本文作者:杉杉
导读
氮取代的炔基化合物,例如炔胺 (ynamines)与炔酰胺化合物 (ynamides),是有机化学中的重要合成砌块。并且,与炔胺以及炔酰胺相比,具有额外亲核与亲电中心的炔亚胺 (ynimines)化合物,具有更高的合成应用价值。然而,由于缺乏一种行之有效的合成策略,致使炔亚胺化学反应活性的相关研究,较少有文献报道。近日,瑞士Lausanne联邦理工学院的祝介平教授课题组在Angew. Chem. Int. Ed.中发表论文,报道一种采用铜催化剂促进的O-乙酰基酮肟 (O-acetyl ketoximes)与端炔之间的aza-Sonogashira交叉偶联反应方法学,进而以良好至优良的反应收率,成功实现一系列炔亚胺分子的构建。此外,借助原位形成的炔亚胺化合物独特的反应活性,作者进一步设计出一种全新的[5+1]杂环化 ([5+1] heteroannulation)反应策略,进而顺利完成一系列具有药学研究价值的杂环分子的构建,例如异喹啉、氮杂吲哚、氮杂苯并呋喃、氮杂苯并噻吩以及咔啉等。
Copper-Catalyzed Aza-Sonogashira Cross-Coupling to Ynimines: Development and Application to the Synthesis of Heterocycles
R. Lavernhe, R. O. Torres-Ochoa, Q. Wang, J. Zhu, Angew. Chem. Int. Ed. 2021, ASAP. doi: 10.1002/anie.202110901
正文
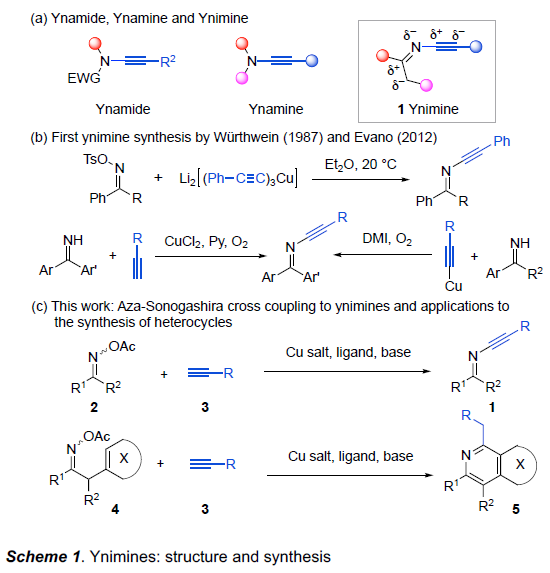
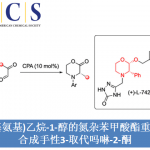
受到有机合成化学家在设计有效并实用的反应策略,实现各类炔酰胺分子构建的相关研究报道 (Scheme 1a)的启发,在本世纪之交,稳定形式的炔胺化合物作为一种多功能砌块 (multifunctional building block),在有机合成研究中已经获得广泛应用。并且,在过去的二十年中,通过炔胺砌块,已经成功设计出多种不同类型的合成转化策略[1]。而炔亚胺化合物作为炔胺化合物的一种重要变体,具有额外的亲电与亲核碳中心。然而,炔亚胺化学则有待进一步的研究。1987年,Würthwein课题组[2]报道通过对甲苯磺酰氧基酮肟与高级有机铜酸盐之间的偶联过程,进而成功首次完成各类炔亚胺化合物的合成。同时,该小组观察到,通过上述策略制备出的两种不同类型 (R = Ph与Me)的炔亚胺化合物,在空气中仅能够稳定存在几小时 (Scheme 1b)。2012年,Evano课题组[3]通过亚胺与炔基化合物或炔基铜配合物之间的氧化交叉偶联反应方法学,同样成功实现各类炔亚胺分子的构建。然而,由于炔亚胺分子的合成策略极为有限,因此,对其化学反应活性的研究目前极少有相关的研究报道[4]。
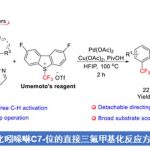
而Evano课题组报道的通过铜催化剂促进的亚胺与端炔之间的氧化交叉偶联反应方法学,为炔亚胺分子的合成开辟出一条最具原子经济性的反应路线。然而,在铜盐与乙炔铜以及氧气存在的条件下,端炔能够较为容易地进行二聚。此外,多数一级亚胺底物,尤其采用芳烷基酮与二烷基酮形成的一级亚胺,通常难以制备,并缺乏相应的稳定性。同时,上述的一级亚胺分子在铜催化剂存在的条件下,能够经历进一步的二聚过程,形成相应的二嗪副产物[5]。因此,通常需要采用过量并且难以制备的一级亚胺底物,进而促进预期的交叉偶联反应过程的顺利进行。受到上述研究报道的启发,接下来,作者设想,能否选择更为廉价易得并具有良好稳定性的肟酯作为亚胺基结构单元的供体[6],进而能够良好地实现亚胺基的N-炔基化反应方法学。基于上述的研究设想,瑞士Lausanne联邦理工学院的祝介平教授课题组报道一种铜催化的O-乙酰基肟2与端炔3之间的aza-Sonogashira交叉偶联反应方法学,进而成功完成一系列炔亚胺化合物1的合成。同时,借助炔亚胺化合物的多重反应活性,该小组进一步设计出肟酯4与端炔3之间的形式[5+1]杂环化反应 (formal [5+1] heteroannulation)策略,进而合成出一系列具有医药研究价值的杂环分子5,例如异喹啉、氮杂吲哚、氮杂苯并呋喃、氮杂苯并噻吩以及咔啉等 (Scheme 1c)。
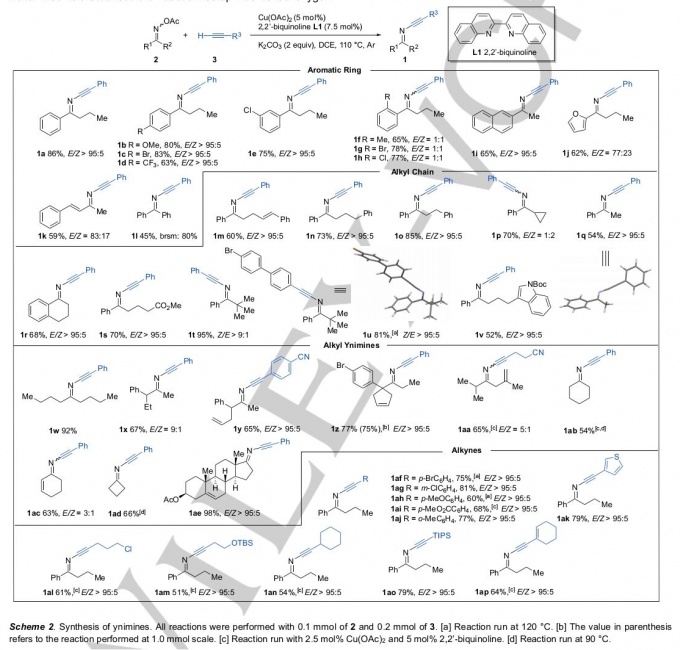
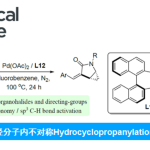
首先,作者采用O-乙酰基酮肟2a (R1 = Ph,R2 = nPr)与苯乙炔 (R = Ph,3a)作为模型底物,进行相关偶联反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Cu(OAc)2作为催化剂,2,2′-二喹啉 (L1)作为配体,K2CO3作为碱,在DCE反应溶剂,反应温度为110 oC,并在氩气气氛中进行反应,最终获得86%收率的偶联产物1a,E/Z > 95:5。
在上述的最佳反应条件下,作者对相关底物的应用范围进行考察 (Scheme 2)。研究表明,在O-乙酰基酮肟底物2中的R1基团为不同基团取代的芳基、萘基、呋喃基以及苯乙烯基时,均能够较好地与上述反应的最佳反应条件兼容,并获得相应的偶联产物1a–1l,收率为45-86%。同时,研究发现,底物2中的R2为各类具有不同基团连接的烷基链或烷基时,同样能够顺利参与上述的偶联过程,并获得相应目标产物1m–1v,收率为52-95%。同时,作者发现,非环脂肪族肟酯 (1w–1aa)以及环酮肟酯 (1ab–1ae)在上述的标准反应条件,同样能够顺利地参与相应的aza-Sonogashira交叉偶联过程,并获得相应的炔亚胺产物。接下来,作者对一系列端炔底物的应用范围进行深入研究。该小组发现,芳环中带有吸电子与供电子基团取代的芳基乙炔 (1af–1aj)、烷基取代的端炔 (1al–1an)、乙炔基三异丙基硅烷 (1ao)以及1,3-烯炔 (1ap),在上述的标准反应条件下,均能够顺利进行上述的偶联反应。同时,作者观察到,上述的aza-Sonogashira交叉偶联过程具有优良的官能团兼容性。值得注意的是,上述的所有炔亚胺目标产物均能够通过常规的硅胶快速柱色谱进行分离纯化。接下来,作者通过单晶X-射线衍射分析,对炔亚胺产物1q 与1u的立体化学进行研究。实验观察到,通过上述偶联过程获得的炔亚胺产物1q为E-立体异构体,而对于具有较高立体位阻基团叔丁基存在的炔亚胺产物1u则为Z-立体异构体。其中,在E–1q中,苯环与C=N共平面,而Z–1u中,为避免苯环邻位C-H键与三键之间不利的立体相互作用,苯环与亚胺官能团位于几乎垂直的位置。因此,上述aza-Sonogashira交叉偶联过程中的E/Z 选择性受到立体效应与立体电子效应的控制。由此,作者假设,产物1f-1h中,无法实现优良立体选择性控制的原因在于:反应过程中,上述的立体效应与立体电子效应的控制存在相互抵消。最后,作者进一步发现,肟酯底物的立体构型对于炔亚胺产物立体构型的控制,几乎无显著的贡献。
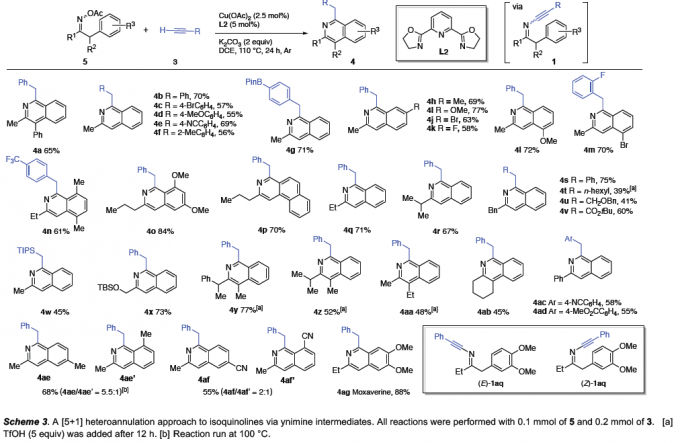
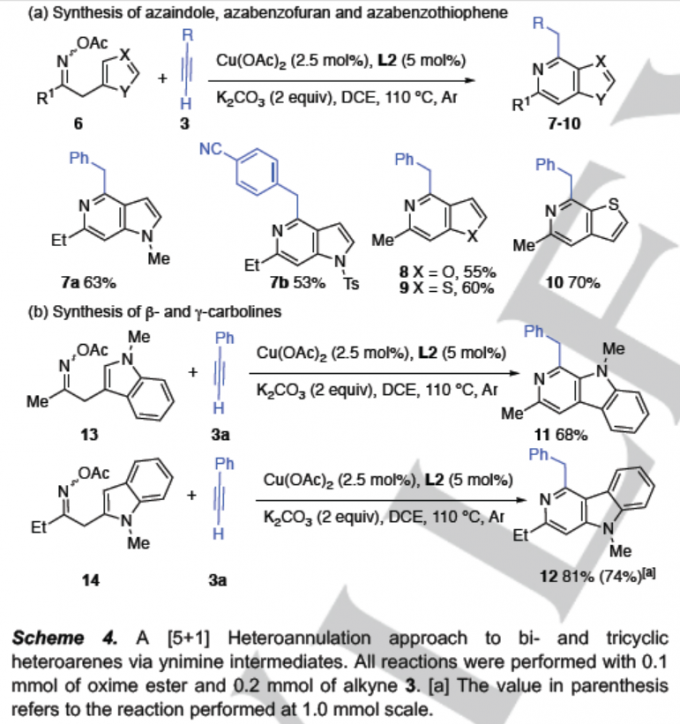
异喹啉化合物4是一种较为重要的杂环分子,广泛存在于各类生物活性天然产物、药物以及功能材料中。近期,研究发现,采用过渡金属催化的芳基酮O-酰基肟与炔基化合物之间的[4+2]杂环化反应方法学[7],能够有效地完成一系列异喹啉分子的构建。然而,这一策略在采用非对称炔基化合物或端炔作为底物时,却缺乏良好的区域选择性控制[8]。为解决上述问题,作者通过对肟酯 5a与苯乙炔作为模型底物,进行[5+1]杂环化方法学中具体反应条件进行优化筛选。进而确定最佳的反应条件为:采用Cu(OAc)2作为催化剂,L2作为配体,K2CO3作为碱,在DCE溶剂,反应温度为110 oC以及氩气气氛中进行反应,最终能够获得65%收率的异喹啉产物4a (Scheme 3)。之后,作者对上述杂环化策略中的底物应用范围进行深入研究。作者发现,芳基中带有强供电子 (4d)或吸电子基团 (4e,4ac,4ad)取代的芳基乙炔以及烷基乙炔底物 (4s–4u),均能够顺利地完成相应的杂环化过程。同时,研究发现,上述的最佳反应条件对于Sonogashira型交叉偶联反应的不良底物,即缺电子的炔基化合物 (如丙炔酸酯)同样能够良好地兼容,并获得60%的收率的异喹啉产物4v。同时,该小组发现,肟酯底物的苯环中存在供电子或吸电子 (4af/4af′)基团取代时,同样能够良好地兼容。此外,该小组进一步发现,这一全新的杂环化策略同样能够较好地应用于市售的血管扩张剂 (marketed vasodilator)moxaverine (4ag)的合成,收率为88%。并且,该小组观察到,这一全新的杂环化策略具有极为优良的官能团兼容性。同时,通过对反应过程的监控表明,炔亚胺为上述杂环化过程的重要中间体。并且,研究表明,在环化过程的反应速率较为缓慢时,向反应混合物中加入三氟甲磺酸 (5 eq),能够有效地加快环化过程的进行 (4t,4x–4aa,5c–5i)。同时,实验观察到,将分离出的炔亚胺混合物E–1aq与Z–1aq (1.9:1)重新加入至上述杂环化反应体系时,能够获得83%收率的杂环产物4ag,同时,在反应过程中E/Z比无显著改变,进而表明E/Z异构化并非上述杂环化过程的决速步骤。
接下来,该小组发现,采用杂环芳烃衍生的肟酯6作为反应底物,在上述的标准反应条件下,同样能够顺利地与端炔衍生物3进行反应,并获得相应的杂环分子7a–7b以及8–10,收率为53-70%。同时,研究发现,采用C-3与C-2取代的吲哚底物13以及底物14,与3a之间进行的杂环化过程,能够获得具有良好反应收率的β-咔啉11以及γ-氮杂咔唑产物12 (Scheme 4b)。
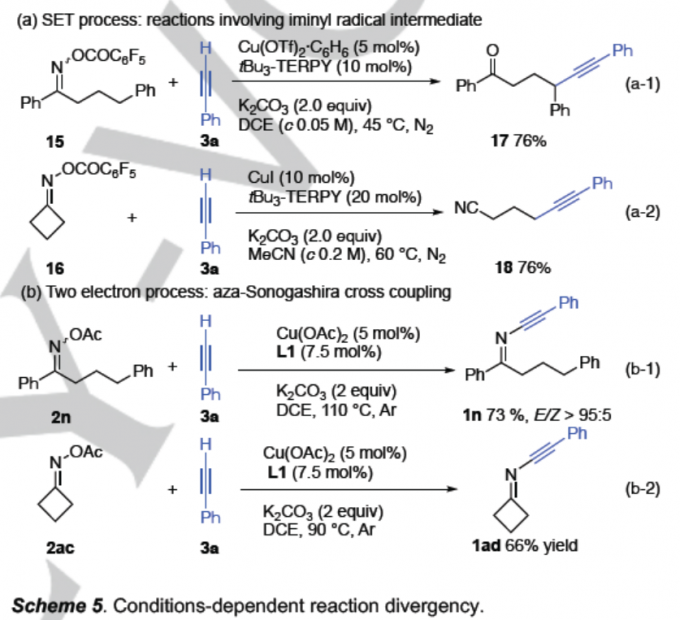
在Cu催化剂存在下,通过亚胺基自由基中间体进行的γ,δ-不饱和O-酰基肟[9]以及β,δ-不饱和O-酰基肟[10]参与的环化反应策略,进而实现二氢吡咯与吡咯衍生物的合成,同样已经有相关的文献报道。然而,在上述的标准反应条件下进行化合物1m、1y以及1aa的制备时,并未观察到上述的竞争反应。同时。近期,研究发现,对于铜催化的苯乙炔 (3a)与肟衍生物15或16之间的反应[11],能够通过1,5-HAT与β-断裂路径,原位产生相应的亚胺基自由基,进而分别获得C(sp3)-H炔基化的酮产物17 (Scheme 5a-1)或腈产物18 (Scheme 5a-2)。尽管已经有上述的反应实例,然而,在本文中的标准反应条件下,3a与2n或2ac之间的反应过程,却能够获得产物1n (Scheme 5b-1)以及1ad (Scheme 5b-2),同时,未观察到竞争性地形成17与18 (Scheme 5b)。此外,作者发现,将自由基捕获剂TEMPO加入至2a与3a的反应体系中,并无法抑制1a的产生。上述实验结果表明,在炔亚胺化合物的形成过程中,可能未涉及亚胺基自由基中间体的参与。
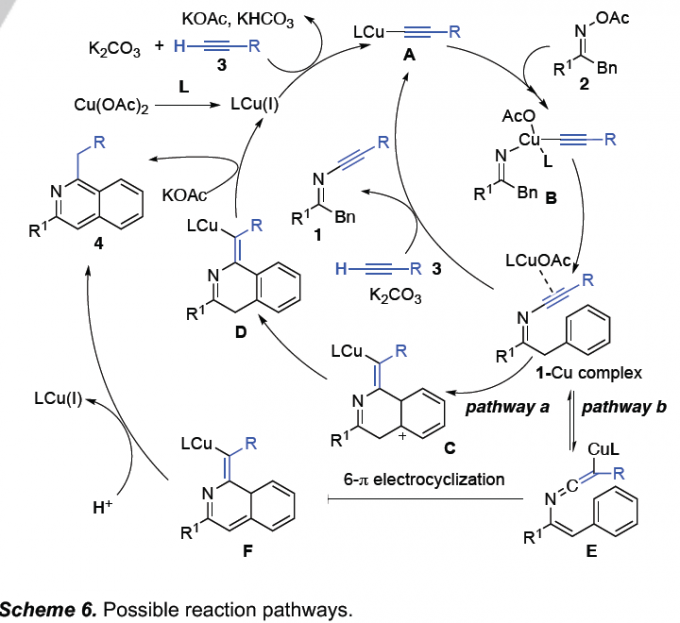
基于上述研究,作者提出一种合理的反应机理 (Scheme 6)。首先,通过碳酸钾促进的原位形成的CuOAc配合物与端炔3之间的反应过程,形成乙炔铜中间体A,之后,通过中间体A与O-乙酰肟化合物2中N-O键进行的氧化加成步骤,形成Cu(III)配合物B。之后,Cu(III)配合物B经历还原消除过程,形成炔亚胺1-Cu(I)配合物,之后继续与端炔3进行配体交换,形成炔亚胺产物1,同时,使乙炔铜配合物A再生,进而完成相应的催化循环过程。接下来,对于炔亚胺化合物1向异喹啉化合物4的转化过程,作者假设,可能存在两种不同的机理路径。Path a中,1-Cu(I)配合物经历Friedel-Crafts型环化过程,形成中间体C,之后,再通过去质子化步骤,转化为中间体D,再经质子化以及芳构化过程,产生异喹啉产物。Path b中,1-Cu(I)配合物与烯氨基-烯酮亚胺 (enamino-ketenimine)E处于平衡状态,并通过6π电环化过程,形成中间体F,之后,经历质子化以及芳构化步骤,形成异喹啉产物4,同时使Cu(I)配合物再生。尽管上述两种机理路径途可能同时进行,然而,作者进一步通过对于(E)/(Z)-炔亚胺化合物的环化形成异喹啉产物以及缺电子芳烃能够有效地参与相应环化过程 (Scheme 3, 4af/4af’)的实验观察,进而表明,Path b过程可能更为合理。
总结:瑞士Lausanne联邦理工学院祝介平教授课题组报道一种Cu(OAc)2催化的O-乙酰基酮肟与端炔之间的偶联反应方法学,进而成功实现一系列炔亚胺分子的构建。这一全新的偶联策略具有广泛的底物应用范围、良好的官能团兼容性以及较高的反应收率等优势。同时,通过炔亚胺化合物独特的反应活性,作者进一步设计出一种全新的[5+1]杂环化反应策略,进而合成出一系列具有药学研究价值的杂环化合物分子,例如异喹啉、氮杂吲哚、氮杂苯并呋喃、氮杂苯并噻吩以及咔啉等。
参考文献:
[1] G. Evano, A. Coste, K. Jouvin, Angew. Chem. Int. Ed. 2010, 49, 2840. doi: 10.1002/anie.200905817. [2] E. U. Würthwein, R. Weigmann, Angew. Chem. Int. Ed. 1987, 26, 923. doi: 10.1002/anie.198709231. [3] A. Laouiti, M. M. Rammah, M. B. Rammah, J. Marrot, F. Couty, G. Evano, Org. Lett. 2012, 14, 6. doi: 10.1021/ol2032152. [4] a) W. M. David, S. M. Kerwin, J. Am. Chem. Soc. 1997, 119, 1464. doi: 10.1021/ja962328r.b) J. Hoffner, M. J. Schottelius, D. Feichtinger, P. Chen, Am.Chem. Soc. 1998, 120, 376.doi: 10.1021/ja9730223.
c) L. Feng, A. Zhang, S. M. Kerwin, Lett.2006, 8, 1983. doi: 10.1021/ol0600638.
d) A. Laouiti, F. Couty, J. Marrot, T.Boubaker, M. M. Rammah, M. B. Rammah, G. Evano, Lett.2014, 16, 2252. doi: 10.1021/ol500749h.
[5] a) A. Laouiti, M. M. Rammah, M. B. Rammah, J. Marrot, F. Couty, G. Evano, Org. Lett. 2012, 14, 6. doi: 10.1021/ol2032152.b) A. Laouiti, K. Jouvin, F. Bourdreux, M. Rammah, M. B. Rammah, G. Evano, Synthesis2012, 44, 1491. doi: 10.1055/s-0031-1289760.
[6] a) K. Narasaka, M. Kitamura, Eur. J. Org. Chem. 2005, 4505. doi: 10.1002/ejoc.200500389.b) J. Race, I. R. Hazelden, A. Faulkner, J. F. Bower, Chem. Sci. 2017, 8, 5248. doi: 10.1039/C7SC01480E.
[7] a) T. Gerfaud, L. Neuville, J. Zhu, Angew. Chem. Int. Ed. 2009, 48, 572. doi: 10.1002/anie.200804683.b) K. Parthasarathy, C. H.Cheng, Org. Chem. 2009, 74, 9359. doi:10.1021/jo902084j.
c) P. C. Too, Y. Wang,S. Chiba, Org. Lett. 2010, 12, 5688. doi: 10.1021/ol102504b.
[8] R. M. Martin, R. G. Bergman, J. A. Ellman, J. Org. Chem. 2012, 77, 2501. doi: 10.1021/jo202280e. [9] K. Narasaka, M. Kitamura, Eur. J. Org. Chem. 2005, 4505. doi: 10.1002/ejoc.200500389. [10] W. Du, M. N. Zhao, Z. H. Ren, Y. Y. Wang, Z. H. Guan, Chem. Commun. 2014, 50, 7437. doi: 10.1039/C4CC03129F. [11] a) Z. Li, R. O. Torres-Ochoa, Q. Wang, J. Zhu, Nat. Commun. 2020, 11, 403. doi: 10.1038/s41467-020-14292-2.b) H. Zuo, S.S. Zhu, W. J. Hao, S. C. Wang, S. J. Tu, B. Jiang, ACS Catal. 2021, 11, 6010. doi: 10.1021/acscatal.1c00842.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.