本文投稿作者: 大白菜
概述
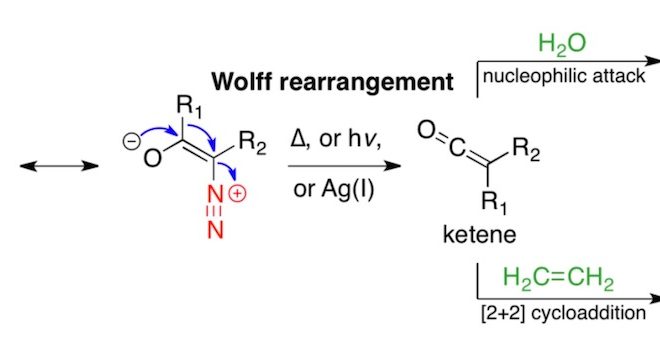
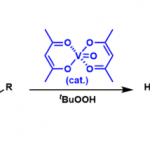
α-重氮酮在加热、光照或者过渡金属催化的条件下消除氮气,形成卡宾之后进行重排得到烯酮的反应称为Wolff 重排[1]。烯酮作为中间产物,可以被弱酸性亲核体(水、醇、胺等)进攻,生成羧酸衍生物。也可以与烯烃经[2+2]环化形成四元环。
特点
Wolff重排反应具有如下几个特征:
- (1)如果重排基团包含手性,重排之后,基团的立体构型不变。
- (2)环状重氮酮经过重排收缩,可用于制备有张力的环体系。
- (3)尽管α-重氮酮非常活泼,但是也通过仔细筛选反应条件来避免或者最小化副反应的发生。[2]
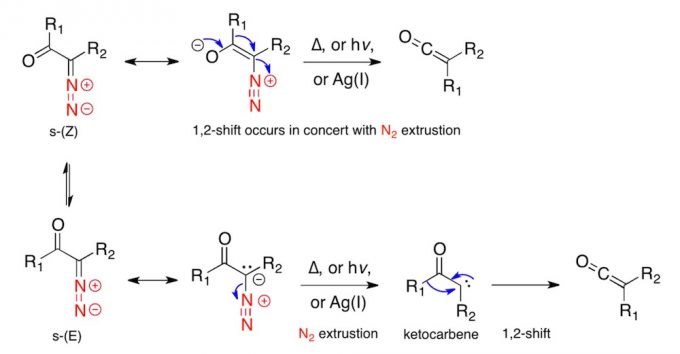
反应机理[2]
反应的实例与应用
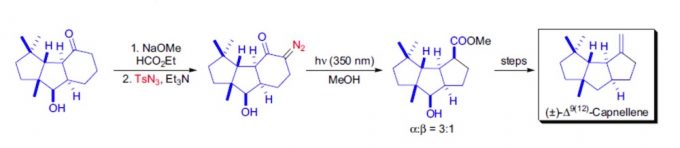
双环酮与叠氮化物在碱性条件下生成α-重氮酮,接着在光照条件下进行Wolff重排,六元环转变成五元环,得到产物的主要碳链骨架。[3]
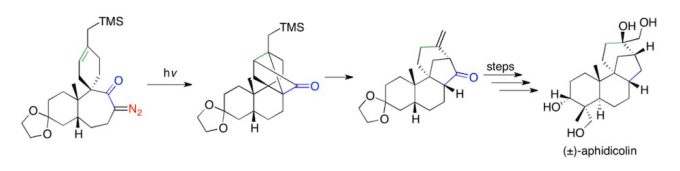
通过wolff重排,经缩环,烯酮与烯[2+2]环化的串联反应,合成(±)-aphidicolin。[4]
参考文献
- Wolff,L. Liebigs Ann. Chem. 1902, 325, 129.
- Gill, G. B. The Wolff rearrangement. in Comp. Org. Synth. (eds. Trost, B. M., Fleming, I.), 3, 887-912 (Pergamon, Oxford, 1991).
- Ihara, M. Suzuki, T. Katogi, M. Taniguchi, N. Fukumoto, K. (1991).”A stereoselective total synthesis of (±)-Δ9(12)-capnellene via the intramolecular Diels-Alder approch”. J. Chem. Soc. Chem. Commun. (9): 646.
- Ireland, R. E. Dow, W. C. Godfrey, J. D. Thaisrivongs, S. (1984). “ Total synthesis of (.+-.)-aphidicolin and (.+-.)-.beta.-chamigrene”. J. Org. Chem. 49 (6): 1001
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.