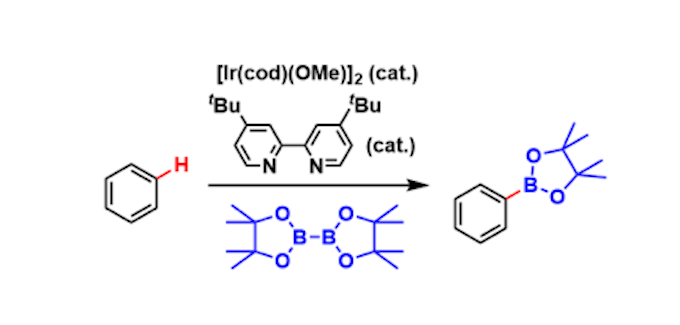
概要
利用铱金属催化剂与给电子性双齿配体,可以不经过芳香卤代烃这一中间体直接进行C-H键活化硼基化反应。作为生成物的有机硼化合物可以作为多种化学官能团转变的中间体,有非常高的化学利用价值。
本反应容易受到芳香环上取代基的立体位阻的影响。因此,ortho-金属化及亲电取代反应较难发生,结果上来看,它可以实现取代芳基的间位选择性官能团化。
利用芳香卤代物做中间体的反应见Miyaura-Ishiyama硼基化反应。
基本文献
- Cho, J. Y.; Tse, M. K.; Holmes, D.; Maleczka, R. E., Jr.; Smith, M. R. Science 2002, 295, 305. DOI:10.1126/science.1067074
- Ishiyama, T.; Takagi, J.; Ishida, K.; Miyaura, N.; Anastasi, N. R.; Hartwig, J. F. J. Am. Chem. Soc.2002, 124, 390. DOI: 10.1021/ja0173019
- Ishiyama, T.; Takagi, J.; Hartwig, J. F.; Miyaura, N. Angew. Chem. Int. Ed. 2002, 41, 3056. [abstract]
- Ishiyama, T.; Nobuta, Y.; Hartwig, J. F.; Miyaura, N. Chem. Commun. 2003, 2924. DOI: 10.1039/B311103B
<review>
- Ishiyama, T.; Miyaura, N. Chem. Rec. 2004, 3, 271. DOI: 10.1002/tcr.10068
- Ishiyama, T.; Takagi, J.; Nobuta, Y.; Miyaura, N. Org. Synth. 2005, 82, 126. DOI: 10.15227/orgsyn.082.0126
- Mkhalid, I. A. I.; Barnard, J. H.; Marder, T. B.; Murphy, J. M.; Hartwig, J. F. Chem. Rev. 2010, 110,890. doi:10.1021/cr900206p
- Hartwig, J. F. Chem. Soc. Rev. 2011, 40, 1992. doi:10.1039/C0CS00156B
- Hartwig, J. F. Acc. Chem. Res. 2012, 45, 864. DOI: 10.1021/ar200206a
- Ros, A.; Femandez, R.; Lassaletta, J. M. Chem. Soc. Rev. 2014, 43, 3229. DOI: 10.1039/C3CS60418G
- Shinokubo, H. Proc. Jpn. Acad. Ser. B. 2014, 90, 1. doi:10.2183/pjab.90.1
- Yang, J. Org. Biomol. Chem. 2015, 13, 1930. DOI: 10.1039/C4OB02171A
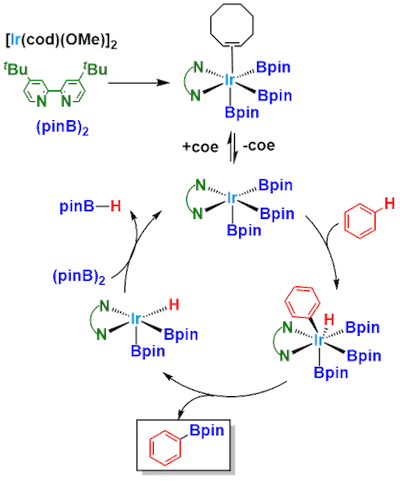
反应机理
铱・配体・Bpin-Bpin(双联频哪醇硼酸酯)混合后生成的fac-trisboryl iridium complex中间体是能催化反应的活性物种。烯烃配体(COD等)离去后会给六配位的Ir(III)留一个空缺位,使得C-H键在此通过氧化加成反应活化。(参考:J. Am. Chem. Soc. 1993, 115, 9329; J. Am. Chem. Soc. 2003, 125, 16114; J. Am. Chem. Soc. 2005, 127, 14263 )
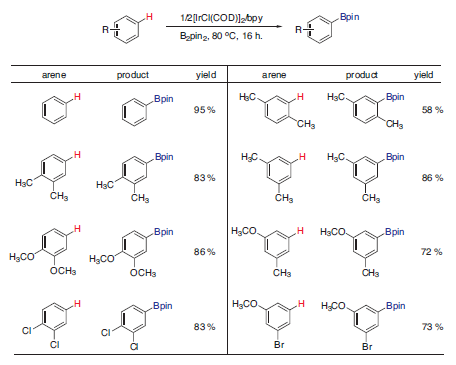
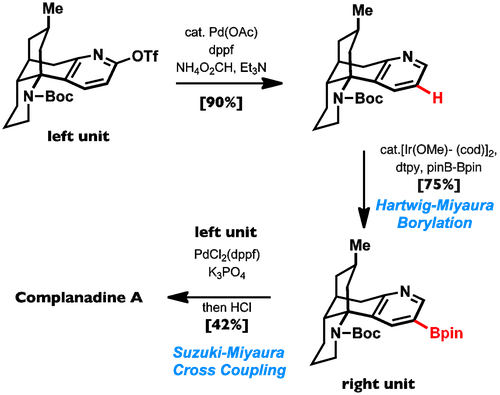
反应实例
因为主要受立体因素的影响,一般在取代基的邻位硼基化反应较为困难。(图片来自这里)
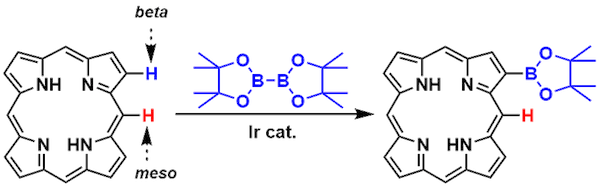
卟啉的β位选择性C-H官能团化[1]
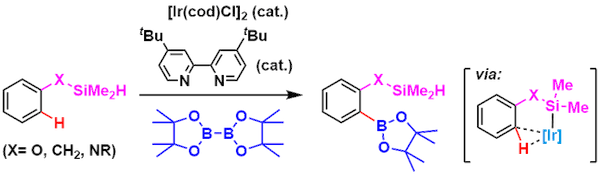
氢硅烷基作为指向基,实现通常条件下较难发生的邻位C-H键硼基化反应。[3]
指向性官能团的存在下,环丙烷[4]以及其他sp3C-H键的硼基化反应也能进行。[5]
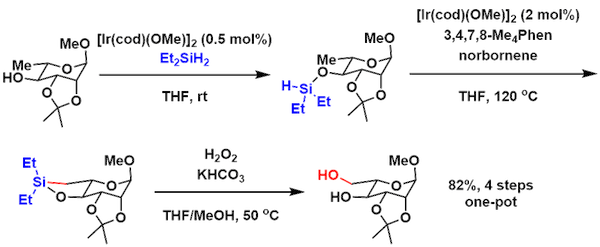
通过对催化剂的调整、以醇羟基做指向基团可活化不太容易活化的sp3C-H键的硅基化[6],之后再通过玉尾氧化转变为醇、这一转化作为一种新型多醇合成法有着很高的利用价值,以下是其在糖合成反应中的应用实例。[7]
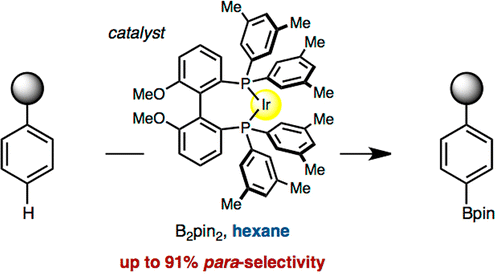
使用大位阻的双齿膦配体与金属铱催化剂能够实现para位的C-H键硼基化反应[8]
用铑催化剂可实现烷烃的终端惰性C-H键的官能团化。[9]
参考文献
- [1] Hata, H.; Shinokubo, H.; Osuka, A. J. Am. Chem. Soc. 2005, 127, 8264. DOI: 10.1021/ja051073r
- [2] Fischer, D.F.; Sarpong, R. J. Am. Chem. Soc. 2010, 132, 5926. DOI: 10.1021/ja101893b
- [3] Boebel, T. A.; Hartwig, J. F. J. Am. Chem. Soc. 2008, 130, 7534.DOI:10.1021/ja8015878
- [4] Liskey, C. W.; Hartwig, J. F. J. Am. Chem. Soc. 2013, 135, 3375. DOI: 10.1021/ja400103p
- [5] (a) Liskey, C. W.; Hartwig, J. F. J. Am. Chem. Soc. 2012, 134, 12422. DOI: 10.1021/ja305596v (b) Li, W.; Liskey, C. W.; Hartwig, J. F. J. Am. Chem. Soc. 2014, 136, 8755. DOI: 10.1021/ja503676d (c) Miyamura, S.; Araki, M.; Suzuki, T.; Yamaguchi, J.; Itami, K. Angew. Chem. Int. Ed. 2015, 54, 846. DOI: 10.1002/anie.201409186
- [6] (a) Simmon, E. M.; Hartwig, J. F. Nature 2012, 483, 70. doi:10.1038/nature10785 (b) Li, B.; Driess, M.; Hartwig, J. F. J. Am. Chem. Soc. 2014, 136, 6586. DOI: 10.1021/ja5026479
- [7] Frihed, T. G.; Heuckendorff, M.; Pedersen, C. M.; Bols, M. Angew. Chem. Int. Ed. 2012, 51, 12285. DOI: 10.1002/anie.201206880
- [8] Saito, Y.; Segawa, Y.; Itami, K. J. Am. Chem. Soc. 2015, 137, 5193. DOI: 10.1021/jacs.5b02052
- [9] Chen, H.; Schlecht, S.; Semple, T. C.; Hartwig, J. F. Science 2000, 287, 1995. DOI:10.1126/science.287.5460.1995
关联书籍
[amazonjs asin=”0471112801″ locale=”US” title=”Organic Synthesis Via Boranes”] [amazonjs asin=”3527325980″ locale=”US” title=”Boronic Acids: Preparation and Applications in Organic Synthesis, Medicine and Materials”] [amazonjs asin=”3527331549″ locale=”US” title=”Metal Catalyzed Cross-Coupling Reactions and More, 3 Volume Set”] [amazonjs asin=”148223310X” locale=”US” title=”C-H Bond Activation in Organic Synthesis”]
相关反应
- 金属催化C-H活化反应 Catalytic C-H activation
- Brown硼氢化-氧化反应 Brown Hydroboration
- 铃木-宮浦偶联反应 Suzuki-Miyaura Cross Coupling
- 宫浦硼化反应 Miyaura-Ishiyama Borylation
外部链接
- Ir-catalyzed C-H borylation (Sigma-Aldrich)
- John F. Hartwig Group
- Borylation – Wikipedia
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载


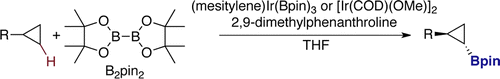
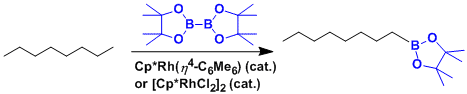















No comments yet.