概要
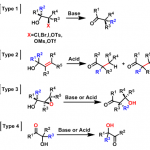
Effenberger环化(Effenberger cyclization),又称为Effenberger α,α′环化(Effenberger α,α′-annulation)是在强碱或Lewis酸催化下,烯醇醚、烯醇硅醚与丙二酰氯反应形成二环[3.3.1]壬烷的反应。该反应1984年由美国Effenberger课题组首次报道[1]。目前已广泛用于PPAP(polycyclic polyprenylated acylphloroglucinols )类天然产物的全合成。
基本文献
- [1] K. H. Schonwalder, P.Kollatt, J. J.Stezowski, F. Effenburger, Chem. Ber. 1984, 117, 3280. doi: 10.1002/cber.19841171113.
- [2] P. Nuhant, M. David, T. Pouplin, B. Delpech, C. Marazano, Org. Lett. 2007, 9, 287. doi: 10.1021/ol062736s.
- [3] T. Kappe, Monatsch. Chem. 1967, 98, 874. doi: 10.1007/BF00901390.
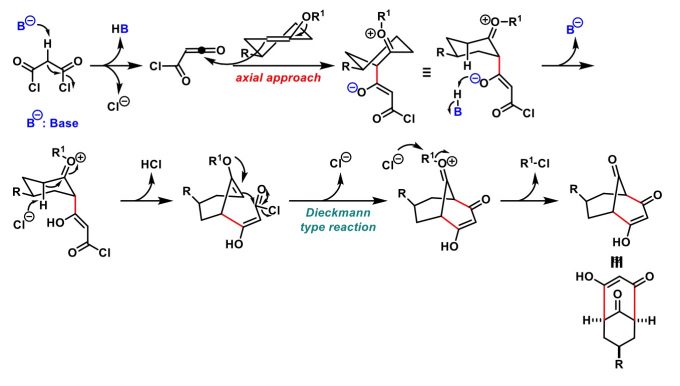
反应机理
碱催化
Lewis 酸催化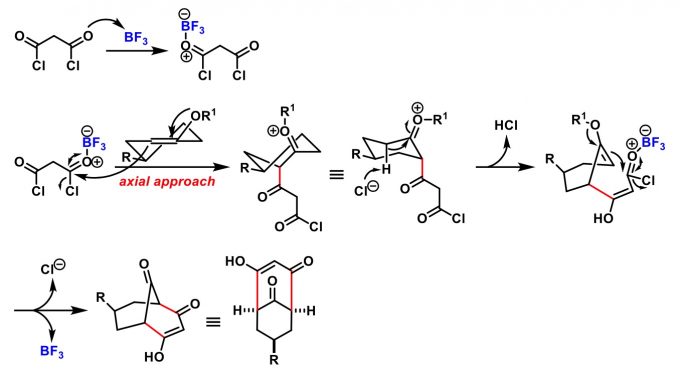
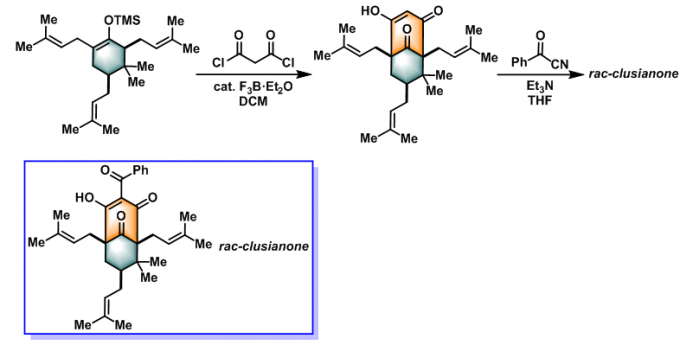
反应实例
(±)-clusianone 的合成[1]
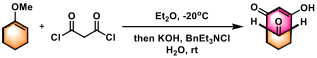
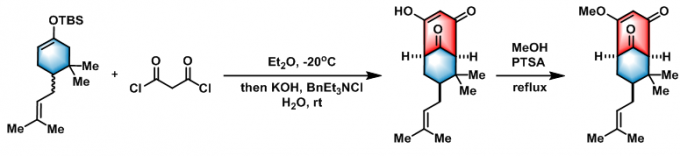
二环[3.3.1]壬烷衍生物的合成[2]
实验步骤
在-20 °C (干冰/CCl4浴)下,向烯醇醚(1eq.)的Et2O溶液(1.1 M) 中滴加丙二酰氯(1 eq.)。将上述反应混合物在-20°C下搅拌24小时后,先加入苄基三乙基氯化铵( 0.05 equiv), 后加入KOH (4 equiv) 的水溶液 (4.5 M)。随后,将反应混合物升至室温,继续搅拌5小时。反应结束后,将反应液用水及石油醚(1:1v/v)稀释,并用2M NaOH调节pH 到10。分离出有机相,水相继续用石油醚萃取,将合并的有机相用无水MgSO4干燥并减压除去溶剂。粗产物采用柱色谱 (石油醚/EtOAc 95/5 v/v 作为洗脱剂)进行分离纯化获得最终目标产物。
实验技巧
参考文献
- [1] P. Nuhant, M. David, T. Pouplin, B. Delpech, C. Marazano, Org. Lett. 2007, 9, 287. doi: 10.1021/ol062736s.
- [2] W. S. Johnson, B. E. McCarry, R. L. Markezich, S. G. Boots, J. Am. Chem. Soc. 1980, 102, 352. doi: 10.1021/ja00521a057.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!














No comments yet.