醛→醇、烯
- 概要
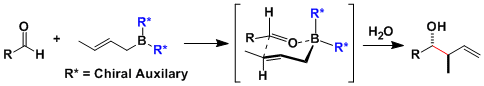
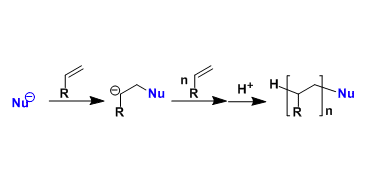
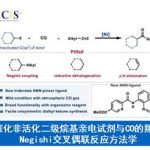
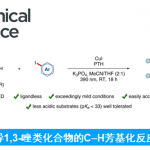
・有手性辅助基团的烯丙基硼烷和醛反应,能够高立体选择性得到手性的单烯丙基醇。这种高立体选择性能够继续精细有机合成之中起到作用,最终目的是得到复杂的锁状化合物,和埃文斯羟醛反应一样时常被用到。
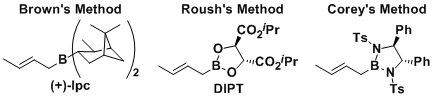
・被报道的有各种各样的方法,但是在这之中最常用的是diisopinocampheylborane法(Brown)和酒石酸酯法(Roush)。
・底物是酮的话,选择性会降低很多。
- 基本文献
・Brown, H. C.; Yadav, P. K. J. Am. Chem. Soc. 1983, 105, 2092. DOI: 10.1021/ja00345a085
・Roush, W. R.;Walts, A. E.; Hoong, L. K. J. Am. Chem. Soc. 1985, 107, 8186. DOI: 10.1021/ja00312a062
・Corey, E. J.;Yu, C. M.; Kim, S. S. J. Am. Chem. Soc. 1989, 111, 5495. DOI: 10.1021/ja00196a082
- 反应机理
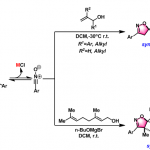
反应经过上图中所示的六圆环中间体状态。由此,从E体的烯丙基硼烷变成anti体、Z体变成syn体的手性醇。
B-O键比较短的缘故、一般六圆环中间态更加牢固,从而选择性更加的高。
- 反应实例
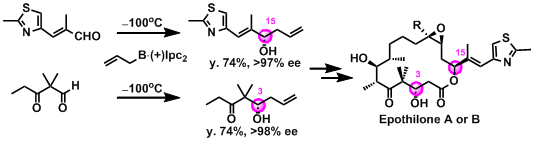
锁式・大环内脂系抗生物质的合成里频繁被使用。
例) Epothilone类的合成[1]
例)酮/酮亚胺的不对称烯丙基碰硼化[2a,2b] 柴崎等人用烯丙基頻哪醇硼烷,使原本反应性较低的酮·酮亚胺做亲电试剂不对称催化烯丙基化反应得以实现。近年Shaus等人[2c]用BINOL衍生物实现了更简单的方法。
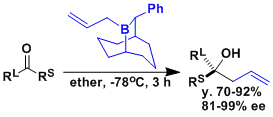
Soderquist等人近年开发的手性烯丙基硼烷、即使是酮做底物也能高选择性进行反应[3]。
- 实验步骤
- 实验技巧
- 参考文献
[2] (a) Wada, R.; Oisaki, K.; Kanai, M.; Shibasaki, M. J. Am. Chem. Soc. 2004, 126, 8910. DOI: 10.1021/ja047200l (b) Wada, R.; Shibuguchi, T.; Makino, S.; Oisaki, K.; Kanai, M.; Shibasaki, M. J. Am. Chem. Soc. 2006, 128, 7687. DOI: 10.1021/ja061510h (c) Lou, S.; Moquist, P. N.; Schaus, S. E. J. Am. Chem. Soc. 2006, 128, 12660. DOI: 10.1021/ja0651308
[3] (a) Burgos, C. H.; Canales, E.; Matos, K.; Soderquist, J. A. J. Am. Chem. Soc. 2005, 127, 8044. DOI: 10.1021/ja043612i (b) Canales, E.; Prasad, K. G.; Soderquist, J. A. J. Am. Chem. Soc. 2005, 127, 11572. DOI: 10.1021/ja053865r
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!