本文作者:杉杉
导读
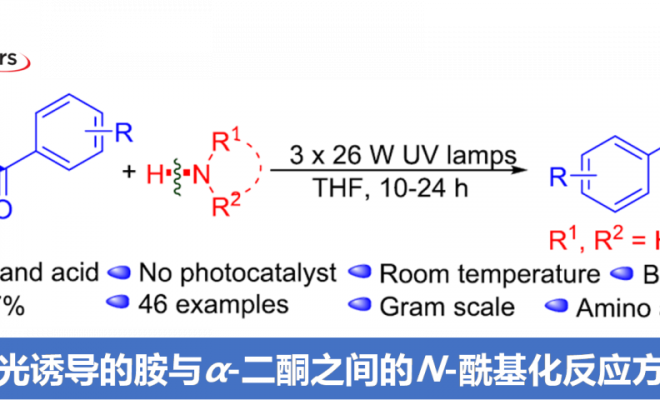
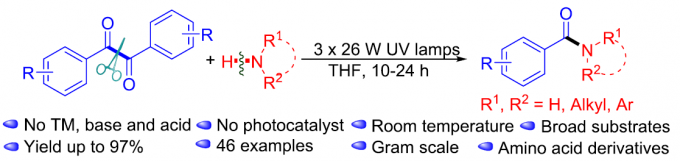
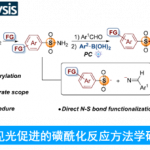
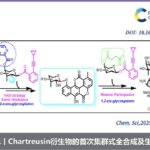
近日,湖南大学邱仁华教授课题组在Org. Lett.中发表论文,报道一种通过紫外光诱导的α-二酮底物与一级以及二级胺之间的N-酰基化反应方法学。这一全新的方法学策略具有反应条件温和、优良的官能团兼容性以及良好至优良的反应收率等优势。并且,能够成功应用于一系列氨基酸衍生物的合成。同时,机理研究表明,安息香 (benzoin)中间体由苯偶酰底物 (benzil)在紫外线辐射条件下原位形成。
UV-Light-Induced N‑Acylation of Amines with α‑Diketones
Z. Xu, T. Yang, N. Tang, Y. Ou, S. Yin, N. Kambe, R. Qiu, Org. Lett. 2021, 23, 5329. doi: 10.1021/acs.orglett.1c01599.
正文
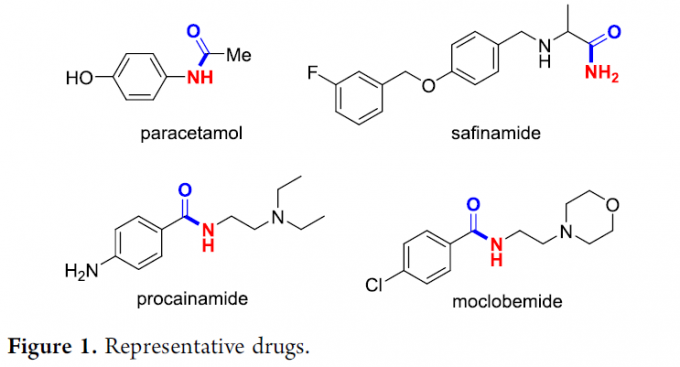
酰胺结构单元广泛存在于药物、农用化学品以及有机功能材料中。并且,部分具有生物活性的酰胺分子目前已经应用于相关疾病的治疗,例如paracetamol、safinamide、procainamide以及moclobemide (Figure 1)。同时,酰胺作为有机合成中的关键砌块,能够应用于一系列不同类型的合成转化过程。
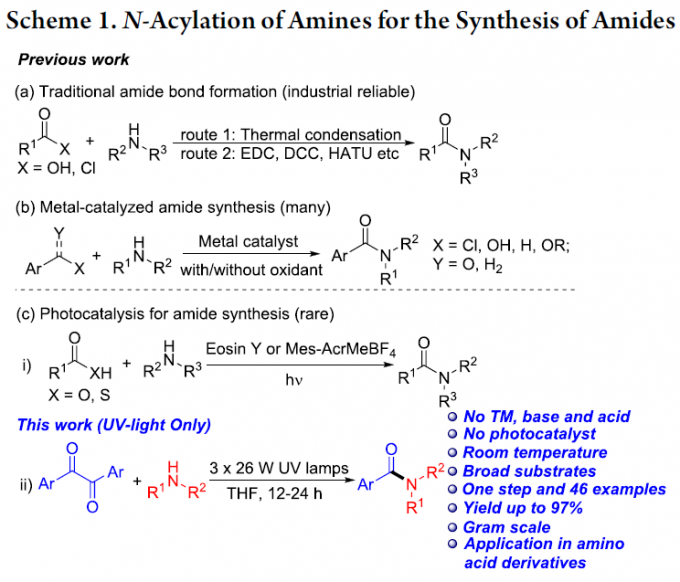
构建酰胺分子的传统方法学策略主要涉及如下四类:羧酸与胺的活化[1]、羧酸底物的单独活化[2]、胺底物的单独活化[3]以及酰基的活化[4]。在工业界的合成研究中,通常采用羧酸与胺之间的热缩合反应 (route 1, Scheme 1a)或选择化学计量或过量的高活性试剂,促进相应缩合过程的进行,例如EDC、DCC以及HATU (route 2, Scheme 1a)。同时,通过金属催化策略进行酰胺分子的构建 (Scheme 1b)已有较多的文献报道[5]。并且,近年来,由于光催化具有清洁性、可持续性以及实验操作简便的优势,已经发展成为构建C-C键与C-Z键的强有力工具[6]。其中,光催化条件下胺分子的N-酰基化反应方法学,已经取得较多的研究进展。例如,Ke等[7]报道在白光LED辐射以及Eosin Y催化剂存在的条件下,羧酸与胺之间的酰胺化反应方法学。Song等[8]报道在蓝光辐射条件下,采用Mes-Acr-MeBF4催化的酰胺键形成策略。
尽管光催化的酰胺化反应方法学研究已取得较大进展,然而,这一策略仍存在较多的局限性,例如,重金属污染、采用过量的起始原料、需要化学剂量的氧化剂与添加剂,并需要外加相应的光催化剂。因此,仍然需要开发一种更加简洁高效与环境友好的反应策略,进而完成各类酰胺分子的构建。为解决上述酰胺化反应方法学中存在的局限性,本文中作者设计出一种在紫外光辐射条件下,通过胺与α-二酮底物,直接构建酰胺分子的反应策略,并且,反应过程中,无需加入添加剂与光催化剂 (Scheme 1c, ii)。
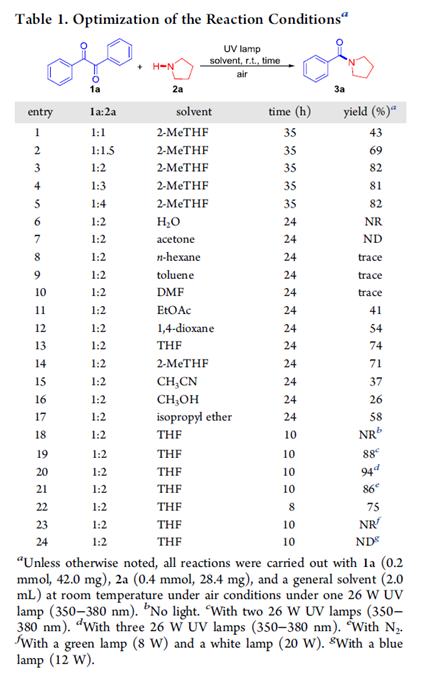
首先,作者采用1a与吡咯烷2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:在紫外光辐射条件下,采用THF作为反应溶剂,室温条件下,反应时间为10h,最终获得94%收率的产物3a (entry 20)。
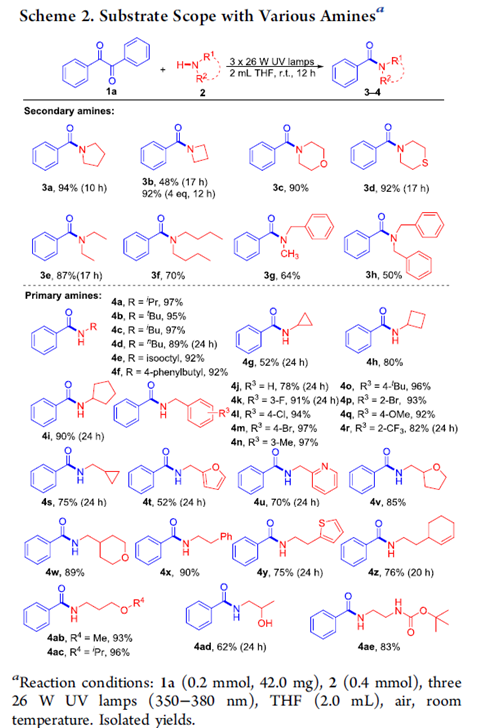
在上述的最佳反应条件下,作者首先对各类二级胺的底物应用范围进行考察 (Scheme 2)。研究发现,上述反应条件对于一系列环二级胺底物2a-2d均能够良好地进行兼容,并获得优良的反应收率 (3a−3d, 90−94% yield)。同时,该小组发现,各类非环二级胺底物,同能够有效地参与相应的N-酰基化过程,并以中等至良好的反应收率获得产物3e–3h。
接下来,作者对各类一级胺的底物应用范围进行研究 (Scheme 2)。该小组观察到,一系列脂肪族非环一级胺底物均能够与上述的标准反应条件良好地兼容,并获得优良反应收率的酰胺产物4a−4f。同时,作者发现,环一级胺同样能够顺利地参与上述的N-酰基化过程,并以52-90%反应收率获得相应酰胺产物4g–4i,接下来,该小组发现,芳基的不同位置中具有吸电子与供电子基团取代的苄胺底物,均能够顺利参与上述的N-酰基化过程,并获得相应的酰胺产物4j–4r。并且,研究表明,环丙基取代的一级胺底物,同样能够与上述最佳反应条件有效地兼容 (4s, 75%)。之后,作者观察到,一系列具有杂环取代基团的一级胺底物,同样能够顺利地完成上述的转化过程,并获得相应目标产物4t–4w与4y,收率为52-89%。此外,上述的标准反应条件对于带有烯基、醚键、羟基以及Boc基团取代的一级胺底物,均表现出良好的官能团兼容性,并以62-96%的收率获得产物4z–4ae。
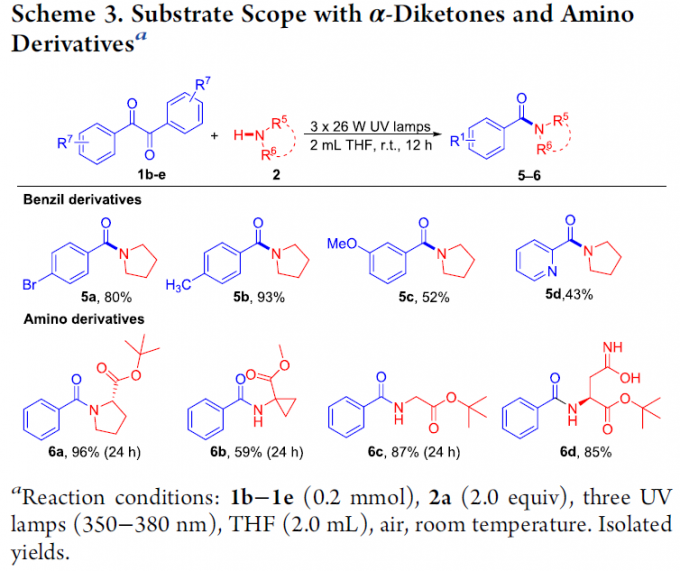
之后,作者对α-二酮底物的应用范围进行深入研究 (Scheme 3)。实验发现,芳基中具有4-Br、4-CH3以及3-OCH3取代的芳香α-二酮底物,均能够有效地进行上述的N-酰基化过程,并获得产物5a–5c,收率为52-93%。同样地,作者发现,上述反应条件对于带有吡啶基取代的α-二酮底物,最终同样能够获得43%收率的酰胺产物5d。此外,作者进一步发现,L-脯氨酸叔丁酯、1-氨基环丙羧酸甲酯、甘氨酸叔丁酯 (tert-butyl glycinate)以及L-天冬酰胺叔丁酯 (L-asparagine tert-butyl ester)底物,在上述的标准反应条件下,均能够可顺利地参与上述转化过程,并以中等至优良的收率 (59-96%)获得相应的酰胺产物6a–6d。
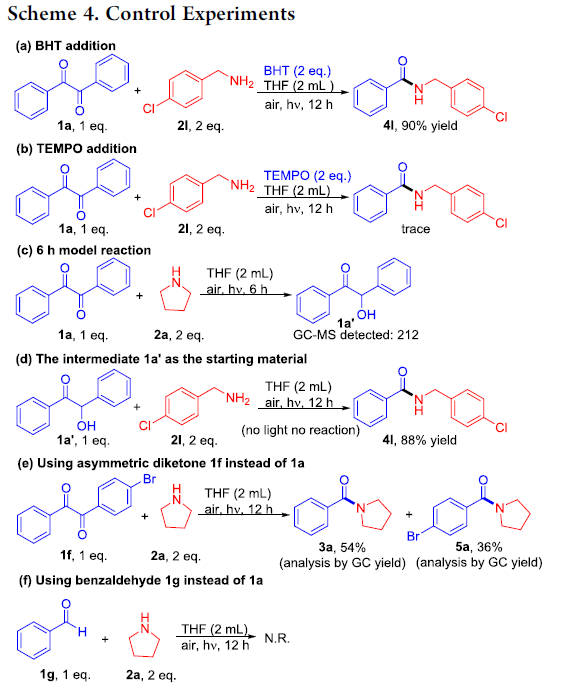
为阐明合理的反应机理,作者接下来进行一系列相关的控制实验研究 (Scheme 4)。首先,在1a与2l的标准反应体系中,加入2 eq. BHT或TEMPO时,作者发现,仅有TEMPO的加入能够显著抑制反应过程的进行。而BHT的加入,则无法抑制反应过程的进行。这可能源自于2eq. 胺的加入,能够抑制相应苯酚产物的形成。进而表明,反应过程中涉及自由基中间体的形成 (Scheme 4a,b)。同时,1a与2a之间的反应,在进行6 h之后,通过GC-MS能够检测出中间体1a´的产生 (Scheme 4c)。接下来,作者观察到,采用中间体1a´作为起始原料,在上述的标准反应条件下,能够顺利地与2l进行反应,并获得88%收率的目标产物4l。同时,作者发现,在缺乏光照的实验条件下,上述转化过程无法顺利地进行。综上结果表明,中间体1a´为反应过程的关键中间体 (Scheme 4d)。此外,作者发现,在采用非对称的二酮底物1f采用参与上述反应时,则能够获得产物3a与5a的混合物 (3a, 54%, and 5a, 36%, Scheme 4e)。同时,在上述的标准反应条件下,作者发现,采用苯甲醛,则无法有效地与相应的吡咯烷底物进行反应 (Scheme 4f)。
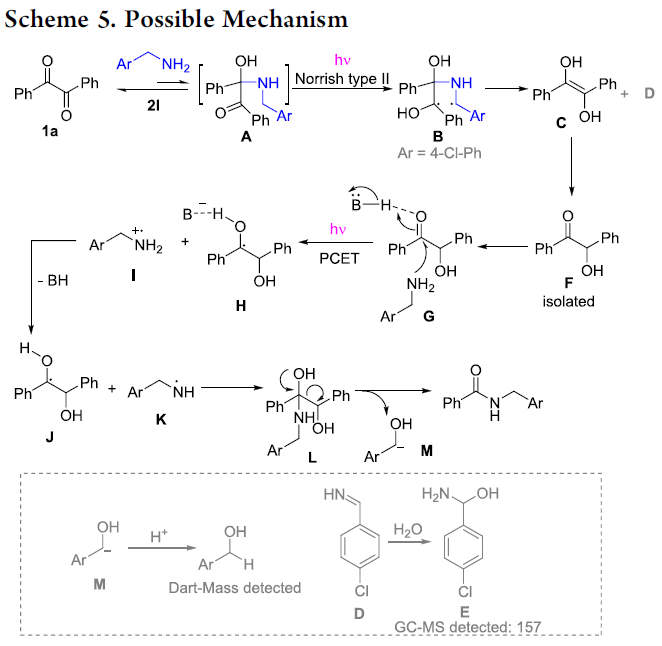
基于上述的控制实验研究,作者提出一种可能的反应机理 (Scheme 5)。首先,4-氯苄胺 2l与二酮化合物 1a通过亲核加成过程,形成中间体 A。接下来,在紫外辐射条件下,通过中间体 A的Norrish II型反应过程,形成自由基中间体 B,之后,中间体 B经历碎片化过程,迅速转化为烯醇化合物 C (通过后续的互变异构化步骤,形成中间体 F)与中间体 D (能够进一步与H2O反应,形成中间体 E)。接下来,胺对中间体 F中的羰基进行进攻,同时,在紫外辐射条件下,通过PCET (proton-coupled electron transfer)过程,进一步形成自由基 H与自由基正离子 I,之后,自由基H与自由基正离子 I进一步转化为自由基 J与K。接下来,氮自由基 K与碳自由基 J进一步结合,形成四面体中间体 L,并通过中间体 L的消除过程,获得预期的酰胺产物。
总结
湖南大学邱仁华教授课题组报道一种无需外部添加剂与光催化剂的反应策略,在紫外光辐射条件下,直接实现α-二酮化合物与一级以及二级胺之间的N-酰基化反应。同时,该反应具有条件温和、底物应用范围广泛、收率良好等优势。此外,上述策略同样能够应用于多种氨基酸衍生物的合成。并且,通过反应机理的研究表明,安息香 (benzoin)中间体由苯偶酰底物 (benzil)在紫外线辐射条件下原位形成。
参考文献
[1] (a) B. S. Jursic, Z. Zdravkovski, Synth. Commun. 1993, 23, 2761. doi: 10.1080/00397919308013807.(b) L. J. Goossen, D. M. Ohlmann, P. P. Lange, Synthesis 2009, 160. doi: 10.1055/s-0028-1083277.
(c) H. Charville, D. A. Jackson, G. Hodges, A. Whiting, M. R. Wilson, Eur. J. Org. Chem. 2011, 5981. doi: 10.1002/ejoc.201100714.
[2] (a) E. Valeur, M. Bradley, Chem. Soc. Rev. 2009, 38, 606. doi: 10.1039/B701677H.(b) J. R. Dunetz, J. Magano, G. A. Weisenburger, Org. Process Res. Dev. 2016, 20, 140. doi: 10.1021/op500305s.
[3] Y. Zhang, D. Riemer, W. Schilling, J. Kollmann, S. Das, ACS Catal. 2018, 8, 6659. doi: 10.1021/acscatal.8b01897. [4] (a) N. Vodnala, R. Gujjarappa, C. K. Hazra, D. Kaldhi, A. K. Kabi, U. Beifuss, C. C. Malakar, Adv. Synth. Catal. 2019, 361, 135. doi: 10.1002/adsc.201801096.(b) G. Yang, K. Li, W. Liu, K. Zeng, Y. Liu, Org. Biomol. Chem. 2020, 18, 6958. doi: 10.1039/D0OB01601B.
[5] (a) I. Guerrero, M. S. Segundo, A. Correa, Chem. Commun. 2018, 54, 1627. doi: 10.1039/C7CC09872C.(b) J. Peng, D. Li, H. Geng, X. Wu, Org. Lett. 2019, 21, 4878. doi: 10.1021/acs.orglett.9b01772.
(c) Z. Li, L. Liu, K. Xu, T. Huang, X. Li, B. Song, T. Chen, Org. Lett. 2020, 22, 5517. doi: 10.1021/acs.orglett.0c01869.
(d) Y. Yuan, F. Wu, C. Schunemann, J. Holz, P. C. J. Kamer, X. Wu, Angew. Chem. Int. Ed. 2020, 59, 22441. doi: 10.1002/anie.202010509.
(e) Z. Fu, X. Wang, S. Tao, Q. Bu, D. Wei, N. Liu, J. Org. Chem. 2021, 86, 2339. doi: 10.1021/acs.joc.0c02478.
[6] (a) A. Kudo, Y. Miseki, Chem. Soc. Rev. 2009, 38, 253. doi: 10.1039/B800489G.(b) H. Liu, L. Zhao, Y. Yuan, Z. Xu, K. Chen, S. Qiu, H. Tan, ACS Catal. 2016, 6, 1732. doi: 10.1021/acscatal.5b02943.
(c) D. M. Schultz, T. P. Yoon, Science 2014, 343, 1239176. doi: 10.1126/science.1239176.
(d) W. Liu, C. Li, Synlett 2017, 28, 2714. doi: 10.1055/s-0036-1590900.
[7] Y. Xu, X. Xu, B. Wu, C. Gan, X. Lin, J. Wang, F. Ke, Asian J. Org. Chem. 2020, 9, 1032. doi: 10.1002/ajoc.202000237. [8] W. Song, K. Dong, M. Li, Org. Lett. 2020, 22, 371. doi: 10.1021/acs.orglett.9b03905.













No comments yet.