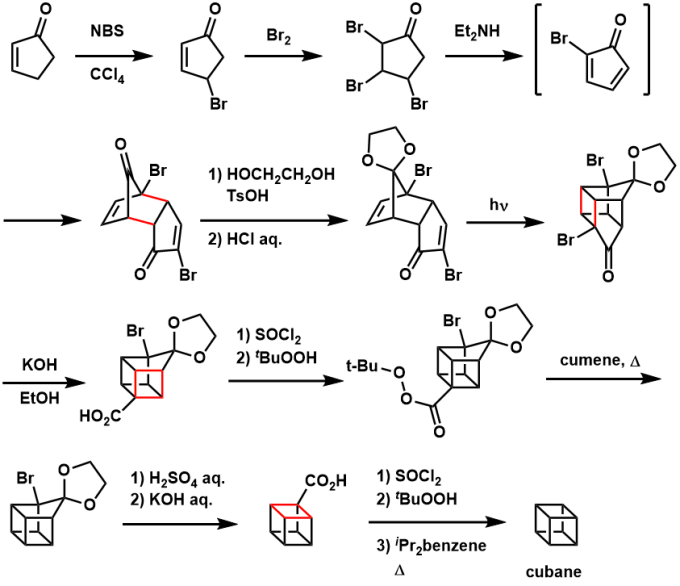
大家知道,有机化合物中的「骰子」是什么吗?
说的就是 立方烷(Cubane)这一碳氢化合物。这样的化合物的存在本身就让我够惊讶的了,竟然还有人已经将它实际合成出来,更让我吃惊不已,话还没完,最近,人们还发现这样的分子还能在医药方面应用,额滴神,我已经惊的不知道该说什么好了。
虽然距离历史上最早实现立方烷的合成已经过去50年了[1]、这一次我们还是围绕立方烷来做一个介绍吧!
立方烷是什么?
立方烷是具有环状碳碳骨架的碳氢化合物C8H8。里面的8个碳原子是完全等同,相比起一般的碳碳键(sp3杂化)有着非常大的环张力。分子尺寸非常小,没有可以立足的官能团,加上环张力很大,可以说是非常难合成的分子之一。
碳原子4元环(环丁烷)的环张力的能量估测有109.9kJ/mol,而立方烷相当于6个这样的环丁烷紧密封闭起来形成立方体笼型骨架、相对更大的环张力(161.5kJ/mol)。所以,人们推测这样的化合物即便合成出来,也会自发的急剧分解。
但是、1964年,Philip Eaton组成功化学合成・分离,比预想结果稳定的结晶性化合物[2]。立方烷结晶有着闪耀的光芒,其晶体像个小菱形(rhombic crystal)、在常压下比室温常温略高的温度会致其升华、封管中测量熔点为133.5℃,另外分解温度在220℃以上。
立方烷的合成
以下是Eaton等人开发的立方烷合成路线[2]。合成的基本策略是由含有张力稍微缓和的5元环分子一点点的缩环来合成了立方烷骨架。
首先是溴代环戊二烯酮这一合成产物作为自发二聚体的重要中间体,在通过适当的保护,有[2+2]光环化反应形成4元环结构的基本骨架。之后再碱性条件下进行Favorskii重排,5元环缩环为4元环。这一系列过程后得到带羧基的立方烷,可以通过自由基脱羰条件来脱去,最终成功实现立方烷的合成。
在那之后、这个合成路线由John Tsanaktsidis等人优化并放大,确立了该物质大规模合成路线(>500g)[3]。
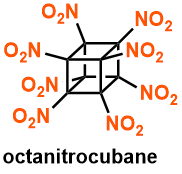
世界最強的炸药:八硝基立方烷
立方烷合成出来后,让人意外的是它竟然比预想的要稳定得多,但是确实含有很大的环张力。人们思考着如果它上面带有不稳定的化学键/官能团、这样的环张力还会更高。
Eaton等人带着这样的思索,设计并于1999年实现了立方烷的顶点碳原子上各带一个硝基取代基的八硝基立方烷的合成。
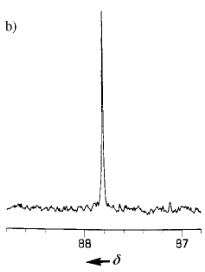
这一分子从理论上来说是世界上最強的炸药,该化合物的合成及结构的确立一度非常艰难。文献[4]中报道的13C NMR图谱如下图所示。也因为它合成起来不容易,所以很难作为实用性的炸药在现实生活中应用
医药中的应用
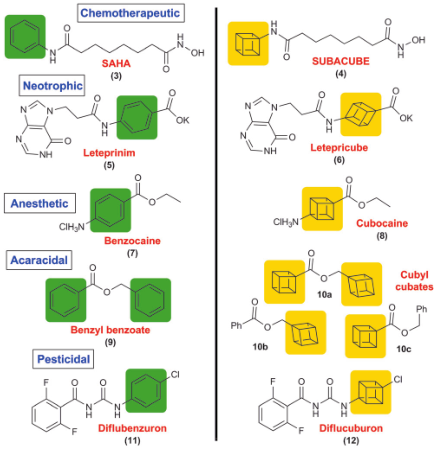
现如今正迎来医药行业的转型期,开发非常有效的小分子医药面临挑战,遭遇瓶颈期。为了解决这样的问题,最近人们开始探索具有特殊结构的builiding block[5]应用在医药中。
立方烷就是这样的实例之一[6]、可以作为苯环生物电子等排体活用在医药研发中。这也是最初实现立方烷合成的Eaton教授的想法[1b]、并通过一些初步研究[5b]了解了这一设想的实效性,直到最近,才使得这一想法得以理论证实。[7]。
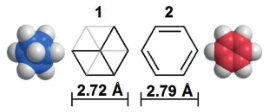
说它们两者相似,怎么看都不觉得,不过按照下图这样斜着的角度去看立方烷的话,就会发现它和苯环有着类似的大小和形状。
事实上,人们已经将一些已有的医药化合物的苯环用立方烷置换(下图)并研究对比这些药物的药理活性,结果显示多数立方烷衍生物有着相同或者更高的活性。原因可以通过非平面结构化是其溶解度增加、稳定的sp3C-H键使其在代谢中具有更好的稳定性这些方面来解释。
结语
除上所述,其他多面体分子、如正四面体烷(带取代基)、正十二面体烷等也都已经成功合成出来。感兴趣的人请参看Platonic Hydrocarbons(PDF)。
(※本文是基于以前Chem-Station 2000/7/3公开过的内容加以修改更新2016/2/7发布)
相关文献
- (a)”Cubane: 50 Years Later” Biegasiewicz, K. F.; Griffiths, J. R.; Savage, G. P.; Tsanaktsidis. J.; Priefer, R. Chem. Rev. 2015, 115, 6719. DOI: 10.1021/cr500523x (b) “Cubanes: Starting Materials for the Chemistry of the 1990s and the New Century” Eaton, P. E. Angew. Chem. Int. Ed. Engl. 1992,31,1421. DOI: 10.1002/anie.199214211
- (a) “The Cubane System” Eaton, P. E.; Cole, T. W. J. Am. Chem. Soc. 1964, 86, 962. DOI: 10.1021/ja01059a072 (b) ”Cubane” Eaton, P. E.; Cole, T. W. J. Am. Chem. Soc. 1964, 86, 3157. DOI: 10.1021/ja01069a041
-
(a) “Barton Decarboxylation of Cubane-1,4-dicarboxylic Acid: Optimized Procedures for Cubanecarboxylic Acid and Cubane” Eaton, P. E.; Nordari, N.; Tsanaktsidis, J.; Upadhyaya. S. P. Synthesis 1995, 501. DOI: 10.1055/s-1995-3961 (b) “Dimethyl Cubane-1,4-dicarboxylate: A Practical Laboratory Scale Synthesis” Bliese, M.; Tsanaktsidis, J. Aust. J. Chem. 1997, 50, 189. doi:10.1071/C97021 (c) “Pilot-Scale Production of Dimethyl 1,4-Cubanedicarboxylate” Tsanaktsidis, J. et al. Org. Process Res. Dev. 2013, 17, 1503. DOI: 10.1021/op400181g
- “Hepta- and Octanitrocubanes” Zhang, M.-X.; Eaton, P. E.; Gilardi, R. “Hepta- and Octanitrocubanes”. Angew. Chem., Int. Ed. 2000, 39, 401. DOI: 10.1002/(SICI)1521-3773(20000117)39:2<401::AID-ANIE401>3.0.CO;2-P
- (a) “New and unusual scaffolds in medicinal chemistry” Marson, C. M. Chem. Soc. Rev. 2011, 40, 5514. DOI: 10.1039/c1cs15119c (b) “Pharmaceuticals that contain polycyclic hydrocarbon scaffolds” Stockdale, T. P.; Williams, C. M. Chem. Soc. Rev. 2015, 44, 7737. DOI: 10.1039/C4CS00477A
-
“Cubanes in Medicinal Chemistry: Synthesis of Functionalized Building Blocks” Wlochal, J.; Davies, E. D. M.; Burton, J. Org. Lett. 2012, 16, 4094. DOI: 10.1021/ol501750k
- “Validating Eaton’s Hypothesis: Cubane as a Benzene Bioisostere” Williams, C. M. et al. Angew. Chem. Int. Ed. 2016,






















No comments yet.