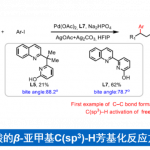
[难道没有一种既不怕空气又不怕水,没有毒性还具有普适性的便宜的催化剂吗?]
要是能够开发出满足以上全部条件的催化剂来,绝对能毫无悬念的将诺贝尔化学奖收入囊中吧。现在只知道人类是可以做到这一点的。本世纪初,闪现出一个接近这一成就的催化剂,那就是有机分子催化剂。即使用仅由碳,氮,氧等元素组成的催化剂来催化反应。虽然含有过渡金属的金属催化剂直到现在还占据主导地位,并且不断被发现能用于相对种类更广泛的化学反应或是连接一些看似不可能的化学键,但可惜的是从它的使用成本和毒性上来考量,同时衡量它的经济效益和大多无法实现生产线生产的话,它其实是好坏参半。另一方面,有机分子催化剂相对与金属催化剂而言则具有了无需考虑其毒性,一般情况下也可以忽视空气和水的影响等这些好处。
正因如此,它看上去是如此的接近诺贝尔化学奖,然而,它的反应活性却仍然是一个短板。一般而言基本古来有之的{离子反应}是有机分子催化剂的主流反应,而相比金属催化剂,它在构造困难的化学键继而所能够合成的分子种类上却非常之有限。它还是一个新兴的方向,这也是没办法的事呀。这句话也就到此为止了。现在,化学工作者们正在拼命地朝着提高它反应活性的方向努力研究着。
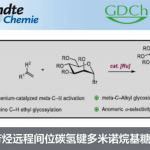
提高有机分子催化剂的反应活性的其中一个方法就是,去离子反应。例如,用高活性的反应中间体自由基引发反应的手法。那么,让我们不再赘述直奔主题。本文向大家介绍京都大学的丸冈启二教授等研究者们,从这些自由基之中发现了{有机硫化物自由基},用它来挑战相对更加特殊的不对称反应,最终实现了“去离子反应”这一成果。
“An organic thiyl radical catalyst for enantioselective cyclization”
Hashimoto, T.; Kawamata, Y, Maruoka, K. Nat. Chem. 2014, ASAP. DOI: 10.1038/nchem.1998
-
有机硫化物自由基催化反应
有机硫化物自由基是一种不稳定的化学中间体,通常以二聚体的(RSSR)形式存在。洋葱中含有的二芳基二硫化物,硫化橡胶中的结构等都是这类化合物。总之它们相对稳定,必须附加一些能量切断SS键才能具有反应活性。而一种让SS键均裂的有效方法就是用光反应。普通的太阳光就能切断它,而研究中通常用能量稍微高于太阳光的汞灯。
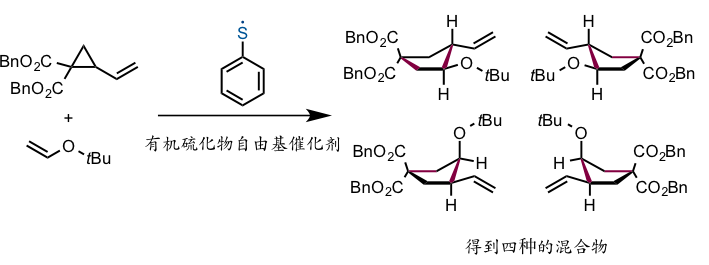
其实,即使是如此不稳定的有机硫化物自由基,事实上目前用它作为催化剂构建出分子的反应也有唯一的一例被报道过。1988年京都大学的大嶌幸一郎教授等人发表过这样的反应,当时称它做自由基环化反应(下图)。[1]
本身是非常单一的催化反应,可惜结果却得到了四种生成物的混合产物(非对映异构体,对映异构体)。丸冈教授想尽可能的通过反应控制分别得到四种异构体,因此重新设计(不对称有机硫化物自由基催化剂)并朝着得到其中一种的方向努力。
-
催化剂的设计
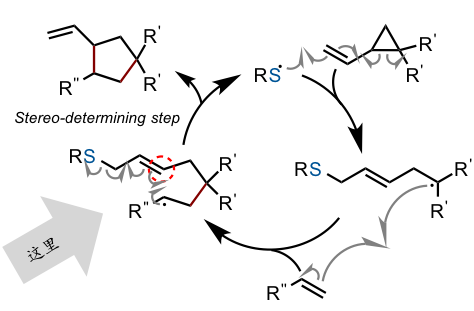
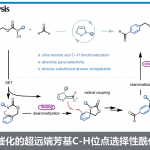
从这里开始我们从更加专业的角度进行论述。这一自由基催化反应的反应机理可由下图解释(下图)。硫化物自由基与原料的加成,环戊烷的开环,另一分子原料的加成,继而关环反应得到产物。图中标示着“这里!”的部分,也就是在新的环生成的阶段,产生了所有的不对称中心,看来针对这一步(非对映异构体,对映异构体)必须要设计出一种能够控制反应的选择性的催化剂才行。
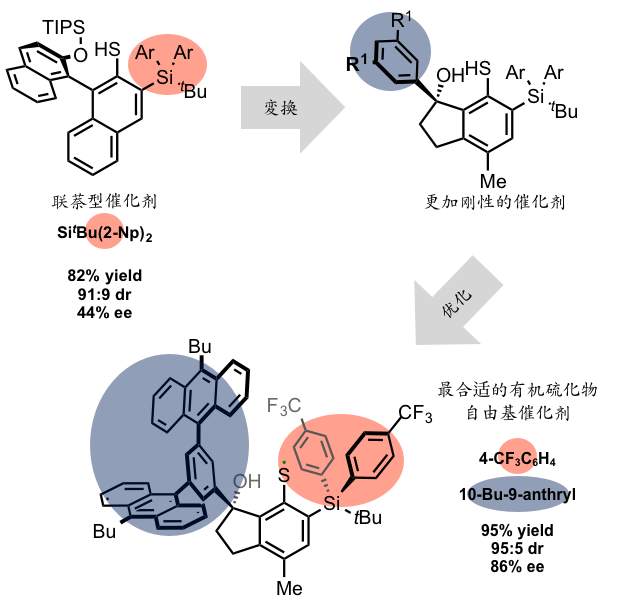
挑战这一难关的人是桥本卓也助教和当时硕士一年级的川又优先生。最初设想的是用含有不对称的联萘结构的有机硫化物自由基催化剂。一开始用二硫化物和光反应对催化剂进行了探讨,可是这种催化剂合成困难因此放弃了,改用由硫醇出发,过氧化苯甲酰加光照的条件生成硫自由基的方法。探讨了各种联萘形式的催化剂,其中最好的结果是下图中红色标注的SiAr2和Sit-Bu(2-Np)2得到了82%的产率和91:9的非对映选择性,和44%的ee值。也就是说,初步实现了将生成物锁定在两个对映异构体,选择性大约在7:3左右。
到此,确定了用联萘型催化剂反应中间体的川又先生,迎来了一决胜负的时刻。大胆放弃了至今为止试用了千百次的联萘构造,为了找寻到一种更加刚直的催化剂结构,使用了萘环三个连在一起的构造。这从理论依据上判断可以称得上是一个十分大胆的事情。而这个设计奏效了,细节省略不提,总之终于被他找到了自由基环化反应的产率被提高到了95%,非对映选择性95:5,更可喜的是对映异构体过剩率86%ee的催化剂。换言之,选择性的得到几乎只有一种异构体(虽不完全)的反应条件被发现了。这是他三年来不分昼夜重复实验探索的辛劳成果。
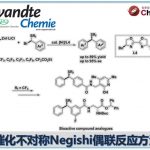
虽然这种有机硫化物催化剂的合成需要十步这么多,可是整体的合成路线确设计的非常精妙。用Newman-Kwart重排和retro thia-brook重排在目标位置(红色部分)引入硅基团,合成的最后阶段变换了设计思路引入了硅基,芳基(下图)。
至于这种催化剂的适用范围,以及一些具体的条件探索的细节,请参阅原著论文。至此,用有机硫化物自由基中间体催化的全新的不对称自由基反应的开发可以说是取得了成功。它不仅仅和目前为止的催化剂设计思路完全不同,最重要的是它是一种反应活性很高的有机分子催化剂。将来的路还有很长,要改良它和继续探索它的应用等等,今后也会继续充满干劲的努力下去。
-
研究者的话
最后,让我们来听一听开发了这一反应的桥本助教和川又先生关于这一研究过程中的一些细节和建议。
至今为止的不对称有机催化剂宏观上概括起来说,也就是分子内官能团的酸,碱性的作用促进了离子反应发生的催化剂。丸冈研究室冲破了这一禁锢,开发出了这种自由基官能团作用的催化自由基反应的新型不对称催化剂。而这一想法的最初的源泉,就来自于1988年大嶌幸一郎教授和Feldman等研究者发现的自由基环化反应,在它的基础上实现了不对称催化。
首先,正式决定展开这一研究之前,自己已经预想到可能会出现对映选择性,然后用联萘的催化剂简单的试了一下反应,得到了5%ee的微妙的结果。另一点,一开始犹豫过这个课题比较难要不要自己亲自来做,最后开始拜托给了川又。他工作非常努力(两年实验数量超过2000个),中途遇到了不少的挫折。但是
- 没有催化剂的条件下反应不进行
- 决定立体选择性的中间体只可能有一个
- 用自由基的立体选择性反应有先例
等等理论上的希望,和已经努力到此不能轻言放弃的觉悟在支持我们继续努力下来。最初让我们觉得,“啊这个反应应该能做成!”的例子,就在生成物的syn-trans比几乎达到单一的时候(论文中table 1,entry 5)。
通过这一研究,我们确信用自由基控制自由基反应的对映选择性是完全可行的。复杂的催化剂,反应温度零度,这样的条件下自由基环化反应终于实现了。只不过反应底物稍微改变一点选择性就会差很多,这一点我们发现是它与至今为止的酸碱反应所不同的地方。另一种观点则是,不从催化剂的构型开始入手,而是针对反应本身来量身定做催化剂也是一种新的途径。
——–橋本 卓也
这个研究课题是由我硕士一年级的时候桥本老师对我说的一句话开始的。
“想用硫自由基做自由基不对称环化反应的话,就加把劲找适合的催化剂吧,拿着,这里是起始物。”
研究的初期开始就已经意识到这个反应最难点就是如何控制反应的对映选择性。活性高的中间体,跟催化剂相隔较远的不对称中心,以及本身就难以控制的自由基反应。和设想的一样,没那么简单就找到能够起作用的催化剂构造。几乎花掉了一年的时间,尝试了近一百种联萘构型的催化剂,几乎每种的合成都要十步以上!而结果却是每一种精心设计引入各类取代基的联萘构造也都无法得到令人满意的对映选择性,几乎就要停手不干了。而打破这一困境的事情就是,当时的最佳反应条件用到的联萘构造的催化剂的反应中间体的结晶构造。在这一构造中,反应中心的硫原子的周围,一半被硅基彻底的覆盖住,不对称的轴的部分怎么转怎么看都有些违和感的萘环引起了我的注意。于是,我保留了硅基,采用了更加稳定的不对称环境的构造来设计改进我的催化剂。
花费了一年的时间终于找到了全新的联萘构型的高选择性催化剂,这可以说是一件幸运的事情。组合出份子模型,用计算化学算出最稳定的配体构造,终于基本设计出这次的催化剂。对于合成路线的探讨,尽量减少了合成的步骤,使最合适的硅基和不对称碳原子上的芳香环在最后才被引入这一点也花费了不少心思。这样就能够在更短的时间里更灵活的改变催化剂的种类,终于找到了最终的催化剂。在课题的中途我数次感觉到绝望,而最终做出了这一全新的催化剂构型,并证明了它在实际反应中的效果,实在是一件值得高兴的事。
——–川又 優
-
参考文献
[1] Miura, K.; Fugami, K.; Oshima, K; Utimoto, K. Tetrahedron Lett. 1988, 29, 5135. DOI: 10.1016/S0040-4039(00)80701-7
-
相关链接
光を受けて働く有機硫黄ラジカル触媒で化学反応を制御する -サステイナブルな有機合成のさらなる発展に期待(京都大学プレスリリース)
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!