概要
极其缺电子的杂环,如四嗪和三嗪、对降冰片烯·反式环辛烯·环辛炔等含有strain C-C多键化合物,显示了高反应性。
这种反应被称为 Strain-Promoted Inverse Electron-demand Diels-Alder Cycloaddition, SPIEDAC、即使在多种官能团共存的情况下,可以进行选择性的「Click Chemistry」、因此常常用于bioconjugation反应中。与其它反映相比,不需要使用金属催化剂,压倒性的高效率反应(高反应速度)是其两大特征。
基本文献
- Carboni, R. A.; Lindsey, R. V. J. Am. Chem. Soc. 1959, 81, 4342. DOI: 10.1021/ja01525a060
- Devaraj, N. K.; Weissleder, R.; Hilderbrand, S. A. Bioconjugate Chem. 2008, 19, 2297. doi:10.1021/bc8004446
- Blackman, M. L.; Royzen, M.; Fox, J. M. J. Am. Chem. Soc. 2008, 130, 13518. DOI: 10.1021/ja8053805
- Devaraj, N. K.; Upadhyay, R.; Haun, J. B.; Hilderbran, S.; Weissleder, R. Angew. Chem. Int. Ed. 2009, 48, 7013. doi:10.1002/anie.200903233
- Devaraj, N. K.; Hilderbran, S.; Upadhyay, R.; Mazitschek, R.; Weissleder, R. Angew. Chem. Int. Ed. 2010, 49, 2869. doi:10.1002/anie.200906120
- Darko, A.; Wallace, S.; Dmitrenko, O.; Machovina, M. M.; Mehl, R. A.; Chin, J. W.; Fox, J. M. Chem. Sci. 2014, 5, 3770. doi:10.1039/C4SC01348D
<review>
- Devarj. N. K.; Weissleder, R. Acc. Chem. Res. 2011, 44, 816. doi:10.1021/ar200037t
- Debets, M. F.; van Berkel, S. S.; Dommerholt, J.; Dirks, A. J.; Rutjes, F. P. T. J.; van Delft, F. L. Acc. Chem. Res. 2011, 44, 805. DOI: 10.1021/ar200059z
- Selvaraj, R.; Fox, J. M. Curr. Opin. Chem. Biol. 2013, 17, 753. doi: 10.1016/j.cbpa.2013.07.031
- Knall, A.-C.; Slugovc, C. Chem. Soc. Rev. 2013, 42, 5131. doi:10.1039/C3CS60049A
- Kozma, E.; Demeter, O.; Kele, P. ChemBioChem 2017, 18, 486. DOI: 10.1002/cbic.201600607
- Mayer, S.; Lang, K. Synthesis 2017, 49, 830. DOI: 10.1055/s-0036-1588682
- Liu, F.; Liang, Y.; Houk, K. N. Acc. Chem. Res. 2017, 50, 2297. DOI: 10.1021/acs.accounts.7b00265
- Oliveira, B. L.; Guo, Z.; Bernardes, G. J. L. Chem. Soc. Rev. 2017, 46, 4895. DOI: 10.1039/c7cs00184c
- Kang, K.; Park, J.; Kim, E. Proteome Sci. 2017, 15, 15. DOI: 10.1186/s12953-017-0121-5
<applications to in vivo Click Chemistry>
- Seckute, J.; Devaraj, N. K. Curr. Opin. Chem. Biol. 2013, 17, 761. doi: 10.1016/j.cbpa.2013.08.004
- Debets, M. F.; van Berkel, S. S.; Dommerholt, J.; Dirks, A. J.; Rutjes, F. P. T. J.; van Delft, F. L. Nat. Rev. Chem. 2018, 2, 202. DOI: 10.1038/s41570-018-0030-x
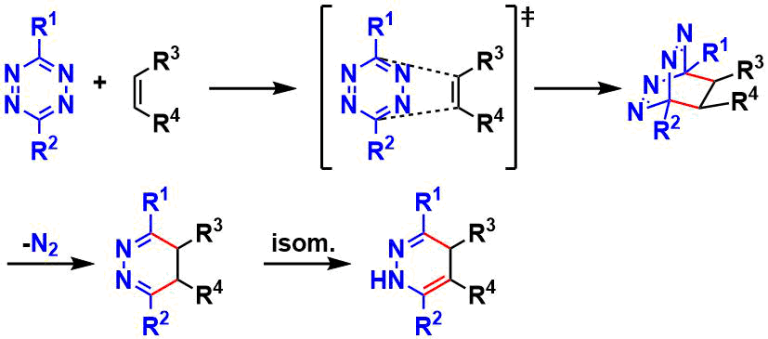
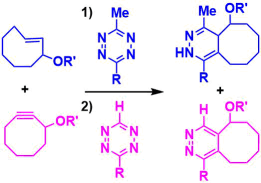
反应机理
具体请参考Diels-Alder反应。
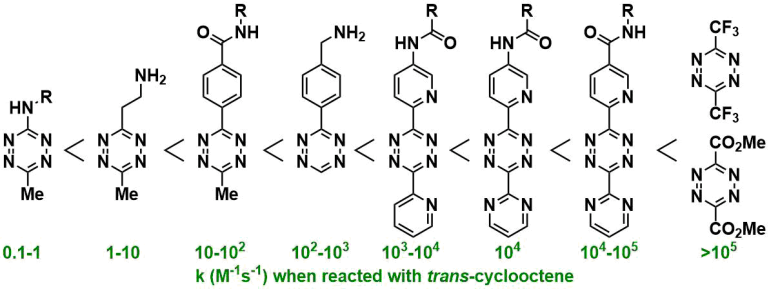
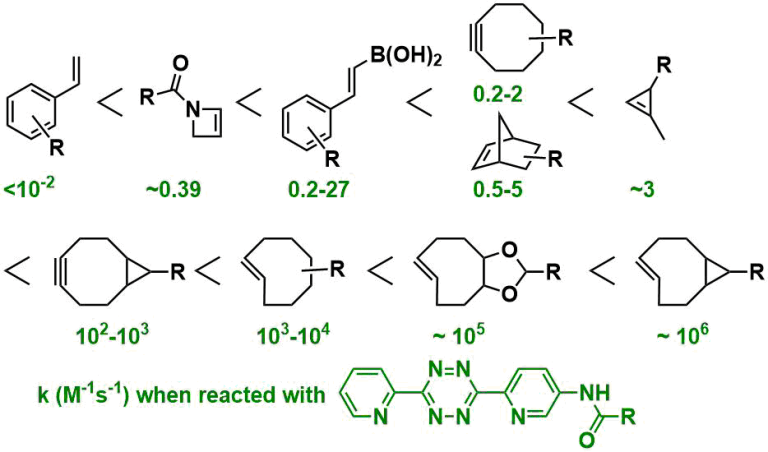
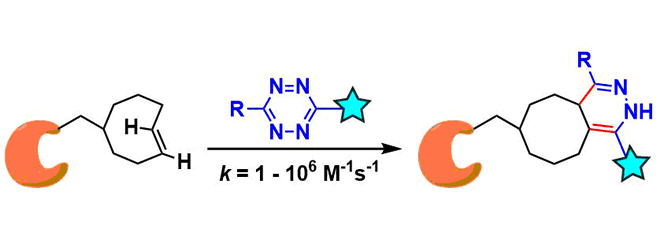
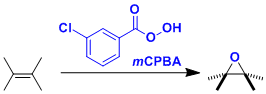
就反应速度来说,与SPAAC反应的k = 10-2 ~ 10-1 M-1s-1相比、四嗪SPIEDAC反应k = 1 ~ 106 M-1s-1,极高速的反应速度是其特征。下图是一个反应速率的大致趋势,四嗪越缺电子导致空间位阻越小,烯烃·炔烃侧的变形越大,反应速率就越高。(下图:引用自Synthesis 2017, 49, 830)。但是,反应越快的分子也越不稳定,也很可能与生物体中的半胱氨酸反应被破坏。
反应实例
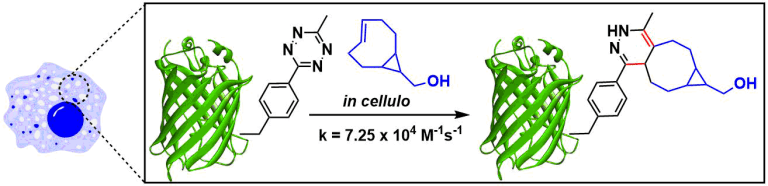
细胞内点击反应的应用[1]:用于细胞内反应必须得达到104M-1s-1以上速率常数(uM-nM浓度下数分以内完成反应)、而本反应能满足该条件。Mehl等人通过使反式环辛烯与细胞内GFP与四嗪部分反应来估计速率常数[2]。还研究了靶向细胞内RNA的转化[3]。
正交SPIEDAC反应[4]:Lemke等人发现、由于空间位阻,环辛炔选择性与单取代的四嗪反应、trans环辛烯可以与单取代和二取代的四嗪都发生反应。从而使用这个发现来实现连续正交生物标记。
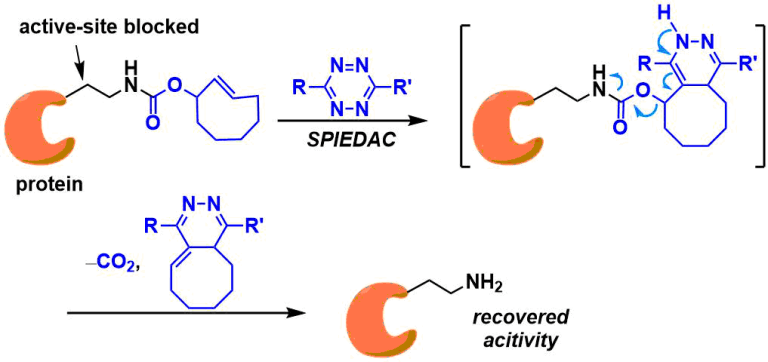
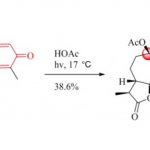
化学decaging上的应用[5]:如下图所示、氨基甲酸酯类rans-环辛烯通过与四嗪的生物正交反应导致消除反应的发生、裸露出胺基端基。利用该反应,可以应用于合成小分子前药[6]、抗体-药物复合体的药物释放[7]、细胞内酶活化[8]等。
参考文献
- Liu, D. S.; Tangpeerachaikul, A.; Selvaraj, R.; Taylor, M. T.; Fox, J. M.; Ting, A. Y. J. Am. Chem. Soc. 2012, 134, 792. DOI: 10.1021/ja209325n
- Blizzard, R. J.; Backus, D. R.; Brown, W.; Bazewicz, C. G.; Li, Y.; Mehl, R. A. J. Am. Chem. Soc. 2015, 137, 10044. doi: 10.1021/jacs.5b03275
- Pyka, A. M.; Domnick, C.; Braun, F.; Kath-Schorr, S. Bioconjugate Chem. 2014, 25, 1438. DOI: 10.1021/bc500302y
- Nikic, I.; Plass, T.; Schraidt, O.; Szymanski, J.; Briggs, J. A.; Schultz, C.; Lemke, E. A. Angew. Chem. Int. Ed. 2014, 53, 2245. doi:10.1002/anie.201309847
- Fan, X.; Ge, Y.; Lin, F.; Yang, Y.; Zhang, G.; Ngai, W. S.; Lin, Z.; Zheng, S.; Wang, J.; Zhao, J.; Li, J.; Chen, P. R. Angew. Chem. Int. Ed. 2016, 55, 14046. doi:10.1002/anie.201608009
- Versteegen, R. M.; Rossin, R.; ten Hoeve, W.; Janssen, H. M.; Robillard, M. S. Angew. Chem. Int. Ed. 2013, 52, 14112. doi:10.1002/anie.201305969
- Rossin, R.; van Duijnhoven, S. M.; ten Hoeve, W.; Janssen, H. M.; Kleijn, L. H.; Hoeben, F. J.; Versteegen, R. M.; Robillard, M. S. Bioconjugate Chem. 2016, 27, 1697. DOI: 10.1021/acs.bioconjchem.6b00231
- (a) Li, J.; Jia, S.; Chen, P. R. Nat. Chem. Biol. 2014, 10, 1003. doi:10.1038/nchembio.1656 (b) Zhang, G.; Li, J.; Xie, R.; Fan, X.; Liu, Y.; Zheng, S.; Ge, Y.; Chen, P. R. ACS Cent. Sci. 2016, 2, 325. DOI: 10.1021/acscentsci.6b00024
相关书籍
Chemoselective and Bioorthogonal Ligation Reactions: Concepts and Applications (English Edition)
- 出版日2017/03/17
- Kindle版25页
- 出版社Wiley-VCH
Cycloadditions in Bioorthogonal Chemistry (Topics in Current Chemistry Collections) (English Edition)
- 出版日2016/05/28
- Kindle版157页
- 出版社Springer
外部链接
- Bertozzi Research Group
- Bioorthogonal Chemistry – Wikipedia
- Inverse electron-demand Diels–Alder reaction – Wikipedia
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.