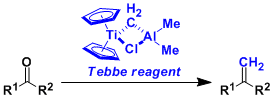
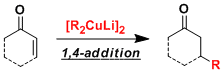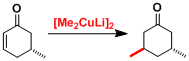- 概要
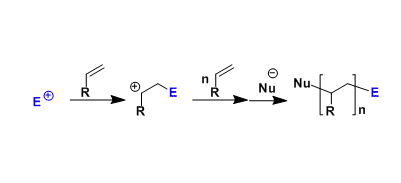
由一价铜和两当量的有机锂试剂制备的有机铜锂试剂(organocuprate)[R2CuLi],亲核性强,用于α,β-不饱和羰基化合物的1,4-加成反应、还有sp3碳上的取代反应,反应都能很快进行。
有机铜试剂碱性弱,脱氢化等副反应较难发生。而单用有机锂试剂1,2-加成优先发生,两者辅助使用,可以实现1,4-加成。
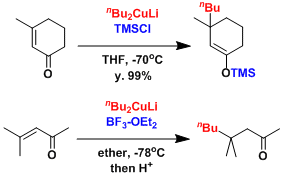
该试剂反应性非常高、对于立体位阻大的碳原子也可以反应。通过TMSCl等硬路易斯酸,可以加速1,4-加成反应。
除了与有机锂试剂以外,也可以与格利雅试剂、有机锌试剂等一起使用。特别是和后两者结合使用时,可以将铜试剂的量减小到催化剂量。
两当量的有机锂试剂对于反应的顺利进行很必要,实际仅有一当量在反应中消耗。通过导入较难迁移的配体(dummy ligand)生成杂有机铜试剂 (mixed organocuprate)[R(X)CuLi](X = alkenyl, -CN, -SR’,-NR’2, PR’2 etc.)、可以对重要的反应剂高效利用。
近年来,通过催化剂量的铜-手性膦配体的使用,发展了许多不对称1,4-加成反应。
- 基本文献
・Modern Organocopper Chemistry, Krause, N. Ed.; Wiley-VCH; 2002.
・Posner, G. H. Org. React. 1972, 19, 1.
・Posner, G. H. Org. React. 1975, 22, 253.
- 反应机理
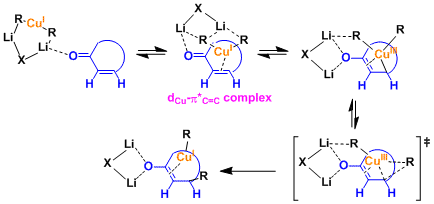
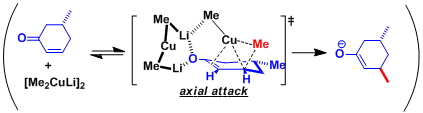
有机铜试剂的结构根据溶剂体系的不同,会有些差异。速度论实验等得结果表明、二聚体[R2CuLi]2很有可能是反应中的可能活性中间体
近几年、中村等、报道了由计算化学研究的详细反应机理(参考: Angew. Chem. Int. Ed. 2000, 39, 3750. 有機合成化学協会誌, 2003, 61, 144.)。
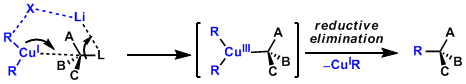
1,4-加成反应中、生成dCu-π*C=C络合物形成后,富电子的一价铜Cu(I)发生氧化加成、生成Cu(III)中間体。近年、Cu(III)中间体的结构研究由分光分析及理论计算的推测(参考:J. Am. Chem. Soc. 2007,129, 7208; J. Am. Chem. Soc. 2007, 129, 7210.)。 接下来的还原消去得到金属烯醇盐,这一过程是该反应的决速步骤。
「dummy ligand 因为和铜较强的作用不发生转移。」这一解释能够行的通。近年、锂和正离子的π相互作用使dummy ligand向不发生迁移的方向固定。这样全新的解释是中村等通过计算提出的。
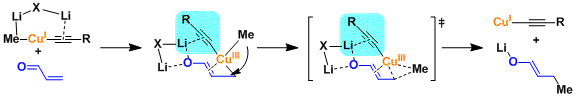
置换反应中,经由铜(III)中间体的反应机理,通过实验,计算两方面得到证实。
- 反应实例
环状不饱和酮时, 受取代基立体位阻的影响、反应进行具有立体选择性。d-π*络合物的形成是高立体选择性的关键。
1,4-加成后生成的金属烯醇盐具有活性、然后加入亲电试剂后,发生一锅法三组分连结型反应。下图是用此法合成前列腺素的实例[1]。
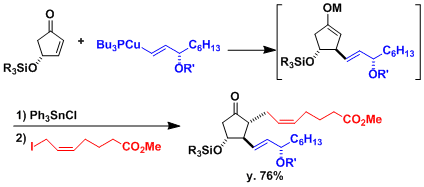
用CuCN作为铜源制备的[R2Cu(CN)Li2]、被称为higher order cuprate(Lipshutz cuprate)、与通常的铜试剂相比具有更高的反应性和化学选择性。
烯基卤代烃・OTf的sp2碳上发生取代(偶联)反应。
TMSCl或BF3等路易斯酸共存下、立体位阻较大的位置也能发生共轭加成。[2] 位置选择性的生成烯醇中间体。
- 实验步骤
环氧化物(3.50g, 40.6 mmol)的THF溶液(30mL)中、加入CuCN(364mg, 3.65mmol)。冷却至-78℃下,边搅拌边由滴液漏斗缓慢加入乙烯溴化镁(1M in THF, 52.8mL, 52.8 mmol),45分滴加完成。反应混合物升至0℃、加入饱和氯化铵水溶液(20mL)。分离有机相,水相用乙醚萃取三次,与有机相合并后用饱和食盐水洗涤,无水硫酸钠干燥。过滤后、减压浓缩,所得粗产物用柱色谱(乙醚/戊烷=1/3)纯化分离。蒸除溶剂后得到目标产物为淡黄色液体(4.41g, 収率95%)。[2]
- 实验技巧
有机铜试剂对热不稳定,升温加热的话会发生铜试剂烷基与烷基的偶联,迅速分解。该试剂不能保存,必须现用现制。
- 参考文献
[2] (a) Yamamoto, Y. Angew. Chem. Int. Ed. 1986, 25, 947. (b) Lipshutz, B. H.; Ellsworth, E. L.; Siahaan, T. J. Am. Chem. Soc. 1989, 111, 1351.
[3]Holub, N.; Neidhorfer, J.; Blechert, S. Org. Lett. 2005, 7, 1227.