本文翻译自日文版化学空间: 千田憲孝 Noritaka Chida 原作者:Macy
翻译:Alberto Caeiro,校对:Hu Hao
千田 憲孝(Noritaka Chida),日本有机化学家,现为日本庆应义塾大学 大学院工学部教授,主要从事天然产物全合成和合成导向的方法学研究。图片:庆应义塾大学个人介绍。
经历
- 1979 庆应义塾大学 工学部 应用化学科 学士
- 1981 庆应义塾大学 工学研究科 应用化学专攻 修士
- 1984 东北大学 理学研究科 化学专攻 博士
- 1984-1987 三楽株式会社 中央研究所探索研究部 研究员
- 1987-1992 庆应义塾大学 理工学部 助手
- 1988-1989 University of Pennsylvania, Postdoctoral fellow, Prof. Amos B Smith
- 1995-2003 庆应义塾大学 理工学部 应用化学科 副教授
- 2003-现在 庆应义塾大学 理工学部 应用化学科 教授
客座教授
- 2000 東京药科大学大学院
- 2001 東京工业大学大学院 理工学研究科
- 2004 北海道大学大学院 地球环境科学研究科
- 2011 奈良先端技術大学大学院
- 2011 长崎大学大学院 医歯薬総合研究科
- 2011 岡山大学大学院 自然研究科
- 2012 御茶水女子大学大学院 人间文化创成科学研究科
- 2012 关西学院大学大学院 理工学研究科
- 2015 冈山理科大学
- 2016 京都大学大学院 药学研究科
- 2018 千叶大学大学院 医学药学府
获奖经历
- 2002 日本化学会 BCSJ奖
- 2015 日本化学会 BCSJ奖
工作介绍
1. Asymmetric total synthesis by chiral pool method via sigmatropic rearrangement
作为自然界中大量存在的手性原料,糖和氨基酸及其衍生物可作为手性辅基和催化剂而被广泛用于不对称转化中。手性池(Chiral pool)策略是指从自然界中广泛存在的手性天然产物出发合成负责复杂手性天然产物。千田教授从由糖类天然产物中含有的手性醇出发,通过底物诱导的不对称σ重排反应,实现了各类天然产物的合成。
Total synthesis of Neostenin via sequential Overman / Craisen rearrangement [1]
从D-核糖为原料得到的原酰胺1在MS4A存在下,封管中加热至180°C时,发生开环得到的2可发生Overman重排得到更加稳定的3。用原乙酸三甲酯捕捉新生成的烯丙醇后,可原位发生Claisen重排,以54%收率得到产物4.。之后通过多个分子内环化反应,Chida教授实现了(+)‐Neostenine的不对称全合成。
Total synthesis of (+)‐Neostenine
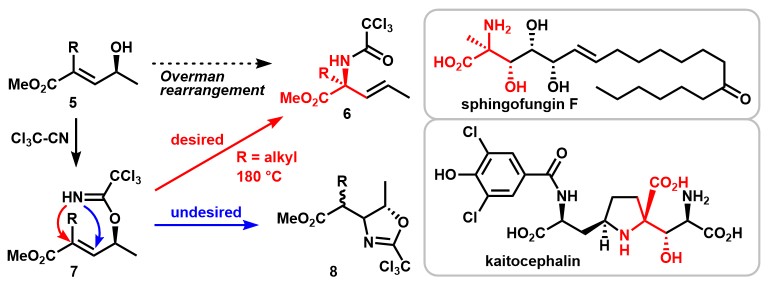
Total synthesis of Sphingofungin F & Kaitocephalin via Orthoamide-Type Overman Rearrangement [2]
由γ-羟基α,β-不饱和酯5出发,通过overman重排反应是α, α双取代氨基酸6的一种有效合成途径。然而这种sigmatropic重排由于分子内Aza-Michael 加成反应得到恶唑啉8的副反应存在,通常被认为是难以实现的。Chida教授发现,通过改变α位取代基和调控反应温度,反应可选择性的发生sigmatropic重排反应。通过该方法,Chida教授实现了含有α, α双取代氨基酸结构的Sphingofungin F 的全合成[2a, b]和 Kaitocephalin的形式合成[2c]。
Synthesis of Sphingofungin F & Kaitocephalin
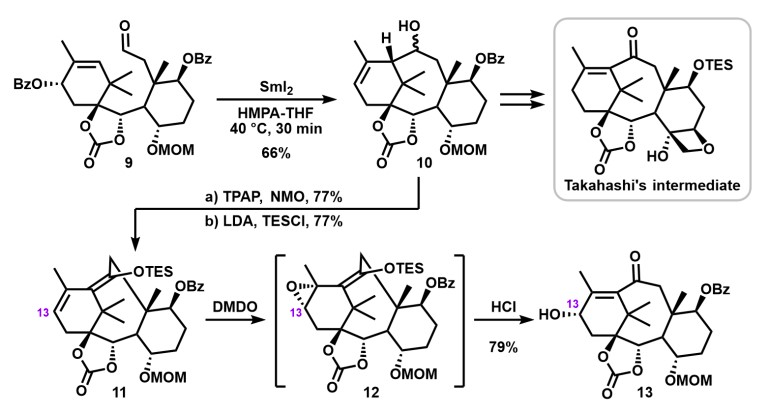
2. Total Synthetic Study of Paclitaxel (Taxol®) [3a, b]
紫杉醇(Paclitaxel Taxol®)是一种从紫杉树皮中分离出来的紫杉烷类天然产品,在癌症治疗中有广泛应用。它是一种高度氧化的四环化合物,包含难以构造的八元环,桥头烯烃和氧杂环丁烷环。由于其复杂且精妙的结构,许多合成化学家都对其有浓厚的兴趣,至今已有许多全合成及半合成报道。
Chida教授通过苯甲酸烯丙酯和醛的分子内环化反应实现了关键8元环的构建,通过合成高桥中间体(Takahashi Intermediate),实现了Taxol的形式合成。由3-O-乙酰基-D-葡萄糖为原料得到的关键中间体9在HMPA-THF混合溶剂中,用SmI2处理即可得到关环产物10,从而成功构建了Taxol环骨架。之后,通过Chugaev消除反应构建桥头烯烃及氧杂环丁烷化反应后即可得到高桥中间体(Takahashi Intermediate)。在Chida教授第二代合成中,他们对SmI2处理得到的关环产物10后面的合成步骤进行了优化,实现了桥头烯烃和C13位羟基的一同引入。化合物10氧化后烯醇硅醚化得到化合物11后,烯烃用二甲基过氧化酮(DMDO, Dimethyldioxirane)进行环氧化得12,随后盐酸后处理即可得到所需的桥头烯烃和C13位羟基(与天然产物的立体化学相同)。Chida教授目前正在通过新建立的第二代方法实现紫杉醇的高效全合成。
Formal synthesis of Taxol
评论及其他
- 在Amod B. Smith III教授课题组从事博士后研究时,与John L. Wood和Gary A. Sulikowski一同完成了大环内酰胺类抗生素(+)-Hitachimycin的全合成{4a, b};
- 对学生的培养非常热心,对学生自己的想法非常尊重;
- 当学生合成中遇到瓶颈时,会对鼓励学生道:合成中遇到难以实现的步骤时,正是需要我们努力的时候;
- Chida教授会对学生说“实验,实验“,以此鼓舞学生;(Chida教授课题组的学生觉得自己深受老师鼓舞)
- 喜欢红酒,尤其是波尔多红酒;
- 在位于美国费城的宾夕法尼亚大学做博士后研究工作期间,对美国体育运动充满热情,是美国职棒大联盟(MBL)中费城费城人队(Philadelphia Phillies)球迷;
- 喜欢米菲。
参考文献
- [1] Nakayama, Y.; Maeda, Y.; Kotatsu, M.; Sekiya R.; Ichiki, M.; Sato, T.; Chida, N. “Enantioselective Total Synthesis of (+)-Neostenine”, Chem. Eur. J. 2016, 22, 3300–3303. DOI: 10.1002/chem.201600058.
- [2] a: Tsuzaki, S.; Usui, S.; Oishi, H.; Yasushima, D.; Fukuyasu, T.; Oishi, T.; Sato, T.; Chida, N. “Total Synthesis of Sphingofungin F by Orthoamide-Type Overman Rearrangement of an Unsaturated Ester”, Org. Lett. 2015, 17, 1704–1707. DOI: 10.1021/acs.orglett.5b00475. b: Sugai, T.; Usui, S.; Tsuzaki, S.; Oishi, H.; Yasushima, D.; Hisada, S.; Fukuyasu, T.; Oishi, T.; Sato, T.; Chida, N. “Synthesis of β-Hydroxy-α,α-disubstituted Amino Acids through the Orthoamide-Type Overman Rearrangement of an α,β-Unsaturated Ester and Stereodivergent Intramolecular SN2’ Reaction: Development and Application to the Total Synthesis of Sphingofungin F”, Bull. Chem. Soc. Jpn. 2018, 91, 594–607. DOI: 10.1246/bcsj.20170408. c: Sugai, T.; Okuyama, Y.; Shin, J.; Usui, S.; Hisada, S.; Osanai, R.; Oishi, T.; Sato, T.; Chida, N. “Synthesis of Kaitocephalin Facilitated by Three Stereoselective Allylic Transposition Reactions”, Chem. Lett. 2018, 47, 454–457. DOI: 10.1246/cl.171226.
- [3] a: Fukaya, K.; Tanaka, Y.; Sato, A. C.; Kodama, K.; Yamazaki, H.; Ishimoto, T.; Nozaki, Y.; Iwaki, Y. M.; Yuki, Y.; Umei, K.; Sugai, T.; Yamaguchi, Y.; Watanabe, A.; Oishi, T.; Sato, T.; Chida, N. “Synthesis of Paclitaxel. 1. Synthesis of the ABC Ring of Paclitaxel by SmI2-Mediated Cyclization”, Org. Lett. 2015, 17, 2570–2573. DOI: 10.1021/acs.orglett.5b01173.b: Fukaya, K.; Kodama, K.; Tanaka, Y.; Yamazaki, H.; Sugai, T.; Yamaguchi, Y.; Watanabe, A.; Oishi, T.; Sato, T.; Chida, N. “Synthesis of Paclitaxel. 2. Construction of the ABCD Ring and Formal Synthesis”, Org. Lett. 2015, 17, 2574–2577. DOI: 10.1021/acs.orglett.5b01174.
- [4] a: Smith III, A. B.; Rano, T. A.; Chida, N.; Sulikowski, G. A. “Total Synthesis of (+)-Hitachimycin”, J. Org. Chem. 1990, 55, 1136–1138. DOI: 10.1021/jo00291a005. b: Smith III, A. B.; Rano, T. A.; Chida, N.; Sulikowski, G. A.; Wood. J. L. “Total Synthesis of Cytotoxic Macrocycle (+)-Hitachimycin”, J. Am. Chem. Soc. 1992, 114, 8008–8022. DOI: 10.1021/ja00047a008.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


























No comments yet.