本文作者:石油醚
概要
Takashi Ooi (1965年出生于日本爱知县),名古屋大学化学系教授,有机化学家,ACS Catalysis副主编。课题组主页:http://www.chembio.nagoya-u.ac.jp/labhp/organic3/index.html
经历
- 1989年 名古屋大学获得学士学位(Prof. H. Yamamoto)
- 1994年 名古屋大学获得博士学位(Prof. H. Yamamoto)
- 1994年-1995年 麻省理工学院博士后(JSPS研究员)(Prof. Julius Rebek Jr.)
- 1995年-1998年 北海道大学助理教授(Prof. K. Maruoka)
- 1998年-2001年 北海道大学讲师(Prof. K. Maruoka)
- 2001年-2006年 京都大学副教授(Prof. K. Maruoka)
- 2006年-至今 名古屋大学教授
获奖经历
- 2017 SSOCJ Daiichi-Sankyo Award for Medicinal Organic Chemistry
- 2014 Fellow of the Royal Society of Chemistry (FRSC)
- 2013 Inoue Prize for Science
- 2011 IBM Japan Science Prize
- 2010 JSPS PRIZE
- 2006 Thieme Journal Award
- 1999 The Chemical Society of Japan Award for Young Chemists
- 1996 Chugai Pharmaceutical Co., Ltd. Award in Synthetic Organic Chemistry, Japan
研究方向
Ooi教授利用有机离子对的精确设计来描绘合成化学的梦想和未来,有机化学的主要吸引力之一是新分子的产生。用自己的想法设计并合成一个世界上不存在的分子。由于鎓盐充当无金属的有机分子催化剂的事实,它可以有助于解决环境问题(例如环境破坏和资源枯竭),所以Ooi小组基于有机离子对“鎓盐”为主,设计和合成的有特殊功能的有机催化剂,来高效可控的催化有机化学反应。Ooi小组希望找到一种具有普遍合成价值的分子转化方法,为有机化学领域带来新的趋势并实现可持续发展的战略。
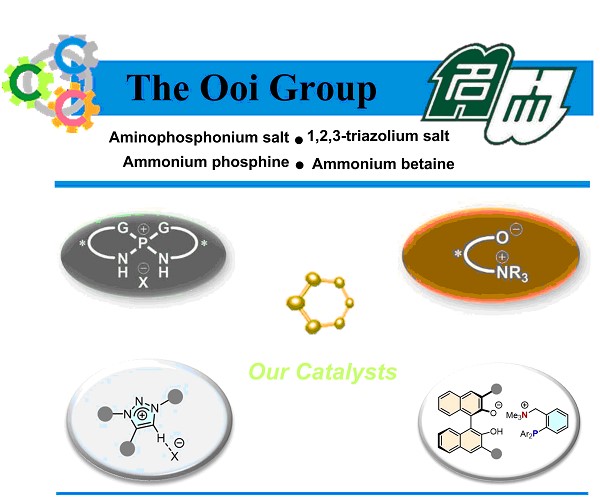
1. 手性氨基膦盐
手性四氨基膦催化剂1可以很容易地由易得的手性二胺和五氯化磷一步合成,是具有很强的立体控制性的有机分子催化剂。以P-螺环为中心的分子结构对于在抗衡离子周围形成特征的三维结构非常重要。 特别地,具有HN-P-NH结构的P离子通过离子间作用力与氢键的相互作用2来捕获抗衡离子,并且可以精确地控制反应的阴离子种类。这种作用还有助于发现超分子型离子对催化剂,有效地激活非离子性分子并可以高度选择性的控制多种分子转换。
目前该类催化剂在不对称Herry 反应3,Mannich-Type 反应4,不对称内酯化5,不对称氢膦酰化反应6,吲哚的不对称烷基化7,羟醛缩合8,1,69-10– and 1,8-加成9等方面的应用。
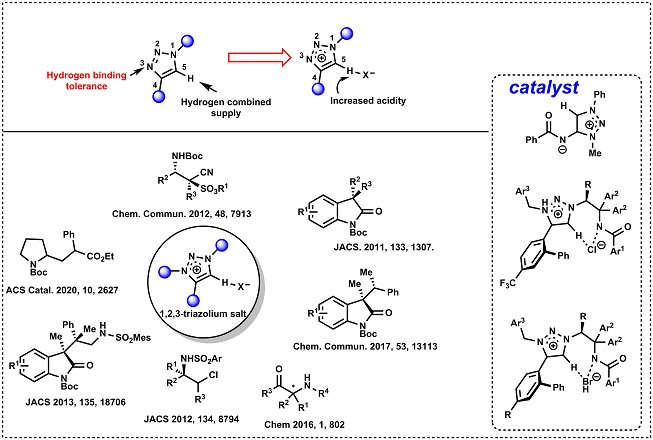
2. 三氮唑鎓盐
1,2,3-三氮唑是杂五元芳族化合物,可以通过“点击化学”的方法轻松合成。由于1,2,3-三氮唑的1,4-位烷基化反应转化为三唑鎓离子,导致C-5位的酸性提高以及加强了阴离子识别能力。着眼于从这种分子结构的独特性能,Ooi教授开创了世界上第一个以三唑鎓离子为核的手性有机分子催化剂11。独特的三唑鎓离子易于合成,且具有广泛的结构多样性,并且在包括不对称相转移催化在内的各种成键反应中均具有出色的立体可控性。实际上,通过使用开发的三唑鎓盐作为催化剂,Ooi教授已经成功实现了前所未有,非常困难的不对称合成7,12-14。
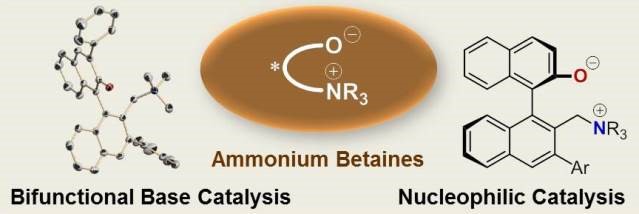
3. 甜菜碱类铵盐
甜菜碱铵通过共价键连接的单个分子骨架中同时包含阳离子和阴离子的一种分子内离子对的铵盐。甜菜碱铵的结构不同于普通的分子间盐,其是独立的阳离子-阴离子对,这使得阳离子和阴离子的空间排列可以被编程到不同的分子结构中。此外,期望两个离子位点将继续在反应系统中以适当的距离定位,并且它们将充当阳离子和阴离子共同作用的真正的离子对催化剂。Ooi教授首次揭示了甜菜碱分子的独特特性,以及可以通过熟练利用甜菜碱结构固有的催化能力来精确控制各种碳-碳键形成的立体化学15-20。
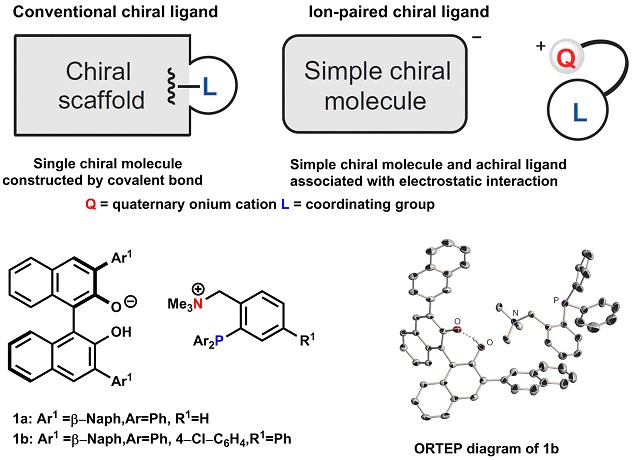
4. 磷化铵催化剂
不对称催化剂是在键形成过程中促进化学反应和控制立体化学的双重功能的手性化合物。与金属结合作为催化剂的不对称配体,同样起到了创造反应活性和控制立体化学的两个作用。
但是,如果想用一个分子来满足这两个作用,分子结构就容易变得复杂并且合成叶恒困难。Ooi教授通过将不对称配体一分为二(即用于引发反应性的非手性配体和形成不对称环境的手性分子),并通过离子之间的静电相互作用将它们结合在一起,创造出容易合成的高性能不对称配体。另外,通过使用由该类配体和钯组成的催化剂,我们实现了非常困难的立体选择性碳-碳键形成反应21-24,包括不对称季碳的构建。
参考文献
- [1] Uraguchi, D., Ueki, Y. & Ooi, T.Controlled Assembly of Chiral Tetraaminophosphonium Aryloxide–Arylhydroxide(s) in Solution. Angew. Chem. Int. Ed. (2011) 50, 3681-3683, doi:10.1002/anie.201007752.
- [2] Uraguchi, D., Ueki, Y. & Ooi, T.Chiral Organic Ion Pair Catalysts Assembled Through a Hydrogen-Bonding Network. Science. (2009) 326, 120-123, doi:10.1126/science.1176758
- [3] Uraguchi, D., Sakaki, S. & Ooi, T.Chiral Tetraaminophosphonium Salt-Mediated Asymmetric Direct Henry Reaction. J. Am. Chem. Soc. (2007) 129, 12392-12393, doi:10.1021/ja075152+.
- [4] Uraguchi, D., Ueki, Y. & Ooi, T.Chiral Tetraaminophosphonium Carboxylate-Catalyzed Direct Mannich-Type Reaction. J. Am. Chem. Soc. (2008) 130, 14088-14089, doi:10.1021/ja806311e.
- [5] Uraguchi, D., Asai, Y. & Ooi, T.Site-Directed Asymmetric Quaternization of a Peptide Backbone at a C-Terminal Azlactone. Angew. Chem. Int. Ed. (2009) 48, 733-737, doi:10.1002/anie.200803661.
- [6] Uraguchi, D., Ito, T. & Ooi, T.Generation of Chiral Phosphonium Dialkyl Phosphite as a Highly Reactive P-Nucleophile: Application to Asymmetric Hydrophosphonylation of Aldehydes. J. Am. Chem. Soc. (2009) 131, 3836-3837, doi:10.1021/ja810043d.
- [7] Ohmatsu, K., Kiyokawa, M. & Ooi, T.Chiral 1,2,3-Triazoliums as New Cationic Organic Catalysts with Anion-Recognition Ability: Application to Asymmetric Alkylation of Oxindoles. J. Am. Chem. Soc. (2011) 133, 1307-1309, doi:10.1021/ja1102844.
- [8] Corbett, M. T., Uraguchi, D., Ooi, T. & Johnson, J. S.Base-Catalyzed Direct Aldolization of α-Alkyl-α-Hydroxy Trialkyl Phosphonoacetates. Angew. Chem. Int. Ed. (2012) 51, 4685-4689, doi:10.1002/anie.201200559.
- [9] Uraguchi, D., Yoshioka, K., Ueki, Y. & Ooi, T.Highly Regio-, Diastereo-, and Enantioselective 1,6- and 1,8-Additions of Azlactones to Di- and Trienyl N-Acylpyrroles. J. Am. Chem. Soc. (2012) 134, 19370-19373, doi:10.1021/ja310209g.
- [10] Uraguchi, D., Yoshioka, K. & Ooi, T.Complete diastereodivergence in asymmetric 1,6-addition reactions enabled by minimal modification of a chiral catalyst. Nat. Commun. (2017) 8, 14793, doi:10.1038/ncomms14793.
- [11] Ohmatsu, K., Suzuki, R., Furukawa, Y., Sato, M. & Ooi, T.Zwitterionic 1,2,3-Triazolium Amidate as a Catalyst for Photoinduced Hydrogen-Atom Transfer Radical Alkylation. ACS. Catal. (2020) 10, 2627-2632, doi:10.1021/acscatal.9b04491.
- [12] Ohmatsu, K., Ando, Y., Nakashima, T. & Ooi, T.A Modular Strategy for the Direct Catalytic Asymmetric α-Amination of Carbonyl Compounds. Chem (2016) 1, 802-810, doi:https://doi.org/10.1016/j.chempr.2016.10.012.
- [13] Ohmatsu, K., Ando, Y. & Ooi, T.Asymmetric Substitution at the Tetrasubstituted Chiral Carbon: Catalytic Ring-Opening Alkylation of Racemic 2,2-Disubstituted Aziridines with 3-Substituted Oxindoles. J. Am. Chem. Soc. (2013) 135, 18706-18709, doi:10.1021/ja411647x.
- [14] Ohmatsu, K., Hamajima, Y. & Ooi, T.Catalytic Asymmetric Ring Openings of Meso and Terminal Aziridines with Halides Mediated by Chiral 1,2,3-Triazolium Silicates. J. Am. Chem. Soc. (2012) 134, 8794-8797, doi:10.1021/ja3028668.
- [15] Torii, M., Kato, K., Uraguchi, D. & Ooi, T.Chiral ammonium betaine-catalyzed asymmetric Mannich-type reaction of oxindoles. Beilstein J. Org. Chem. (2016) 12, 2099-2103, doi:10.3762/bjoc.12.199.
- [16] Oyaizu, K., Uraguchi, D. & Ooi, T.Vinylogy in nitronates: utilization of α-aryl conjugated nitroolefins as a nucleophile for a highly stereoselective aza-Henry reaction. Chem. Commun. (2015) 51, 4437-4439, doi:10.1039/C4CC10261D.
- [17] Uraguchi, D., Oyaizu, K. & Ooi, T.Nitroolefins as a Nucleophilic Component for Highly Stereoselective Aza Henry Reaction under the Catalysis of Chiral Ammonium Betaines. Chem. Eur. J. (2012) 18, 8306-8309, doi:10.1002/chem.201201259.
- [18] Uraguchi, D., Koshimoto, K., Miyake, S. & Ooi, T.Chiral Ammonium Betaines as Ionic Nucleophilic Catalysts. Angew. Chem. Int. Ed. (2010) 49, 5567-5569, doi:10.1002/anie.201002315.
- [19] Uraguchi, D., Koshimoto, K. & Ooi, T.Ionic Nucleophilic Catalysis of Chiral Ammonium Betaines for Highly Stereoselective Aldol Reaction from Oxindole-Derived Vinylic Carbonates. J. Am. Chem. Soc. (2012) 134, 6972-6975, doi:10.1021/ja3022939.
- [20] Uraguchi, D., Koshimoto, K. & Ooi, T.Chiral Ammonium Betaines: A Bifunctional Organic Base Catalyst for Asymmetric Mannich-Type Reaction of α-Nitrocarboxylates. J. Am. Chem. Soc. (2008) 130, 10878-10879, doi:10.1021/ja8041004.
- [21] Ohmatsu, K., Hara, Y., Kusano, Y. & Ooi, T.Anion-Stoichiometry-Dependent Selectivity Enhancement in Ion-Paired Chiral Ligand–Palladium Complex Catalyzed Enantioselective Allylic Alkylation. Synlett (2016) 27, 1047-1050, doi:10.1055/s-0035-1561403.
- [22] Ohmatsu, K., Hara, Y. & Ooi, T.In situ generation of ion-paired chiral ligands: rapid identification of the optimal ligand for palladium-catalyzed asymmetric allylation. Chem. Sci. (2014) 5, 3645-3650, doi:10.1039/C4SC01032A.
- [23] Ohmatsu, K., Ito, M. & Ooi, T.Ligand-controlled E/Z selectivity and enantioselectivity in palladium-catalyzed allylation of benzofuranones with 1,2-disubstituted allylic carbonates. Chem. Commun. (2014) 50, 4554-4557, doi:10.1039/C3CC49338E.
- [24] Ohmatsu, K., Ito, M., Kunieda, T. & Ooi, T.Ion-paired chiral ligands for asymmetric palladium catalysis. Nat. Chem. (2012) 4, 473-477, doi:10.1038/nchem.1311.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




























No comments yet.