本文作者:Summer
导读
浙江大学史炳锋团队成功报道了Ru(II)和新型手性联萘羧酸协同催化亚砜亚胺类化合物与α-羰基亚砜基叶立德的C-H键活化/环化反应,能以高收率和对映选择性得到一系列手性磺胺嘧啶。同时,亚砜亚胺类化合物还可发生动力学拆分和平行动力学拆分过程,仍能以高对映选择性得到相应的手性磺胺嘧啶产物。相关研究成果发表于:
Efficient Synthesis of Sulfur-Stereogenic Sulfoximines via Ru(II)-Catalyzed Enantioselective C−H Functionalization Enabled by Chiral Carboxylic Acid
Tao Zhou, Pu-Fan Qian, Jun-Yi Li, Yi-Bo Zhou, Hao-Chen Li, Hao-Yu Chen, and Bing-Feng Shi*, J. Am. Chem. Soc. ASAP. DOI: 10.1021/jacs.1c03111.
正文
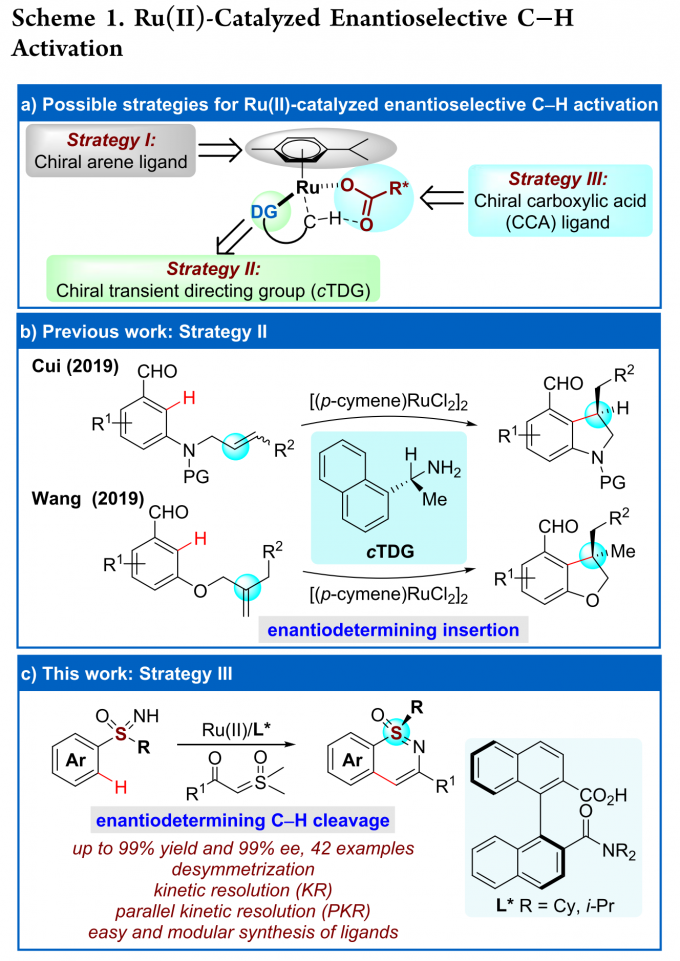
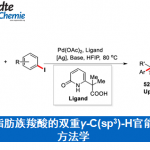
高价金属催化的C-H键活化反应因其多样的反应特性和独特的选择性而受到化学家们的广泛关注,但关于Ru(II)催化的C-H键活化反应仍然面临巨大挑战。基于Ru(II)-芳烃络合物的结构,三种可行的策略可用于Ru(II)催化的C-H键活化反应(Scheme 1a)。第一种策略即精确设计的手性芳烃配体。这种策略已被成功用于CpxMIII(M = Co, Ru, Ir)催化的不对称C-H键官能团化反应,但CpRu(II)不能有效地活化惰性C-H键。[1]第二种策略即利用手性暂态导向基(TDG)策略。这种策略已被成功用于Pd(II)催化的不对称惰性C-H键活化反应以及Ru(II)催化的不对称分子内C-H键活化/氢芳基化反应(Scheme 1b)。[2]第三种也是最具有吸引力的一种策略即使用易于获得的外部手性配体。众所周知,手性羧酸可作为外部手性配体用于促进Pd(II)催化的C-H键活化反应[3],但还没有基于选择性C-H键断裂的Ru(II)催化C-H键活化反应的报道。另一方面,磺胺嘧啶广泛存在于药理活性的药物及农药中,同时,它还可作为C-H键官能团化的直接基团。然而,关于合成手性磺胺嘧啶的报道尤为稀缺。基于上述背景研究,浙江大学史炳锋团队成功报道了Ru(II)和新型手性联萘羧酸协同催化亚砜亚胺类化合物与α-羰基亚砜基叶立德的C-H键活化/环化反应。一系列高收率和对映选择性的手性磺胺嘧啶化合物通过去对称化、动力学拆分以及平行动力学拆分得到(Scheme 1c)。
(图片来源:J. Am. Chem. Soc.)
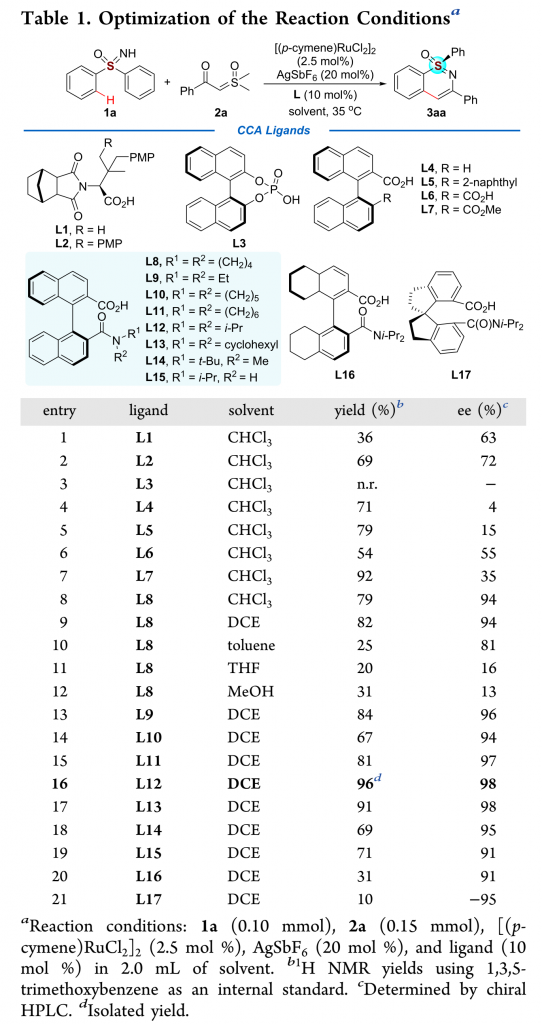
作者以亚砜亚胺1a与α-羰基亚砜基叶立德2a为模板底物,通过对催化剂、添加物以及溶剂等条件进行筛选,确定最优条件为(Table 1):Ar气条件下,以2.5 mol% [(pcymene)RuCl2]2为催化剂,10 mol% 手性羧酸L12为配体,20 mol% AgSbF6为添加物,DCE为溶剂,底物在35 ℃条件下反应12 h,能以96%的收率、98%的对映选择性得到手性产物3aa。
(图片来源:J. Am. Chem. Soc.)
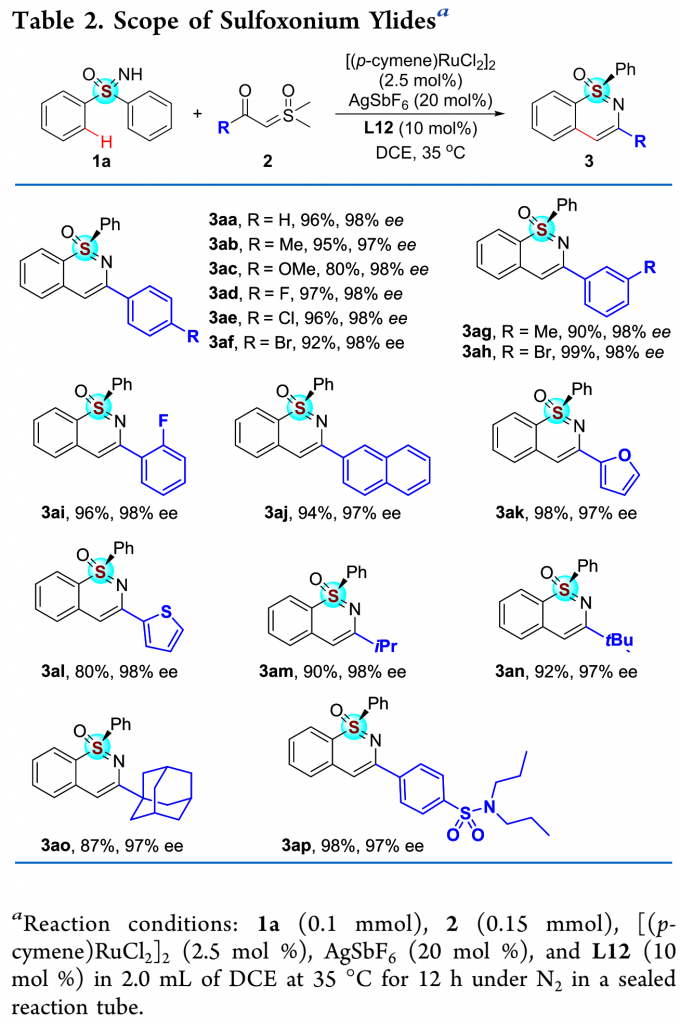
在最优反应条件下,作者对α-羰基亚砜基叶立德的底物范围进行了考察(Table 2)。各种芳基、萘基、呋喃基、硫代磺酰基以及脂肪酰基取代的α-羰基亚砜基叶立德均能较好的适应反应条件,能以优秀的收率和对映选择性得到相应产物。
(图片来源:J. Am. Chem. Soc.)
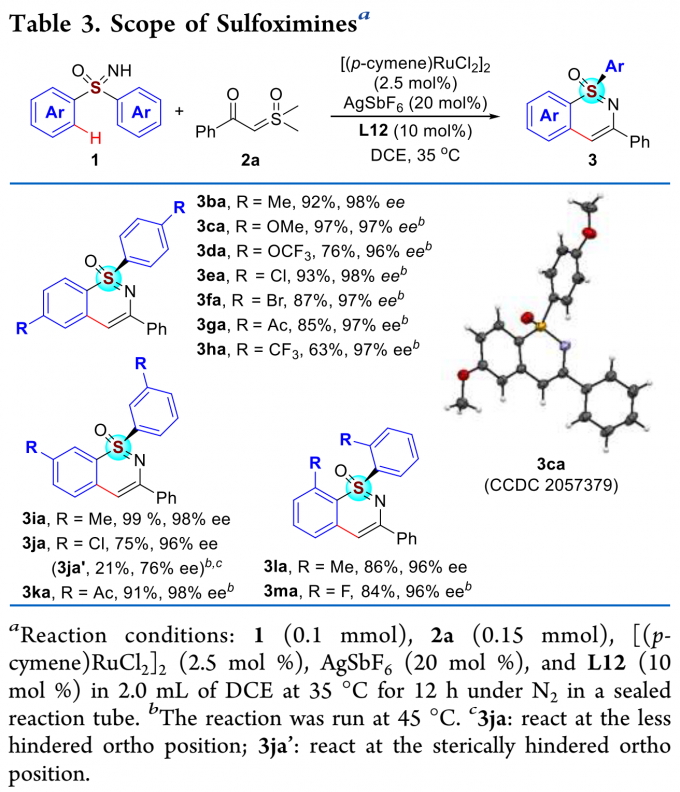
紧接着,作者考察了二芳基亚砜亚胺的底物范围(Table 3)。各种给电子和吸电子取代的二芳基亚砜亚胺均能较好的适应反应条件,能以良好至优秀的收率和对映选择性得到相应产物。其中,3ca的绝对构型通过单晶确定。
(图片来源:J. Am. Chem. Soc.)
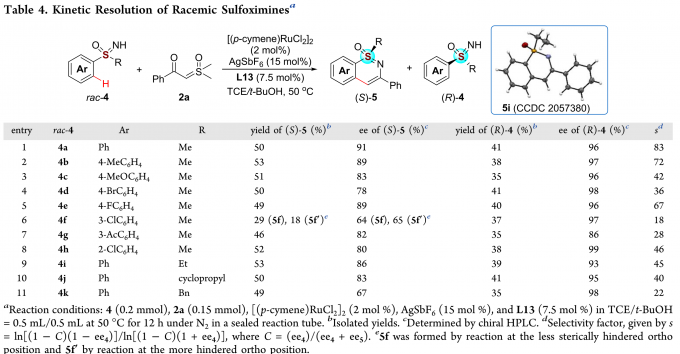
通过调整反应条件,消旋的亚砜亚胺也可发生Ru(II)催化的动力学拆分过程(Table 4)。各种取代的亚砜亚胺均能较好的适应反应条件,能以良好至优秀的收率和对映选择性得到环化产物(S)-5,同时,能以中等至优秀的的收率和对映选择性得到(R)-4。
(图片来源:J. Am. Chem. Soc.)
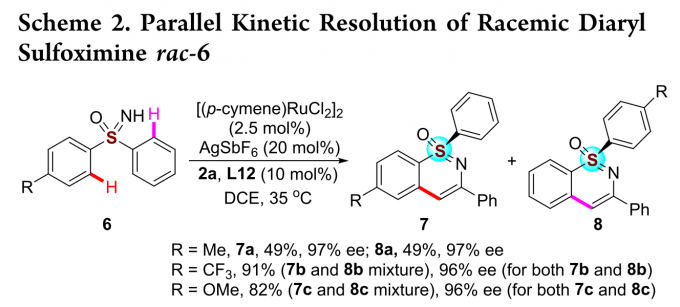
此外,对于连接两个不同芳香族取代的亚砜亚胺可以实现更更具挑战性的平行动力学拆分(Scheme 2)。当R取代基为甲基时,该反应能以优秀的收率和对映选择性得到两种手性产物7a和8a。若R取代基为三氟甲基或甲氧基时,反应只能得到两种混合物,但相应产物的对映选择性仍保持在高水平。
(图片来源:J. Am. Chem. Soc.)
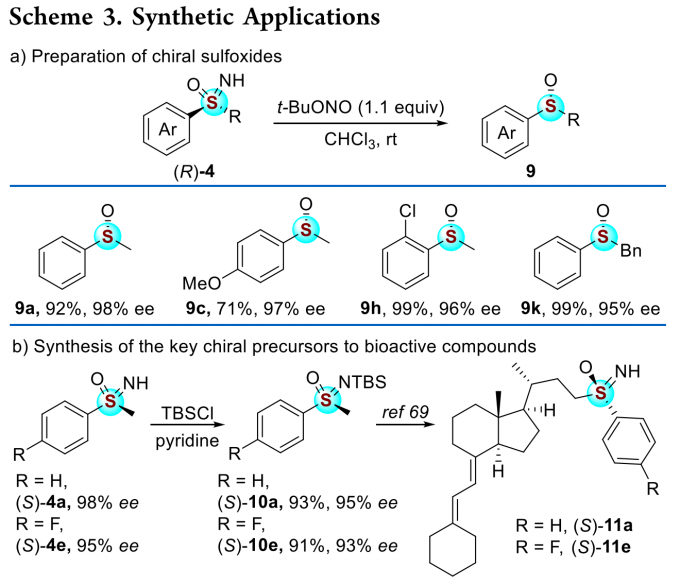
为了证明反应的应用潜力,作者进行了一系列衍生反应(Scheme 3)。手性亚砜亚胺(R)-4可以被还原为相应的手性亚砜(Scheme 3a)。此外,通过动力学拆分过程得到的(S)-4a和(S)-4e经过简单的反应步骤,可转化为相应的人体细胞色素P450C24(CYP24)羟化酶的抑制剂(Scheme 3b)。
(图片来源:J. Am. Chem. Soc.)
为了进一步了解反应机理,作者进行了一系列控制实验。标准条件下,不加入2a,只将1b溶于D2O和DCE混合物中,能检测到24%的氘掺入到1b中。反之,若只加2a,其它条件不变,未能检检测到氘。这些结果表明,尽管不加入2a时,C-H活化步骤在反应过程中是可逆的,但2a的加入能明显加快C-H键活化的正向进行。同时,作者利用动力学同位素效应对平行动力学实验进行了研究。kH/kD = 1.5表明C-H键断裂是该反应的限速步骤。此外,高分辨率质谱分析表明,反应中过程中形成五价钌中间体。
小结:浙江大学史炳锋团队成功报道了Ru(II)和新型手性联萘羧酸协同催化亚砜亚胺类化合物与α-羰基亚砜基叶立德的C-H键活化/环化反应,能以高收率和对映选择性得到一系列手性磺胺嘧啶。同时,亚砜亚胺类化合物还可发生动力学拆分和平行动力学拆分过程,仍能以高对映选择性得到相应的手性磺胺嘧啶产物。
参考文献
- Ye, N. Cramer, Chem. Res.2015, 48, 1308-1318. DOI: 10.1021/acs.accounts.5b00092
- a) F.-L. Zhang, K. Hong, T.-J. Li, H. Park, J.-Q. Yu, Science2016, 351, 252-256. DOI: 1126/science.aad7893 b) Z.-Y. Li, H. H. C. Lakmal, X. Qian, Z. Zhu, B. Donnadieu, S. J. McClain, X. Xu, X. Cui, J. Am. Chem. Soc. 2019, 141, 15730-15736. DOI: 10.1021/jacs.9b07251 c) G. Li, Q. Liu, L. Vasamsetty, W. Guo, J. Wang, Angew. Chem., Int. Ed. 2020, 59, 3475-3479. DOI: 10.1002/anie.201913733
- Shao, K. Wu, Z. Zhuang, S. Qian, J.-Q. Yu, Acc. Chem. Res.2020, 53, 833-851. DOI: 10.1021/acs.accounts.9b00621

















No comments yet.