作者:石油醚
概要
冯小明:中国科学院院士,四川大学化学系教授,博士生导师,有机化学家。
课题组主页:http://www.scu.edu.cn/chem_asl/
经历
- 1981-1985年兰州大学,学士学位
- 1985-1988年兰州大学,硕士学位(Prof. Ziyi Zhang)
- 1993-1996年中科院化学所,博士学位(Prof. Zhitang Huang & Yao-Zhong Jiang)
- 1988-1993年西南师范大学化学系,历任助教和副教授
- 1997-2000年中科院成都有机所,任副研究员和研究员,不对称合成联合开放实验室副主任,于1999被评聘为博士生导师
- 1998-1999年美国Colorado State University化学系,博士后(Prof. Yian Shi)
- 2000-至今 四川大学化学系教授,博士生导师
- 2013年 当选中科院院士
获奖经历
- 2002 the National Science Fund for Distinguished Young Scholars (China)
- 2005 the Special Professor of the Chang Jiang Scholars by the Ministry of Education of China
- 2009 Higher Education Outstanding Scientific Research Output Awards (Science and Technology) from the Ministry of Education (First class, China)
- 2011 SciFinder Award for Creative Work in Synthetic Organic Chemistry, CCS
- 2012 the State Natural Science Award, P.R. China (Second class, China)
- 2013 a Chinese Academy of Sciences Academician
- 2014 a Fellow of the Royal Society of Chemistry
- 2016 Chiral Chemistry Award, CCS
- 2018 Physical Science Prize of Future Science Prize
- 2018 Huang Yaozeng Metal Organic Chemistry Award, CCS
- 2019 Higher Education Outstanding Scientific Research Output Awards (Science and Technology) from the Ministry of Education (First class, China)
- 2019 Ho Leung Ho Lee Foundation Prize for Scientific and Technological Progress
- 2019 the Outstanding Talent Award of Sichuan
- 2020 the National Innovation and Competition Prize of China (Individual Medal)
研究方向
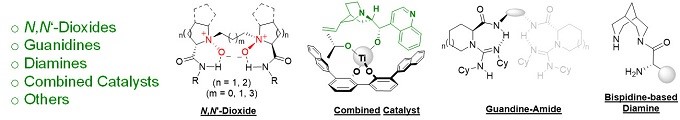
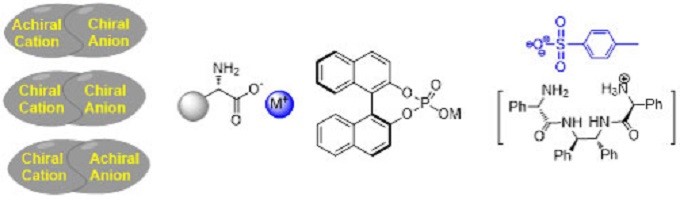
冯小明院士课题组针对不对称合成中发展新型优势手性催化剂、新反应和新策略等核心问题,进行系统深入的研究。以廉价易得的氨基酸为原料,设计合成多种新型手性配体和催化剂,获得了具有原创性和特色的优势手性催化剂,其中手性双氮氧化合物被称为“冯氏配体”面向全世界销售,实现了50多类重要不对称反应,如第一例不对称催化α-取代重氮酯与醛的反应,被国外人名反应专著冠名为Roskamp-Feng反应,为一些重要生理活性手性化合物的合成提供有效方法。在过去的几年中,冯院士小组一直在寻找并发展新型的手性催化剂,其中一些已在不对称催化反应中得到了广泛的应用。这些催化剂包括手性双氮氧有机催化剂和配体、胍胺有机催化剂和配体、手性二胺催化剂、手性有机盐以及组合催化剂等(图 1)。该类催化剂涉及的反应类型包括:碳-碳键,碳-氧键,碳-氮键,碳-氢键和其他碳-杂原子键的对映选择性形成。
图 1 手性催化剂
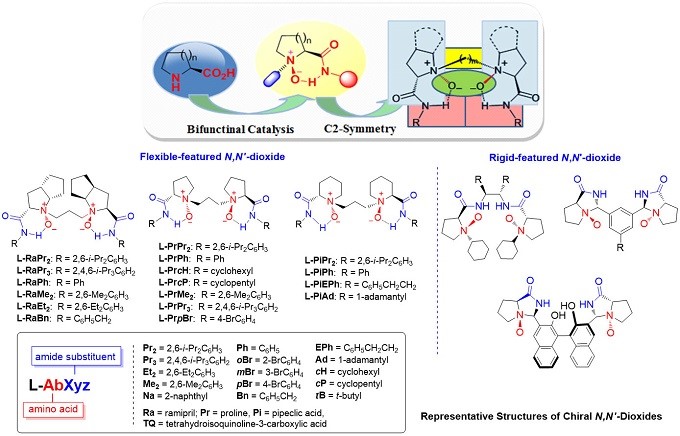
1.手性N,N’–二氧化物的不对称催化作用
基于双功能催化和C2-对称性的策略,冯小明院士课题组以廉价易得的氨基酸和胺为起始原料,设计并合成了新的N,N’-二氧化物酰胺化合物家族。1)通过由具有可变构象的连接两个N-氧化物酰胺亚基,可以容易地制备新型的C2-对称的N,N’-二氧化物; 2)通过使用不同的手性主链、连接单元和具有不同空间和电子性质的胺,可以很容易地进行结构修饰,以适应目标的对映选择性反应的氮氧催化剂(图2)。
图2 N, N’-二氧化物酰胺化合物家族
手性N,N’-二氧化物的第一次应用涉及双官能有机催化,其中氨基氧化物作为路易斯基以及酰胺提供氢键结合位点,同时增强亲电性和亲核性。第二种是手性配体-金属络合物共催化。(许多手性四齿轮配体-金属配合物已被确定为有效的催化剂1,(Acc. Chem. Rev. 2011, 44, 574))
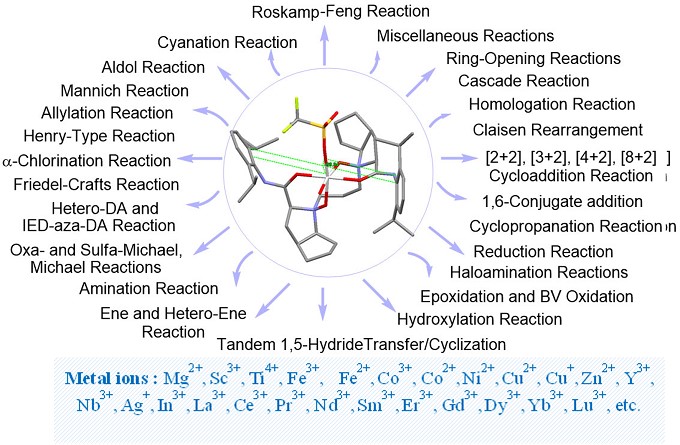
将N,N’-二氧化物用作路易斯酸催化不对称反应的优先配体,极大地拓展了该类化合物的用途。N,N’-二氧化物可以有效地与各种金属盐配体(稀土金属,碱土金属,IV族金属,XIII族金属)在合适的金属离子存在以及sp3碳和烷基间隔的构型自由,使得N,N’-二氧化物分子内的氢键消失,酰胺和胺的氧化物分子可以向内和横向转换以配合金属中心,从而具有高效的催化效率。N,N’-二氧-金属配合物可在温和的反应条件下,通过简单的反应过程,可催化四十多种类型2-9的不对称催化反应以及反应的区域选择性、非对映体选择性和对映体选择性的控制问题,都得到了很好的解决(图3)。
图3 N, N’-二氧化物酰胺化合物催化的反应
2.手性胍的不对称催化作用
胍类化合物是一种具有特殊离域行为和Y-型CN3结构的有机超强碱。冯院士团队以手性氨基酸为原料,设计合成了一种新型手性胍酰胺化合物。手性胍、双胍及其半盐、胍酰胺作为双功能有机催化剂,已在多种反应中得到开发,并将手性胍胺催化剂扩展到金属催化的不对称反应中10-15(图4)。
图4 手性胍催化剂
3.手性二胺的不对称催化作用
天然产物sparteine(中文名:金雀花碱、鹰爪豆碱)及其结构类似物是不对称催化反应中常用的手性配体,其核心结构是一种具有双胺骨架。通过引入合适的手性基团并结合司巴丁及其类似物的双胺结构,为开发新的不对称催化剂提供了新的机会。通过不断的努力,冯院士小组研究表明:嵌在Bispidine/氨基酸骨架中的手性二胺有机催化剂对于丙酮与官能化酮的直接羟醛缩合反应、硝基烯烃与丙酮、丁酮和环酮的Michael反应中都表现出很好的催化作用16,17(图5)。
图5 手性二胺催化剂
4.手性自组装金属催化剂的不对称催化
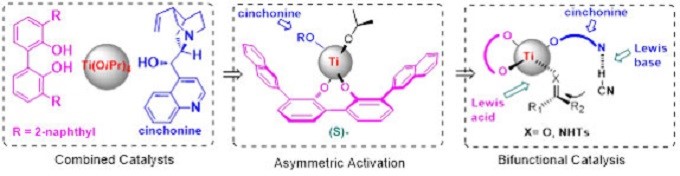
“不对称活化”的概念为手性催化剂的设计提供了一种经济且高效的方法。冯院士小组开发了一种由辛可宁、非手性双酚衍生物和钛化合物组成的金属配合物。其设计策略是将柔性双酚配体与易于获得的手性改性剂结合使用。Atropos配体受手性改性剂影响,将该配体导向最稳定的构象,从而确定了催化中心的对映选择性。这种复合钛催化剂具有很宽的底物耐受性,可以实现C=O,C=N,C=C键的高效对映选择性腈化反应18,19(图6)。
图6 手性自组装金属催化剂
5.手性有机盐的不对称催化作用
有机盐催化剂,特别是手性官能团化盐催化剂,由于其在不同化学反应中具有可调控性、回收和再利用的优势、以及在阳离子或阴离子结构修饰方面的可能性,因此在不对称催化领域开辟了一个有趣的子领域。冯院士课题组研究表明,手性碱金属盐如苯甘氨酸钠、磷酸钠和手性胺盐可作为多种类型反应的有效催化剂(图7)。
图7 手性有机盐催化剂
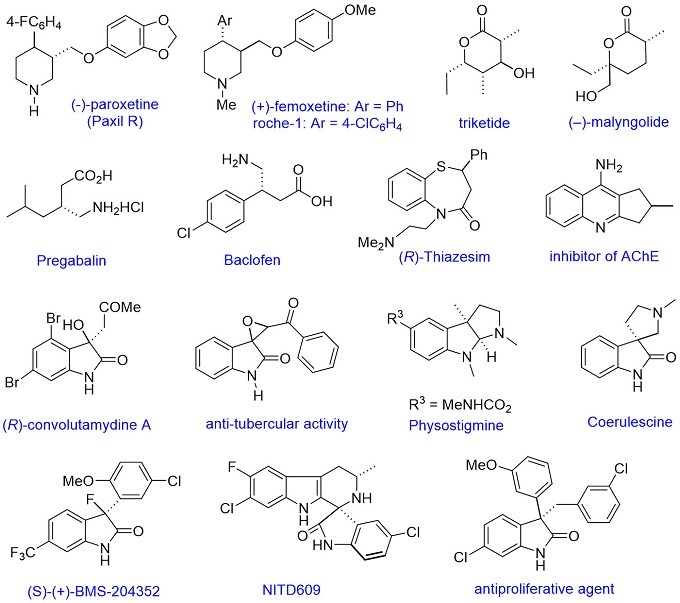
6.合成应用
冯院士小组使用本小组开发的不对称催化反应的策略和方法,可以很容易的获得一些具有潜在价值的中间体。通过小组努力,已建立了一些很难制备的手性基块,目前课题组已经在发展手性药物分子和生物活性手性化合物的简明合成,并不断扩大不对称催化反应的应用领域(图8)。
图8 合成应用
其他
- Chem-station对冯院士做了题为“打造不对称催化新星・具有C2对称性的氮氧双功能优势手性催化剂ー冯小明教授”的人物专访。
- Chem-station对于冯院士课题组使用手性N-O配体,实现了不对称的Doyle-Kirmse反应进行了介绍。
- Chem-station对“Roskamp reaction”的介绍中提到了2010年由四川大学冯院士课题组改进,并将其做成不对称催化反应,故又名Roskamp-Feng反应。
- Chiral N,N’-dioxide/Sc(III) complex、Chiral N,N’-dioxide/Dy(III) complex
- Chiral mono-guanidine-amide、Chiral bis-guanidine-amide
相关链接
- 冯小明院士履历
- 冯小明-中国科学院院士介绍
- 从没笑过的冯小明:年三十晚上也在实验室(图)
- “科学与中国”巡讲团到成都冯小明主讲
- 四川大学冯小明院士获何梁何利基金科学与技术进步奖
- 冯小明院士荣获第三届未来科学大奖
参考文献
- [1] Liu, X., Lin, L. & Feng, X. Chiral N,N′-Dioxides: New Ligands and Organocatalysts for Catalytic Asymmetric Reactions. Acc. Chem. Res. (2011). 44, 574-587, doi:10.1021/ar200015s.
- [2] Zhang, X. et al. Enantioselective Radical-Polar Crossover Reactions of Indanonecarboxamides with Alkenes. Angew. Chem. Int. Ed. (2020). 59, 4846-4850, doi:10.1002/anie.201914151.
- [3] Chen, Y. et al. Tandem Insertion–[1,3]-Rearrangement: Highly Enantioselective Construction of α-Aminoketones. Angew. Chem. Int. Ed. (2020). 59, 8052-8056, doi:10.1002/anie.201914645.
- [4] Kang, T. et al. Chiral Zinc(II)-Catalyzed Enantioselective Tandem α-Alkenyl Addition/Proton Shift Reaction of Silyl Enol Ethers with Ketimines. Angew. Chem. Int. Ed. (2019). 58, 2464-2468, doi:10.1002/anie.201810961.
- [5] Ge, S. et al. Bimetallic Catalytic Asymmetric Tandem Reaction of β-Alkynyl Ketones to Synthesize 6,6-Spiroketals. Angew. Chem. Int. Ed. (2019). 58, 4017-4021, doi:10.1002/anie.201812842.
- [6] Xiong, Q., Dong, S., Chen, Y., Liu, X. & Feng, X. Asymmetric synthesis of tetrazole and dihydroisoquinoline derivatives by isocyanide-based multicomponent reactions. Nat. Commun. (2019). 10, 2116, doi:10.1038/s41467-019-09904-5.
- [7] Zheng, H. et al. Stereodivergent synthesis of vicinal quaternary-quaternary stereocenters and bioactive hyperolactones. Nat. Commun. (2018). 9, 1968, doi:10.1038/s41467-018-04123-w.
- [8] Lin, X. et al. Chiral Nickel(II) Complex Catalyzed Enantioselective Doyle–Kirmse Reaction of α-Diazo Pyrazoleamides. J. Am. Chem. Soc. (2018). 140, 3299-3305, doi:10.1021/jacs.7b12486.
- [9] Liu, X., Zheng, H., Xia, Y., Lin, L. & Feng, X. Asymmetric Cycloaddition and Cyclization Reactions Catalyzed by Chiral N,N′-Dioxide–Metal Complexes. Acc. Chem. Res. (2017). 50, 2621-2631, doi:10.1021/acs.accounts.7b00377.
- [10] Dong, S., Feng, X. & Liu, X. Chiral guanidines and their derivatives in asymmetric synthesis. Chemical Society Reviews (2018). 47, 8525-8540, doi:10.1039/C7CS00792B.
- [11] Guo, S., Dong, P., Chen, Y., Feng, X. & Liu, X. Chiral Guanidine/Copper Catalyzed Asymmetric Azide-Alkyne Cycloaddition/[2+2] Cascade Reaction. Angew. Chem. Int. Ed. (2018). 57, 16852-16856, doi:10.1002/anie.201810679.
- [12] Chen, Q. et al. Copper/Guanidine-Catalyzed Asymmetric Alkynylation of Isatins. Angew. Chem. Int. Ed. (2016). 55, 5286-5289, doi:10.1002/anie.201600711.
- [13] Tang, Y. et al. Direct Synthesis of Chiral Allenoates from the Asymmetric CH Insertion of α-Diazoesters into Terminal Alkynes. Angew. Chem. Int. Ed. (2015). 54, 9512-9516, doi:10.1002/anie.201501918.
- [14] Zhu, Y. et al. Asymmetric NH Insertion of Secondary and Primary Anilines under the Catalysis of Palladium and Chiral Guanidine Derivatives. Angew. Chem. Int. Ed. (2014). 53, 1636-1640, doi:10.1002/anie.201308501.
- [15] Dong, S. et al. Organocatalytic Oxyamination of Azlactones: Kinetic Resolution of Oxaziridines and Asymmetric Synthesis of Oxazolin-4-ones. J. Am. Chem. Soc. (2013). 135, 10026-10029, doi:10.1021/ja404379n.
- [16] Wang, M. et al. Asymmetric Crossed-Conjugate Addition of Nitroalkenes to Enones by a Chiral Bifunctional Diamine Organocatalyst. Chem. Eur. J. (2011). 17, 2365-2368, doi:10.1002/chem.201002961.
- [17] Liu, J. et al. Organocatalyzed highly stereoselective Michael addition of ketones to alkylidene malonates and nitroolefins using chiral primary-secondary diamine catalysts based on bispidine. Org. Biomol. Chem. (2009). 7, 4120-4127, doi:10.1039/B910939K.
- [18] Zheng, K., Liu, X. & Feng, X. Recent Advances in Metal-Catalyzed Asymmetric 1,4-Conjugate Addition (ACA) of Nonorganometallic Nucleophiles. Chem. Rev. (2018). 118, 7586-7656, doi:10.1021/acs.chemrev.7b00692.
- [19] Wang, J., Liu, X. & Feng, X. Asymmetric Strecker Reactions. Chem. Rev. (2011). 111, 6947-6983, doi:10.1021/cr200057t.
- [20] 冯院士目前发表410篇论文
- [21] 冯院士撰写的书籍
- [22] 冯院士课题组主页(上面的图片均来自其课题组主页)
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






























No comments yet.