作者:石油醚
导读
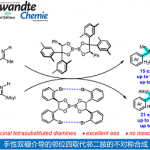
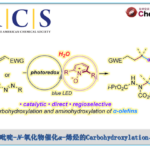
近日,中山大学赵晓丹教授课题组在期刊J. Am. Chem. Soc.上发表论文,报道了Lewis碱性手性硫醚催化实现的烯丙基磺酰胺的分子间不对称亲电碘化双官能化反应,高对映选择性地构建了一系列碘化手性分子。通过该方法,可实现手性叔烷基醚、叔烷基氟化物、叔烷基叠氮化物的高效构建。所得的碘化产物可通过重排或取代反应转化为高价值的α-芳基酮、手性二级胺、氮杂环丙烷等手性分子。
|
正文
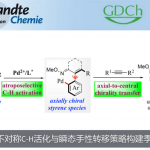
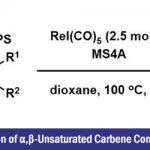
作为亲电卤化反应的一个重要分支,烯烃的亲电碘化官能化反应在过去的几十年里受到了特别的关注。一方面,这种转化可通过在温和条件下在烯烃双键上同时引入碘原子和另一个官能团,以直接获取官能化的烷基碘化分子。众所周知,烷基碘化分子具有重要意义,不仅存在于海洋天然产物等活性分子中(Scheme 1a),还可以很容易地被转化为高价值的复杂分子。另一方面,这类由亲电碘物种所引发的反应,为其他亲电试剂难以实现的挑战性转化提供了可能。尽管具有众多优点,该领域中大部分研究关注于烯烃的分子内环化反应,通过将外源亲核试剂引入烯烃的分子间不对称碘化反应的研究是很少的(Scheme 1b),尽管该方法在构建复杂手性化合物中更具前景。迄今为止,仅有通过金属催化实现特定底物官能化的少数成功例子,其关键步骤依赖于底物控制或亲核试剂控制,例如冯小明院士团队通过共轭加成/α-碘化过程实现的α,β-不饱和羰基化合物的双官能化反应(Scheme 1c),以及Arai课题组通过金属离子键、氢键、卤键、π-π堆积共同作用实现的α-烷基苯乙烯的碘化酯化反应(Scheme 1d)。
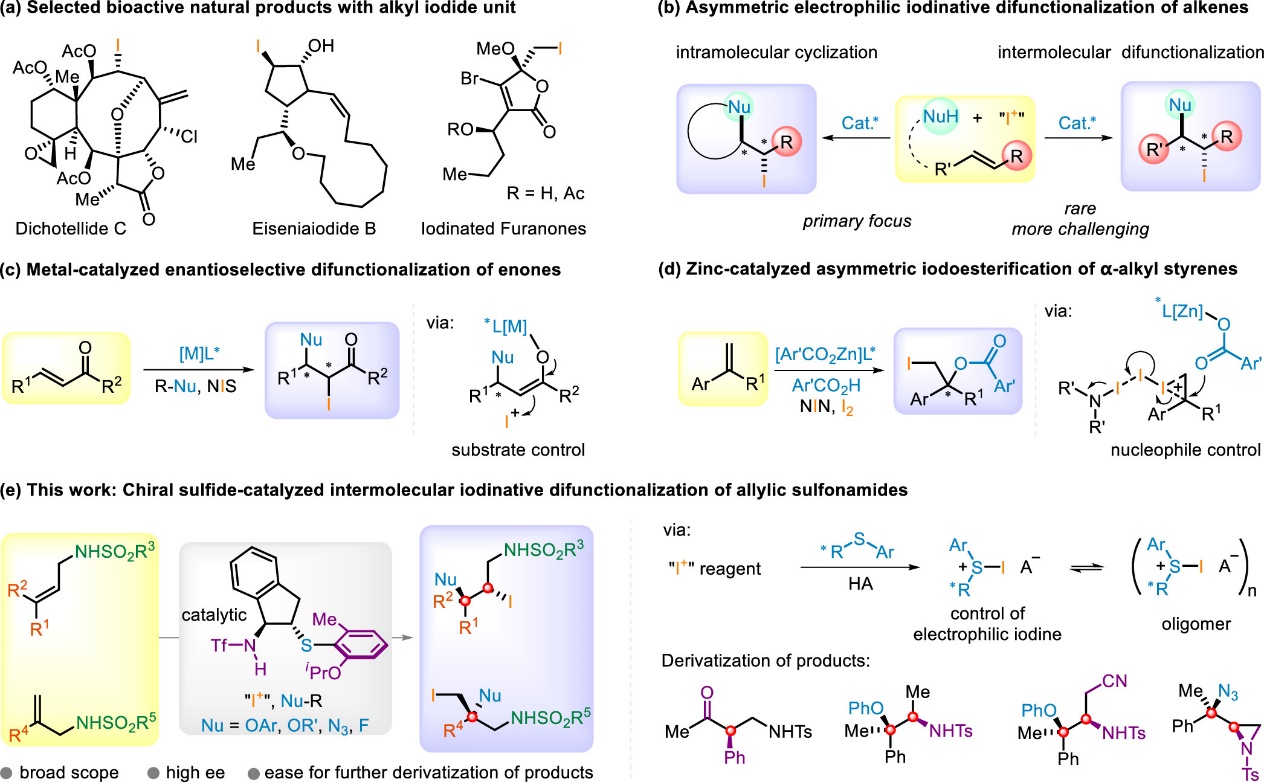
Scheme 1. Catalytic Enantioselective Iodofunctionalization of Alkenes
近年来,不对称Lewis碱性硫属化合物催化备受关注,已成为不饱和化合物(尤其是烯烃)的不对称亲电官能化的强有力工具。中山大学赵晓丹教授课题组也一直在这一领域开展工作,并发展了基于茚骨架的手性硒硫醚催化剂,高效实现了烯烃的不对称亲电硫化和氯化反应。近日,该课题组使用他们所发展的基于茚骨架手性双官能硫醚催化剂,通过亲电碘物种控制的策略,实现了γ,γ-双取代烯丙基磺酰胺和1,1-双取代烯丙基磺酰胺的不对称亲电碘化双官能化反应(Scheme 1e),所得产物可转化为高价值的α-芳基酮、手性二级胺、氮杂环丙烷等手性分子。
考虑到对N-保护的烯丙基胺的直接官能化是构建高价值的胺衍生物的简便方法,作者认为N-保护的γ,γ-双取代烯丙基胺可能是不对称碘化双官能化的理想底物。这类底物可以形成其他方法难以构建的具有四级立体中心的手性碘代胺衍生物。此外,相比于1,2-二取代烯烃或单取代烯烃,该底物所形成的碘鎓离子可能相对更稳定,从而减少手性中间体的消旋化。酚被用作亲核试剂,尽管它们可能由于自身的竞争性直接卤化反应而难以应用于烯烃的不对称亲电卤化反应中。通过系统地条件优化,作者发现,当使用手性硫醚C9为催化剂,二碘海因为亲电碘试剂,酚作为亲核试剂,甲磺酸或三异丙基硅基三氟甲磺酸酯为添加剂时,γ,γ-双取代烯丙基胺可通过不对称碘化芳氧基化反应顺利转化为手性碘化叔烷基醚衍生物(Scheme 2)。值得一提的是,在这些反应中,酚并未发生进一步的碘化反应。
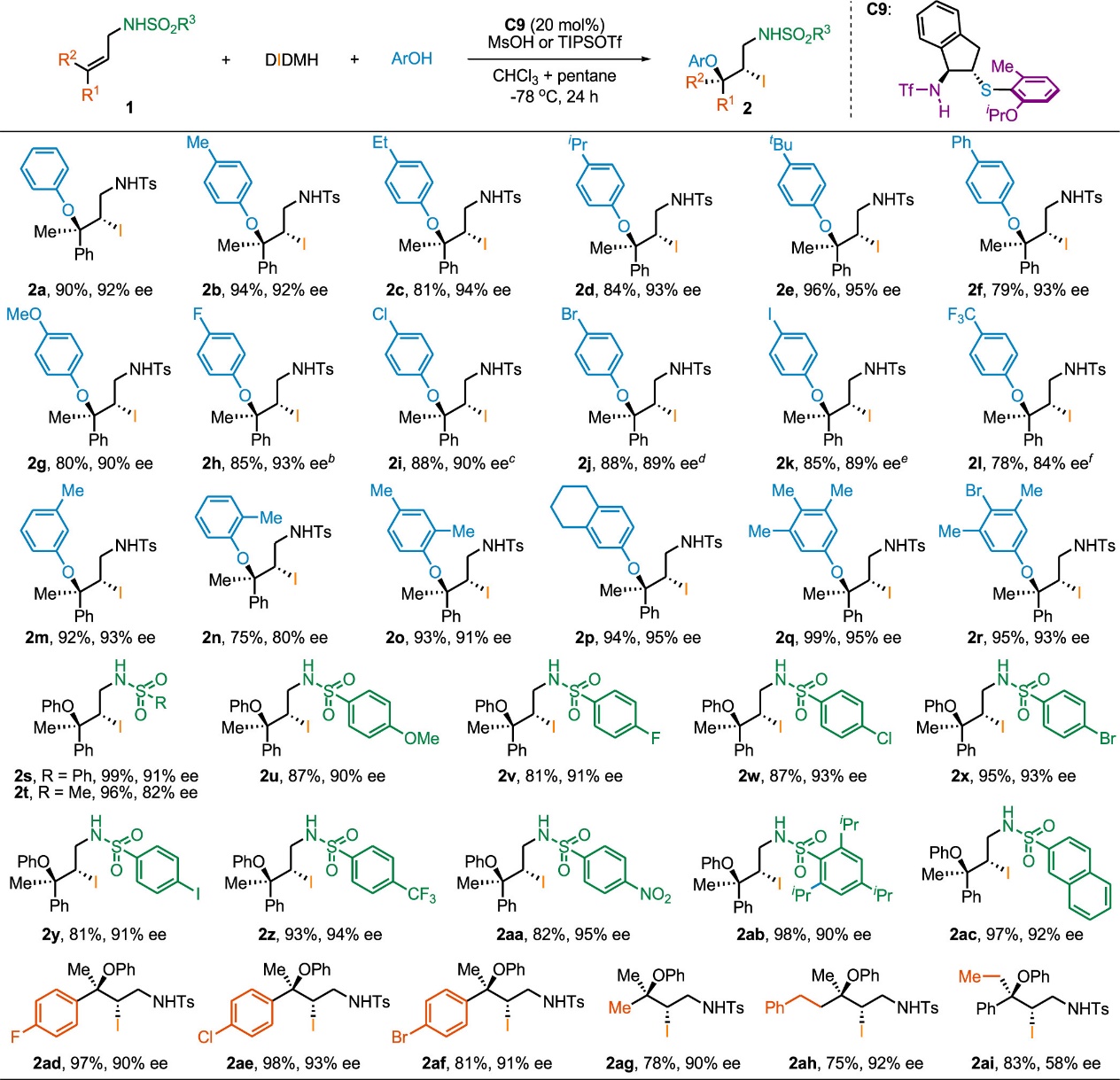
Scheme 2. Asymmetric Iodoaryloxylation of γ,γ-Disubstituted Allylic Sulfonamides
通过使用N-碘代糖精为亲电碘试剂,该反应体系同样适用于1,1-双取代烯丙基磺酰胺的不对称碘化芳氧基化反应(Scheme 3)。有趣的是,产物的单晶结构分析表明,由这类底物所形成的产物的叔烷基醚立体中心与γ,γ-双取代烯丙基胺为底物所形成产物的立体中心的构型是相反的。
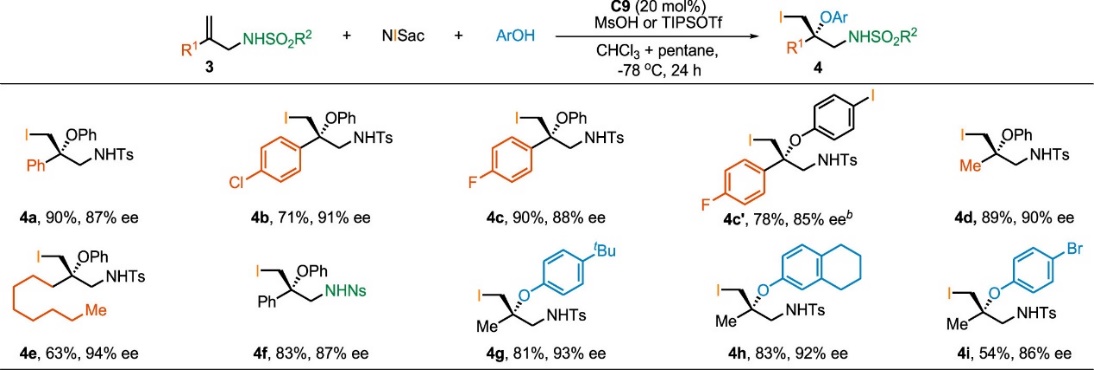
Scheme 3. Asymmetric Iodoaryloxylation of 1,1-Disubstituted Alkenes with an Allylic Sulfonamide Unit
除了酚可被用作亲核试剂外,醇、三乙胺氢氟酸盐、叠氮基三甲基硅烷同样可被用作氧、氟、氮中心亲核试剂,实现烯丙基胺的不对称碘化醚化、碘化氟化和碘化叠氮化反应(Scheme 4)。值得一提的是,当使用二级醇如环己醇为亲核试剂时,反应可以顺利进行,并以高对映选择性获得现有其他方法难以构建的大位阻手性二烷基醚类产物。该方法为二级醇的不对称叔烷基化以构建大位阻的手性二烷基醚衍生物提供了简便高效的策略。此外,该体系首次实现了烯烃的催化不对称碘化氟化反应和首次实现了三取代烯烃的的催化不对称碘化叠氮化反应。
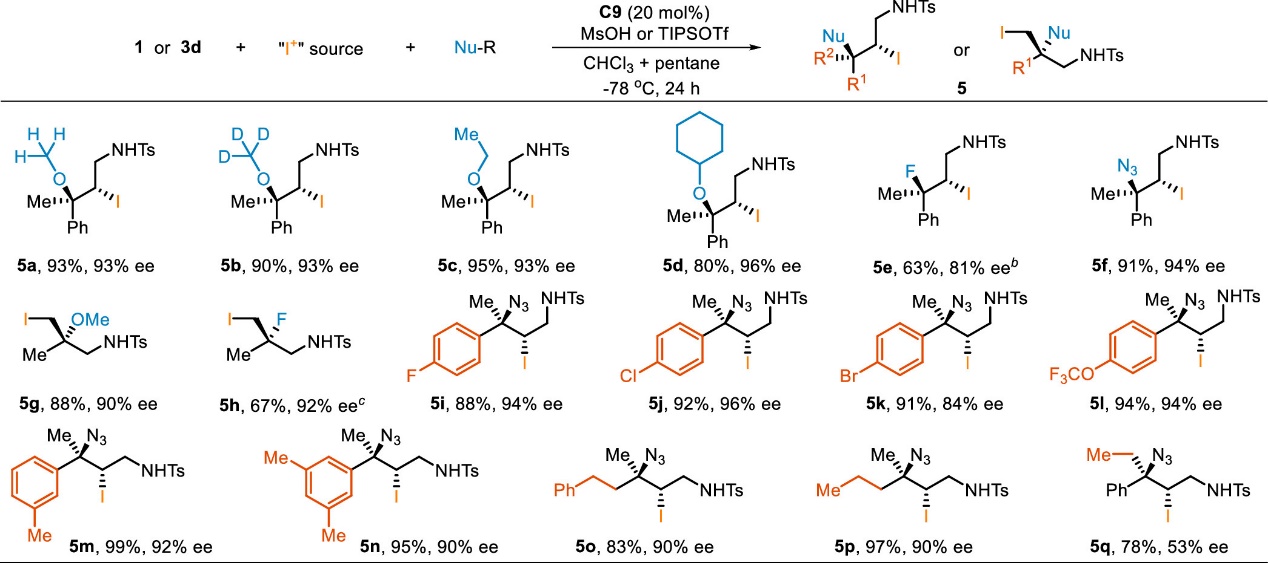
Scheme 4. Asymmetric Iodinative Functionalization of Allylic Sulfonamides with Different Nucleophiles
为了进一步证明所发展方法的实用性,作者进行了克级反应以及对产物进行进一步的衍生化,通过芳基迁移或胺基迁移构建了一系列含氮手性化合物(Scheme 5)。
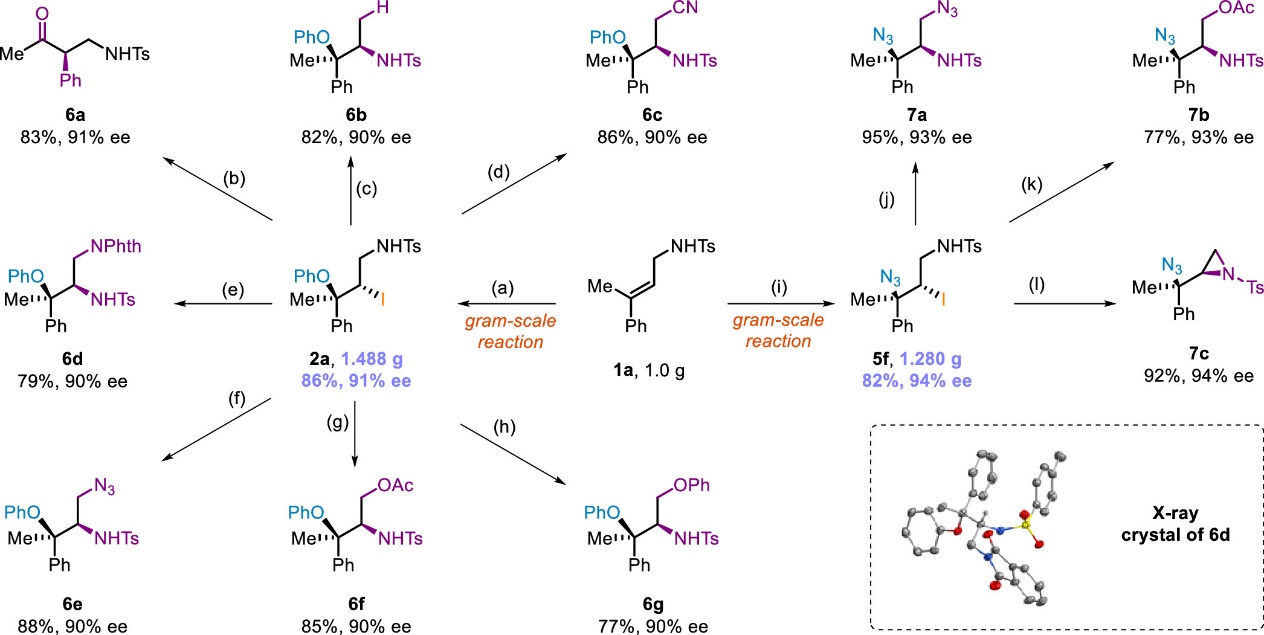
Scheme 5. Construction of Nitrogen-Containing Chiral Molecules via Further Transformations of the Iodinated Products
随后,作者设计了一系列实验来研究该反应的机理(Scheme 6),包括但不限于底物和催化剂氢键效应的研究,不同条件下底物和酚和碘试剂的反应,酚和碘代苯酚的竞争性亲核反应,产物产率与反应时间的关系,催化剂级数,以及非线性效应研究等实验。根据文献报道和相关的机理研究,作者推测反应机理如下(Scheme 7):首先,在甲磺酸的作用下,手性硫醚催化剂C9与二碘海因反应生成可能的中间体,硫醚捕获的碘正离子I。根据观测到的负非线性效应以及催化剂的分数级数,在反应中可能存在由单体I聚集形成的寡聚物II。随后,I通过识别γ,γ-双取代烯丙基胺的Si面,形成具有酸衍生的阴离子桥的碘鎓离子中间体III,其中底物的芳基远离催化剂的芳基。若两个芳基较为靠近时,由于二者的空间位阻,碘鎓中间体IV可能不利于形成。最后,酚对碘鎓中间体III的亲核开环即可得到碘化手性叔烷基醚产物。不同的是,对于1,1-双取代烯丙基磺酰胺为底物的反应,由于γ-位没有较大位阻的基团,硫醚捕获的碘正离子I可选择性地识别底物的Re面,形成中间体V,其中的阴离子桥相比于识别Si面所形成的中间体VI的阴离子桥要更短。随后中间体V被酚进攻即可得到叔烷基醚立体中心与γ,γ-双取代烯丙基胺为底物所形成产物构型相反的产物。
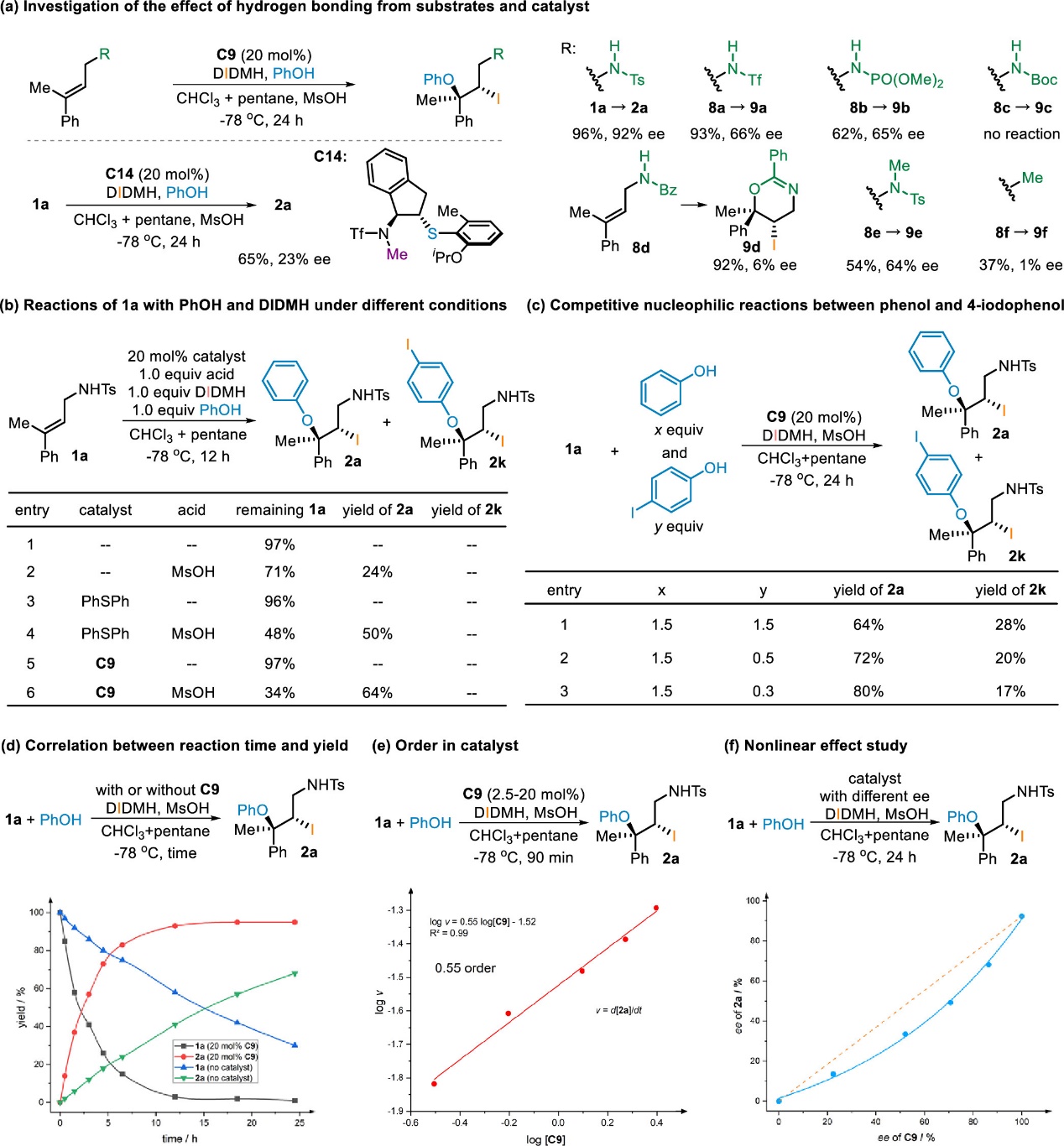
Scheme 6. Mechanistic Insights
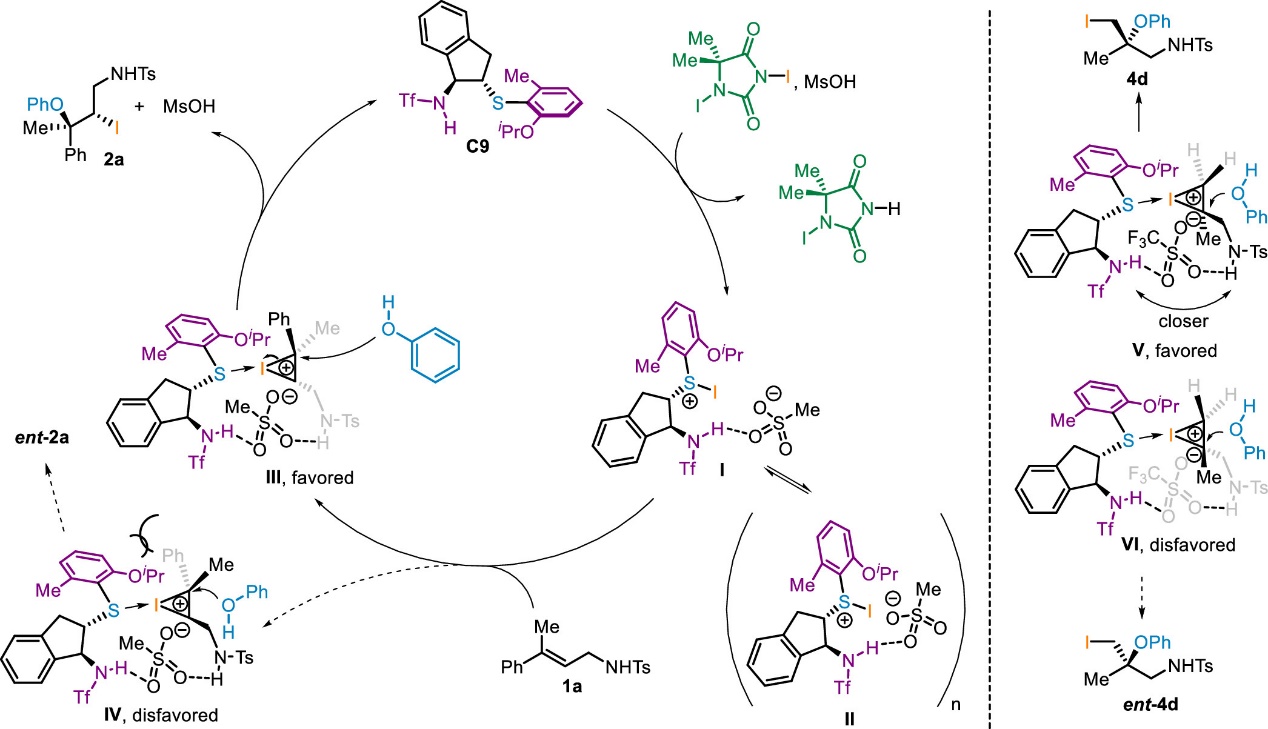
Scheme 7. Proposed Mechanism
总结
中山大学赵晓丹教授课题组发展了一种高效的手性硫醚催化策略,实现了烯烃的对映选择性分子间亲电碘化双官能化反应。通过该策略,γ,γ-双取代烯丙基磺酰胺和1,1-双取代烯丙基磺酰胺可转化为一系列的碘化手性叔烷基醚、叔烷基氟化物和叔烷基叠氮化物。所得的碘化产物是一类很容易转化为其他手性化合物的平台分子。机理研究表明手性硫醚催化剂在控制该碘化反应的反应性和立体选择性上具有重要作用。
(赵晓丹教授供稿)
相关链接:
赵晓丹教授课题组主页:https://ce.sysu.edu.cn/zhaolab/
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载
























No comments yet.