投稿作者张寻
上次的文章中,我们提出把氦放在了碱土金属元素的位置,向大家展示了一个全新的元素周期表。在本文中,我们将指出传统元素周期表的缺点,并提出更加符合21世纪的周期表。
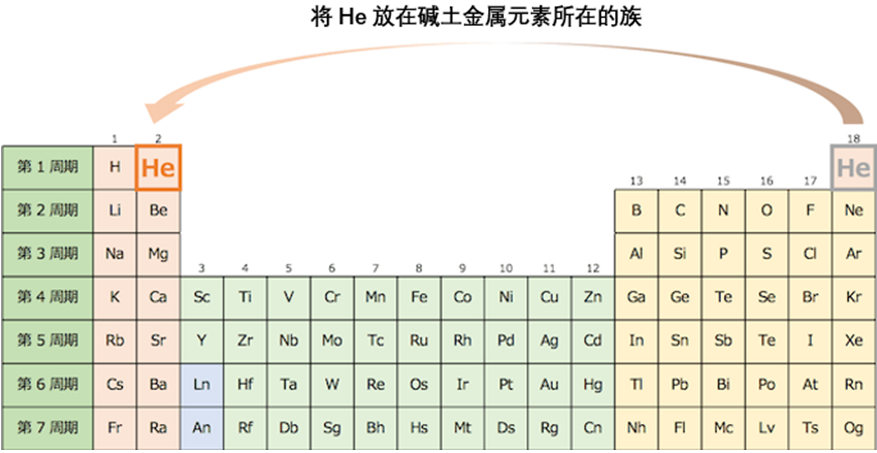
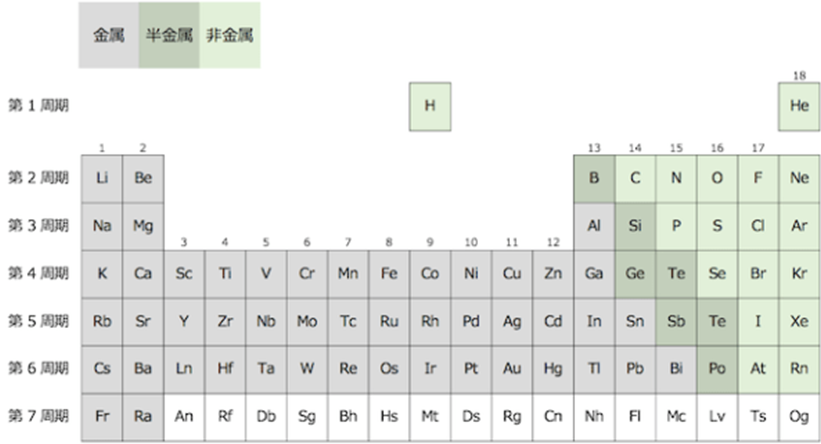
复习一下上次的内容,将氦元素放在碱土金属元素的族中,s区的元素便在左端聚齐了。
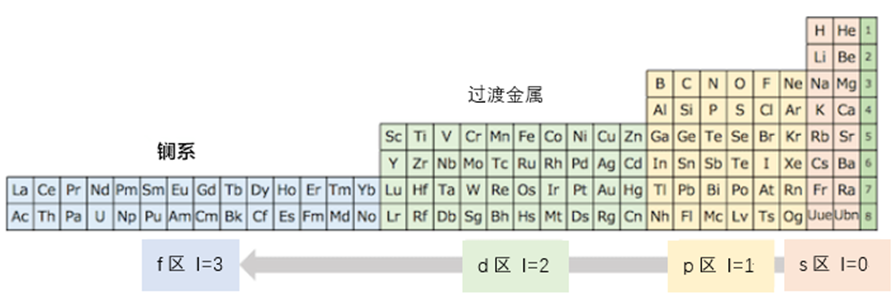
把s区放在p区右边的话,角量子数的规则性更显而易见
现在,我们来复习一下之前讲的内容。我们把氦放在碱土金属元素一族,s区元素因此就在左边聚齐了。但是,这样做仍有不足之处。从周期表左边开始,我们观察一下元素的角量子数的区域排布,是以s,f,d,p这样的顺序进行排列。因此,我认为最好将s区元素放在稀有气体右边。就如同下图所示,将角量子数比较小的区域放在右边,从而可以形成角量子数从右向左依次增大的排序。
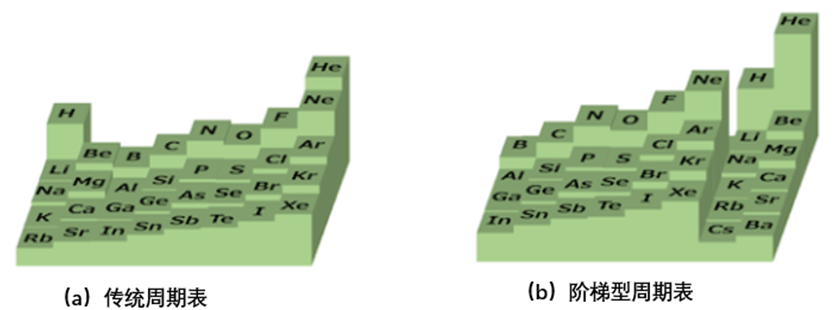
用这种方法的话,f区的元素就可以放在周期表的最左边了。话说在一般情况下,镧系和锕系的元素往往都是被放置在周期表外面的,仅在周期表上注明这两组元素的名字而已,看起来倒是很清爽。顺便说一下,我也预备了第119号元素(Uue)和第120号元素(Ubn)等元素的位置。这个周期表的话,即使在将来发现了g区元素,也不用放在周期表外面,只要增加周期即可。
与传统周期表的比较
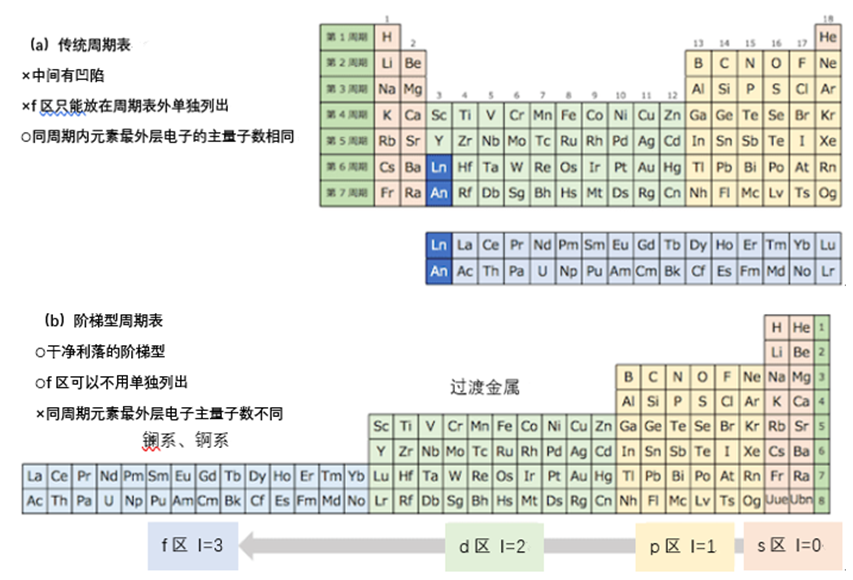
让我们抑制住激动的情绪,一起来看一下这个新的周期表有怎样的优点和问题吧。首先,我们来比较一下传统的周期表和本文提出的周期表。传统的周期表只有七个周期,而本次提出的周期表,第二周期只有Li和Be两种元素,并且有第八个周期。同时,传统的周期表,其中间的部分凹进去了一块,而阶梯型周期表从第二个周期开始像阶梯一样排列,元素数量逐渐增加。传统的凹陷型周期表因为已经被看习惯了,所以能被广泛接受。但是初次出现的阶梯型周期表却总是给人一种不完整、不完善的感觉。这个阶梯型周期表,是1930年由法国化学家Charles Janet提出的,并以他的名字命名,称作Janet周期表。
新的周期数P的定义
现在,我们再来看一下阶梯型周期表,s区以外的元素所属的周期已经发生了改变。例如,铁(Fe)和钴(Co)等3d元素都被放在了第五周期。另一方面,传统的周期表,最外层电子的主量子数是和元素所在周期一一对应的。也就是说,因为铁和钴的最外层电子在4s,所以它们理应属于第四周期。同时,在传统周期表中其他的第四周期元素,比如钾(K)和镓(Ga),它们的最外层为4s和4p电子。因此可以说,在传统的周期表中,各元素所属的周期和其电子排布是相互关联的。而阶梯型的周期表在这一方面就不甚合理了。
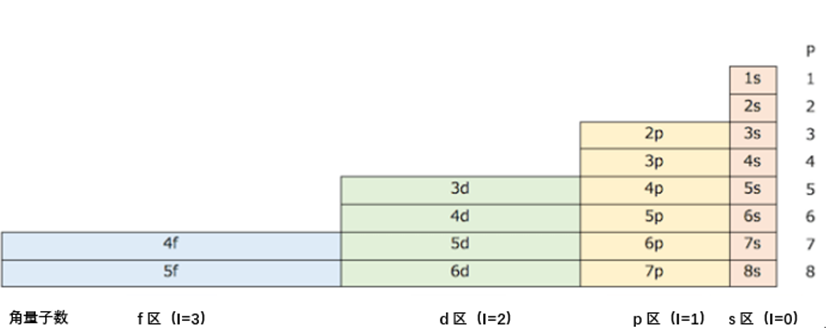
为了应对这个问题,Janet周期表的研究者提出了新的周期数P。关于P的概念,就是根据原子的构造,使用新的电子主量子数(n)和方位量子数(l),如下所示。
P = n + l
例如,Janet周期表中第五周期的3d元素、4p元素以及5s元素的周期数计算如下:
3d 元素 : n + l = 3 + 2 = 5
4p 元素 : n + l = 4 + 1 = 5
5s 元素 : n + l = 5 + 0 = 5
可喜可贺!以上所有的元素P值都是5不是嘛!使用周期数P,就可以完善Janet周期表的周期理论了。
化学性质的规律被破坏了
如上所述,从周期表的外观和原子的构造等角度出发,Janet周期表要比传统的周期表更加简练。但是,对于将s区放在右边的提议,从化学的观点来看,弊端还是很多的。例如,就元素单质的物理状态来说,就会出现一定的混乱。传统的周期表中,左边的区域是金属,右边的区域是非金属,它们之间的对角线上是半金属。但是,如果把s区元素放在右边,这种排列规律就荡然无存了。
还有,离子化能的大小,电子亲和力以及电负性的大小的规则性也一样收到了影响。例如,从元素离子化能的角度来看,如下图所示的3D块状结构图所示,其周期性一览无余。如果我们尝试使用阶梯型周期表的话,稀有气体元素和s区元素之间就会产生一个巨大的坎,从而显得周期表的设计十分粗糙。
本次讲述了新型周期表(阶梯型周期表),传统的凹陷型周期表,以及f区元素在周期表之外的问题该如何解决。同时,文章用简练的语言阐述了这个量子力学的观点,即角量子数在周期表中从左向右逐渐减小。另一方面,对于初学周期表的高中生以及化学研究人员来说,传统的周期表对于元素的化学性质以及周期性描述地更加清晰。因此,我并不主张废除现在使用的周期表。但是如果发现了更多119号以后的元素,阶梯型的Janet周期表或许就会出现在教科书里了吧。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
































No comments yet.