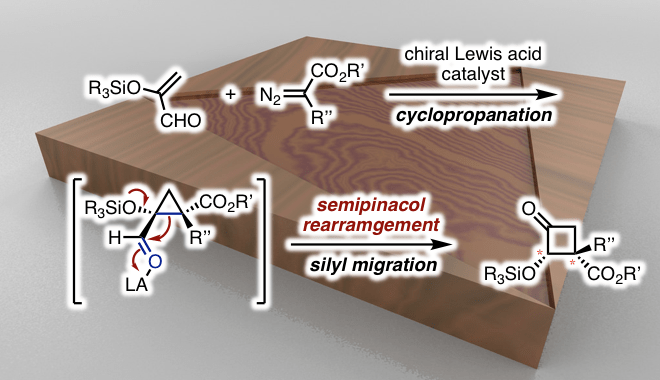
作者开发了一种使用手性路易斯酸催化剂的新型环丁酮不对称合成方法。实现了高非对映体/对映体选择的多米诺型的环丙烷化→半频哪醇重排形成手性多取代环丁酮。
催化不对称环丁酮合成
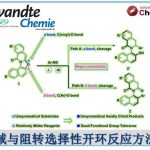
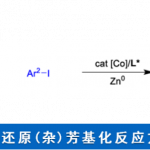
环丁烷衍生物是药物和天然产物中常见的骨架。特别是,环丁酮是一种非常有用的结构单元,可以通过利用环应变的开环和环膨胀反应合成为各种化合物,最近已经有几篇针对该骨架的催化不对称合成方法的报道。例如、最近Dong等人报道了使用钴催化的分子内不对称加氢酰化合成环丁酮(图1A)[1]。另一方面,通过催化半环醇重排环丙醇衍生物合成环丁酮的方法也已经被报道。Alexakis等人在手性磷酸(CPA)催化剂存在下通过链烯基环丙醇的半微量醇重排开发出了β-卤代螺环丁酮合成法(图1B)[2]。作为使用不对称过渡金属催化剂的实例,Toste与Trost等人分别报道了使用金或钯作为催化剂的链烯基环丙醇的半频哪醇重排(图1C)[3]。此外,还报道了通过酸,碱和热将半乳糖醇重排成羰基部分合成环丁酮,但没有对映选择性实例(图1D)[4]。
最近,Ryu教授及其同事使用手性氧杂硼杂环鎓离子(COBI)作为路易斯酸催化剂,通过α-甲硅烷氧基丙烯醛和重氮酯的反应进行连续环丙烷化/半频哪醇重排, 成功地合成了具有立体/对映选择性邻近手性中心的环丁酮(图1E),今天小编就带大家来看一下这个反应。
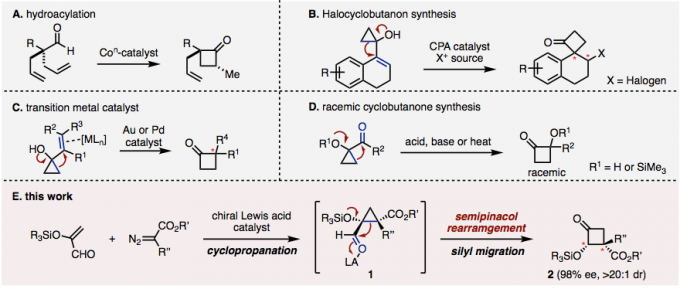
图1.催化不对称环丁酮的合成
“Asymmetric Synthesis of Cyclobutanone via Lewis Acid Catalyzed Tandem Cyclopropanation/Semipinacol Rearrangement”
Shim, S. Y.; Choi, Y.; Ryu, D. H. J. Am. Chem. Soc.2018, 140, 11184−11188. DOI: 10.1021/jacs.8b06835
论文作者介绍

研究者:Do Hyun Ryu
经历:
1993-1997 Ph. D., Department of Chemistry, KAIST (Prof. Sung Ho Kang)
1997-2001 Associate Research Scientist, SK Chemicals, Life Science Institute
2000-2002 Postdoc Fellow, Harvard Medical School (Prof. Robert R. Rando)
2002-2005 Postdoc Fellow, Harvard University (Prof. E. J. Corey)
2005-2009Assistant Professor, Sungkyunkwan University
2009-2015Associate Professor, Sungkyunkwan University
2015- Professor, Sungkyunkwan University
研究内容:催化剂开发、不对称反应开发、全合成研究、化学生物学
论文概要
作者在先前的研究中报道了使用COBI催化剂对不饱和醛和重氮酯进行不对称环丙烷化[5]。在这次研究中,作者使用α-硅氧基丙烯醛,并且利用同样的手法如果能先生成1-甲酰基-1-甲硅烷氧基环丙烷1、然后发生半频哪醇重排,最后形成环丁酮2。反应实际上按预期进行,并且可以应用于各种重氮酯(图2A)。即使使用具有卤素或氰基等官能团的芳基,烷基或具有大体积酯的重氮酯,反应也以高收率,高非对映体/对映体选择性进行。
根据各种对照实验的结果,作者提出了通过过渡态4产生环丁酮2的机理(图2B)。首先,COBI催化剂与不饱和醛的羰基部分配位,重氮酯的1,4-加成平面选择性地发生,并且通过随后的环丙烷化形成4。此外,对由COBI催化剂活化的羰基部分发生半频哪醇重排,并且通过甲硅烷基转移获得目标环丁酮2。
因此,这篇文章报道了一种合成具有连续不对称中心的环丁酮的新方法。 将来,可以预期该方法可用作各种有用复杂化合物中间体合成。
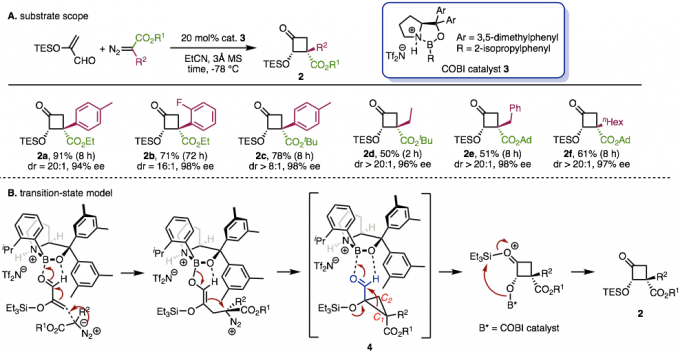
图2. (A)底物适用范围、(B)过渡态模型
参考文献
- Kim, D. K.; Riedel, J.; Kim, R. S.; Dong, V. M. J. Am. Chem. Soc. 2017, 139, 10208. DOI:10.1021/jacs.7b05327
- Romanov-Michailidis,F.;Gueńeé,L.;Alexakis, Angew. Chem., Int. Ed. 2013, 52, 9266. DOI: 10.1002/anie.201303527
- [a]Kleinbeck, F.; Toste, F. D. J. Am. Chem. Soc. 2009, 131, 9178. DOI: 10.1021/ja904055z[b] Trost, B. M.; Yasukata, T.J. Am. Chem. Soc.2001, 123, 7162. DOI: 10.1021/ja010504c
- [a]Paukstelis, J. V.; Kao, J. L. J. Am. Chem. Soc. 1972, 94, 4783. 10.1021/ja00768a086[b] Appendino, G.; Bertolino, A.; Minassi, A.; Annunziata, R.; Szallasi, A.; de Petrocellis, L.; Di Marzo, V. Eur.J. Org. Chem. 2004, 2004, 3413. DOI: 10.1002/ejoc.200400122
- Gao, L.; Hwang, G.-S.; Ryu, D. H. J. Am. Chem. Soc. 2011,133, 20708. DOI: 10.1021/ja209270e
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!























No comments yet.