作者:苏打水
导读:
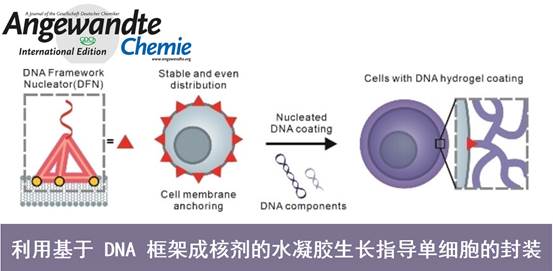
近日,上海交通大学樊春海院士课题组开发了一种单细胞封装的仿生策略,使用 DNA 框架结构作为成核剂 (DFN , DNA framework structure as a nucleator) 来引导 DNA 水凝胶在细胞友好的条件下生长。四面体DFN可以稳定地锚定在细胞膜上,形成均匀且灵活的细胞封装。这种封装可以维持细胞活力并保护细胞免受机械应力诱导的自噬。
Y. Wei, Y. Feng, K. Wang, Y. Wei, Q. Li, X. Zuo, B. Li, J. Li, L. Wang, C. Fan, Y. Zhu, Directing the Encapsulation of Single Cells with DNA Framework Nucleator-Based Hydrogel Growth.
Angew. Chem. Int. Ed. 2024, e202319907. https://doi.org/10.1002/anie.202319907
正文:
在自然界中,大肠杆菌(E. coli)等细菌利用 CsgB 蛋白作为分子成核剂,使 CsgA 蛋白在其细胞表面聚合成核,形成致密的卷曲纤维网络。1这个过程构建了被称为 Curli 的生物膜结构,它在细菌的生物功能中发挥着至关重要的作用,包括宿主细胞粘附和入侵,以及在恶劣环境中的长期生存。另一方面,体外培养的哺乳动物细胞缺乏这种生物膜结构,因此将其脆弱的磷脂双层细胞膜直接暴露于环境中1。因此,通过用人造材料封装单个哺乳动物细胞来模拟天然细菌生物膜可以为细胞提供机械强化,使它们能够抵抗体外培养环境中的机械刺激和渗透压。此外,它允许构建具有可调参数的受限微环境,有效地将细胞与外部环境隔离。这些实用程序对于细胞工程和细胞命运操纵等应用具有重要意义2。
这里,上海交通大学樊春海院士课题组报道了一种单细胞封装策略,通过使用 DNA 框架结构作为成核剂 (DFN) 在细胞友好的条件下启动 DNA 水凝胶的生长状况3。在测试的结构中,四面体 DFN 可以均匀稳定地驻留在细胞膜上,有效启动杂交链式反应,为不同的细胞系产生均匀致密且灵活的单细胞封装。该封装在含血清的细胞培养环境中可持续长达 72 小时,与单链 DNA 成核剂介导的封装相比,性能提高了约 70 倍。封装细胞的代谢和增殖受到抑制,但在释放后可以恢复到原始效率,表明封装具有优异的细胞相容性。还发现,与裸露细胞相比,封装的细胞在经历机械应力后表现出较低的自噬水平,这表明 DNA 封装的保护作用4。该方法可能为离体细胞工程提供新的工具。
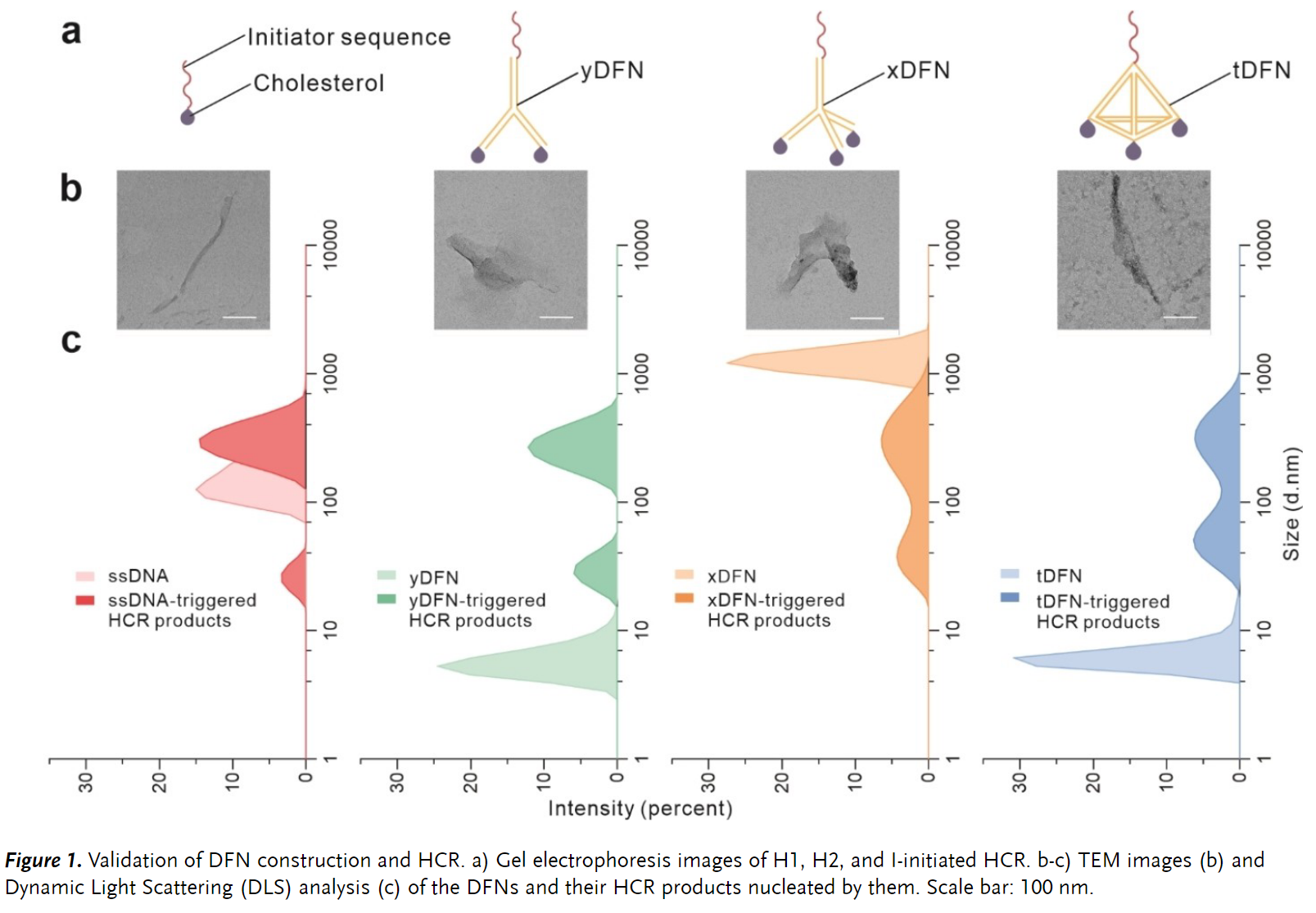
研究人员首先设计了一系列可以锚定在细胞膜上并启动 HCR 进行原位 DNA 水凝胶生长的 DFN。DFN 由三个模块组成:用于膜锚定的疏水基团、用于 HCR 凝胶过程的引发序列以及用于组织前两个组件的空间排列的 DNA 框架结构。设计并合成了几种不同的 DFN,包括 Y 形、X 形和四面体 DFN(分别表示为 yDFN、xDFN 和 tDFN),以及胆固醇修饰的单链 DNA 成核剂(chol- ssDNA)作为对照。分别使用 DNA 凝胶电泳和动态光散射 (DLS) 来表征这些成核剂,并验证了这些成核剂在溶液中引发 HCR 进行 DNA 聚合的能力(Figure 1)。
接着,利用 HeLa 细胞系作为模型来研究这些成核剂在细胞表面的锚定和分布,使用共焦显微成像和流式细胞术分析对样品进行研究,检查了细胞表面不同成核剂结构的锚定密度。(Figure 2)。
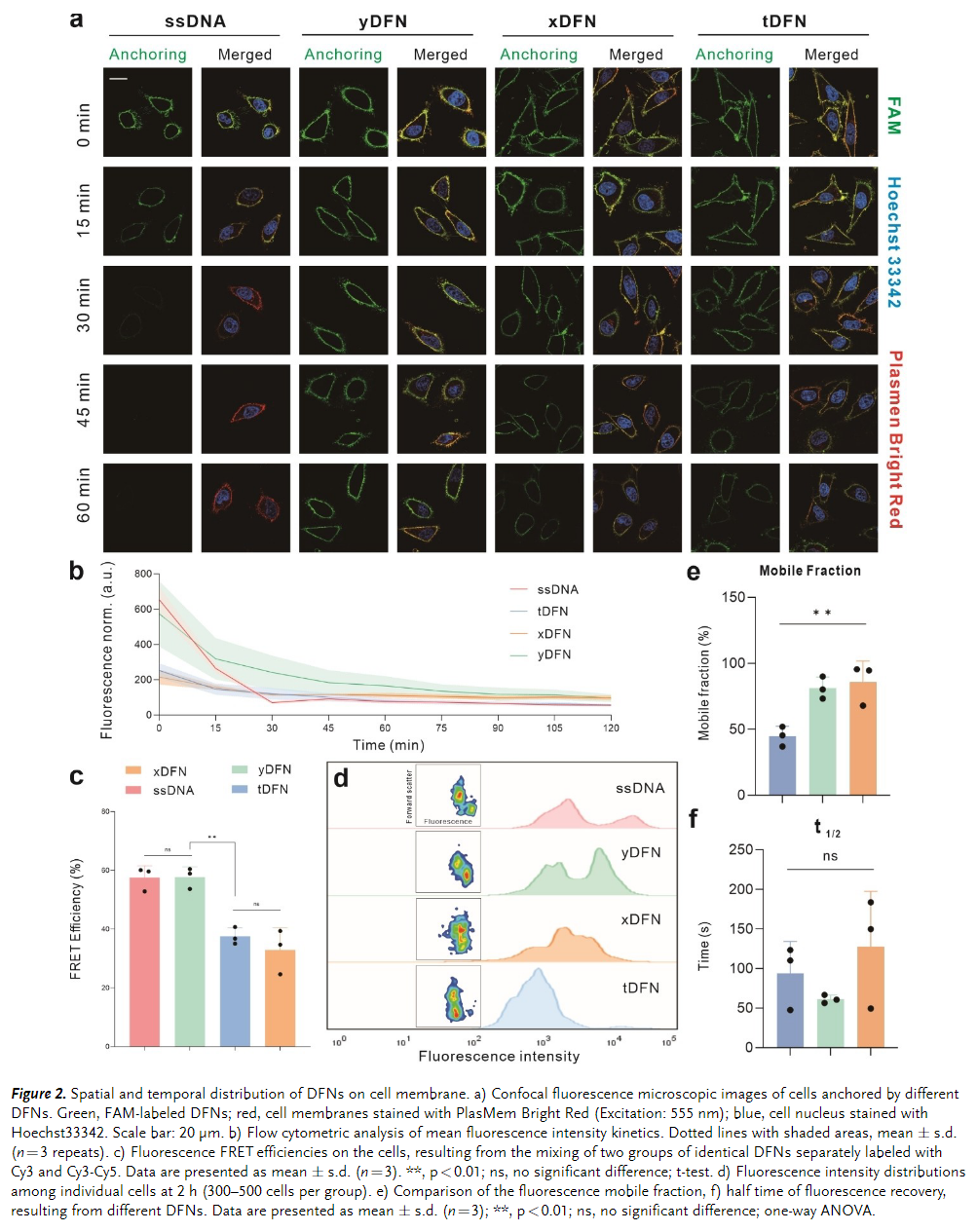
另一方面,研究了不同成核剂结构在细胞表面的锚定稳定性。通过结果分析,认为相对刚性的结构tDFN 在控制结构内胆固醇之间以及 DNA 框架之间的距离方面发挥着作用。这使得溶液中和细胞膜上都具有单分散性,从而能够在较长时间内受控且均匀地锚定在细胞膜表面。
接下来,使用 tDFN 介导的单细胞 DNA 水凝胶封装来自 CCRF-CEM 悬浮细胞系的单个细胞,进行了共焦显微成像和细胞切片 TEM 表征以可视化所得的 DNA 封装(Figures 3a-b)。从 z 轴堆叠共焦显微镜重建的 3D 图像中和TEM 图像显示细胞膜外存在阳性染色层观察到DNA水凝胶含有高度多孔的网络结构,验证了单细胞 DNA 水凝胶封装的形成。
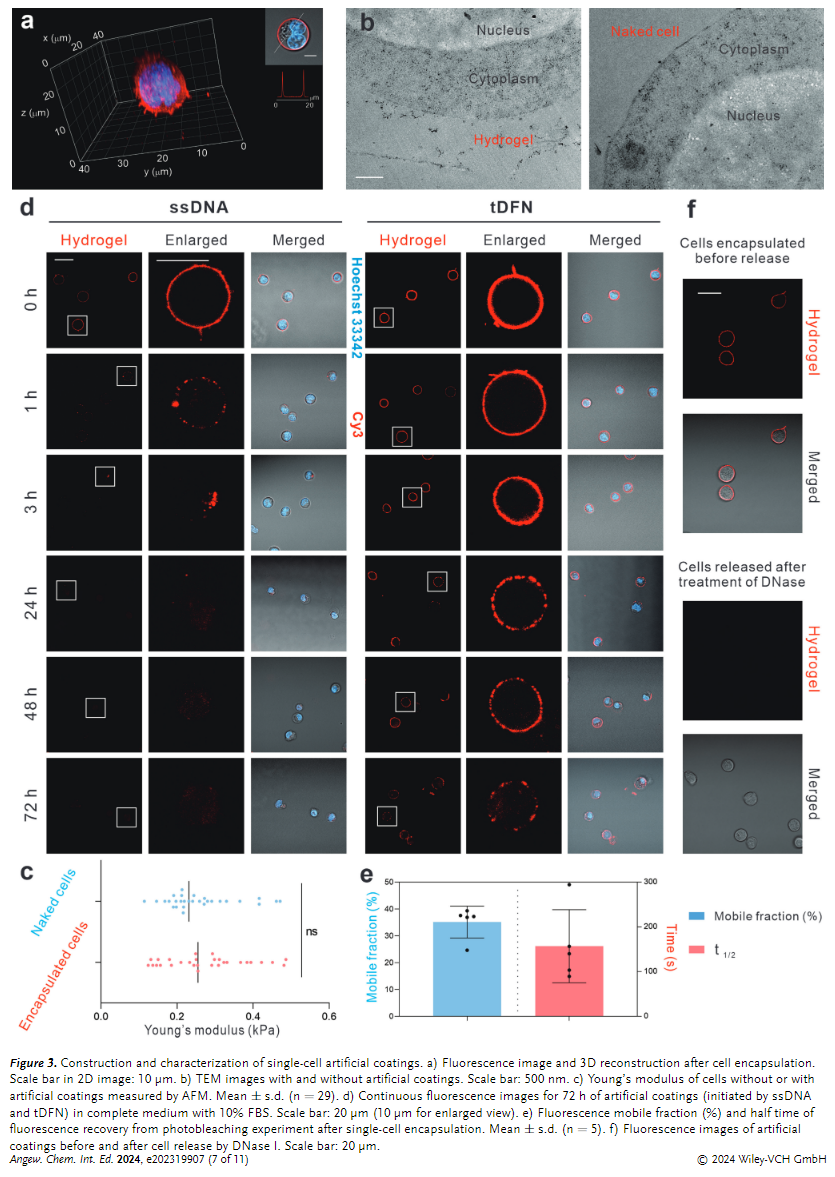
之后,使用 AFM 力谱分析了 DNA 封装层对封装细胞机械性能的影响(Figure 3c),进一步评估了 DNA 封装层在含有 10% (v/v) 血清的完全培养基中的稳定性(Figure 3d),探索了 DNA 封装层在细胞表面的移动性(Figure 3e),评估了 DNA 单细胞封装的可降解性(Figure 3f)。结果表明该DNA封装层可能不会对细胞造成机械刺激和损伤,tDFN 可以稳定地锚定在细胞膜上, DNA 水凝胶在细胞膜上具有流动性,能够实现自我恢复和封装的适应性,并且可以有效降解。
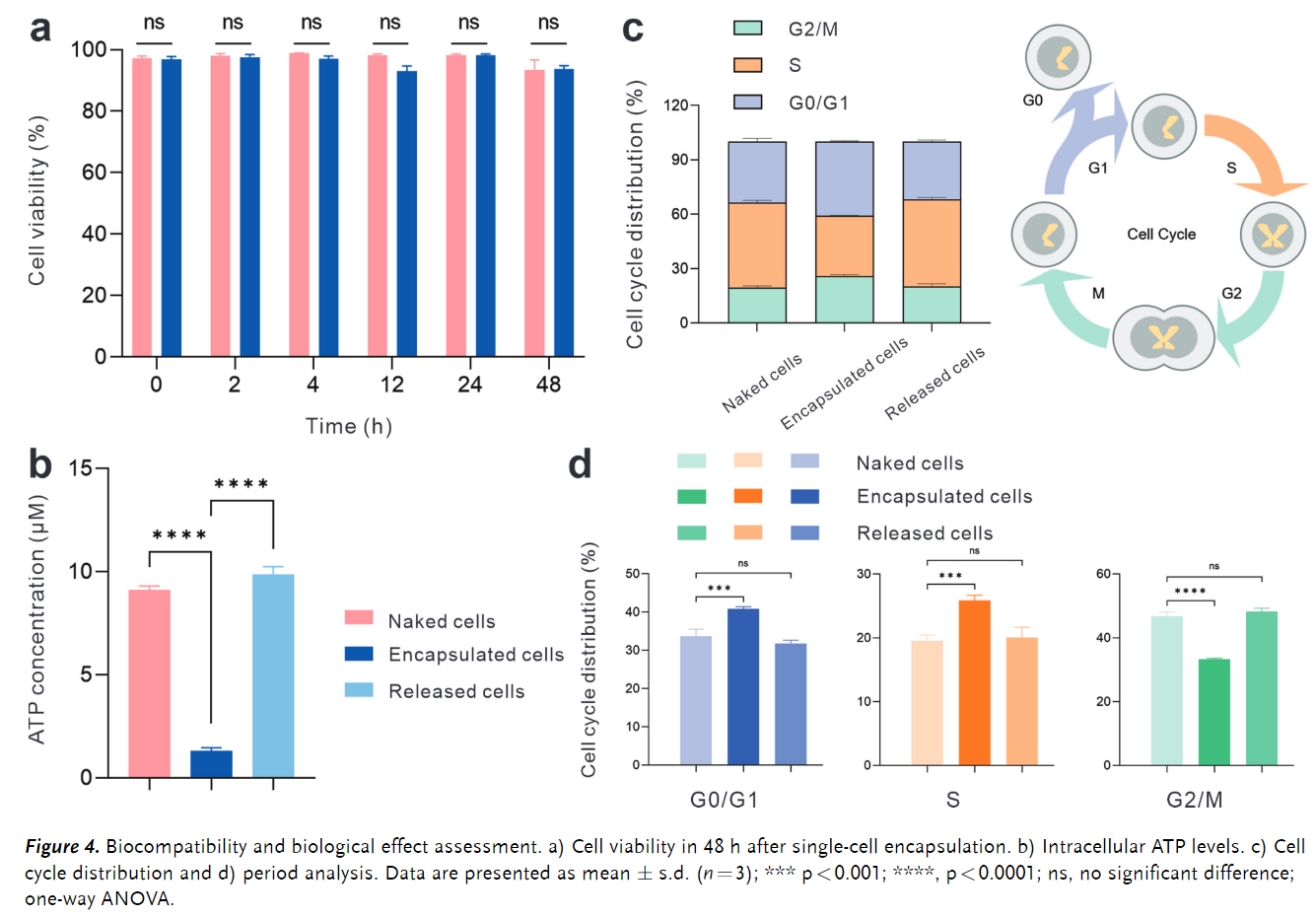
在实现稳定的单细胞封装后,进一步评估了其对细胞活力的影响(Figure 4a),研究了 DNA 封装对细胞代谢和增殖的影响(Figure 4b), 利用流式细胞术分析封装细胞的细胞周期表明,封装会阻碍细胞分裂,但解封装后,细胞可以恢复到与裸细胞相似的细胞周期(Figures 4c-d),结果显示48小时内封装的细胞与裸细胞表现出相当的活力,表明封装材料具有优良的细胞相容性。同时,解封装后的细胞再培养48小时,其ATP水平能够恢复到与正常生长细胞相当,且DNA封装不会对细胞活力或基本功能造成不可逆的损伤。
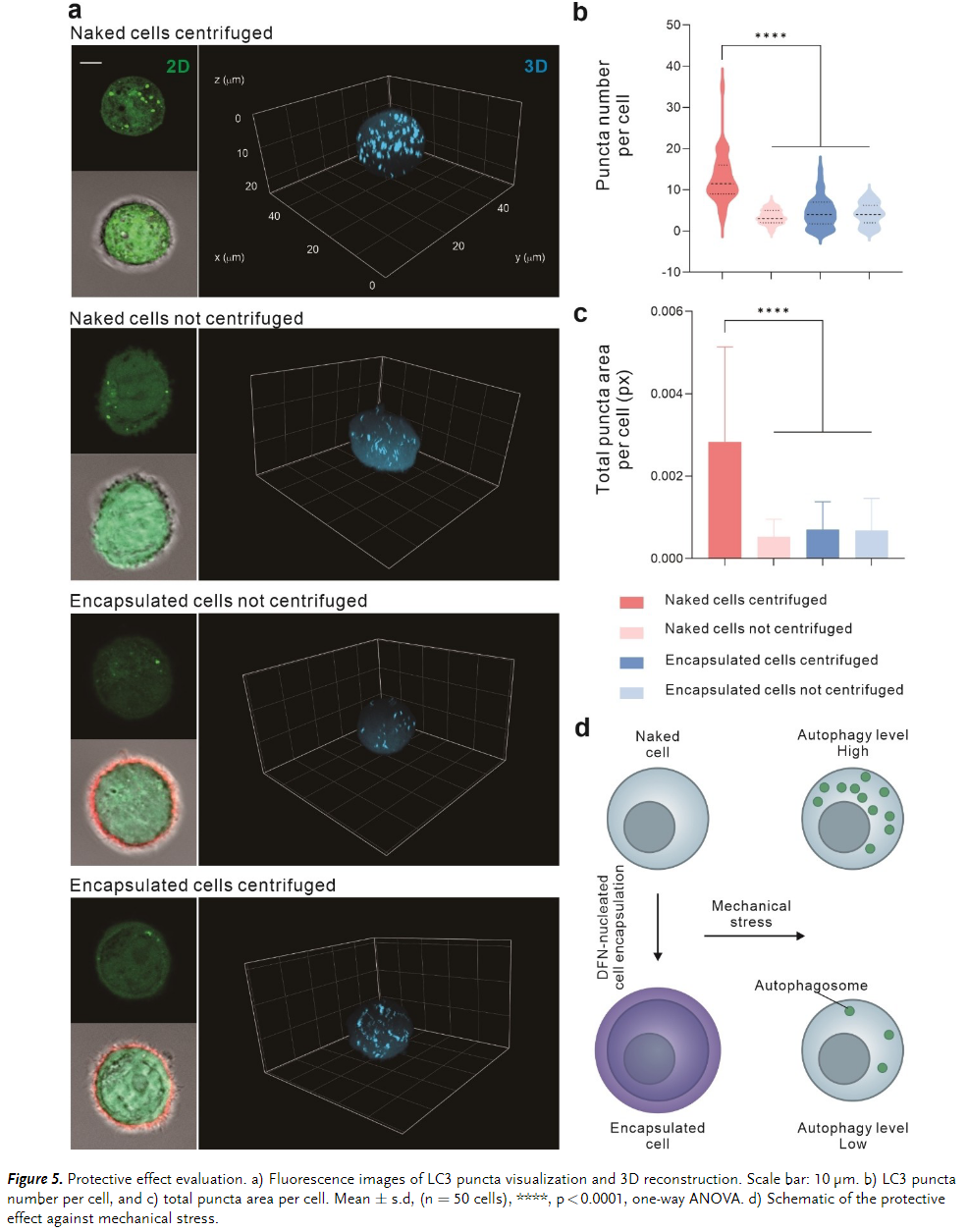
在确认了水凝胶的生物相容性和稳定性后,进一步评估了 DNA 封装为细胞提供机械保护的能力。人们认为机械刺激会触发细胞自噬,这是生物医学研究中至关重要的过程。通过量化共聚焦图像中每个细胞中 LC3 荧光点(表示自噬体)的数量和面积,表明单细胞 DNA 水凝胶封装可以充当保护壳,具有对机械应力的抵抗力(Figure 5)。
总结:
上海交通大学樊春海院士课题组报道了利用不同的DNA结构作为成核剂来介导DNA水凝胶在细胞膜上的生长并产生单细胞封装的方法,四面体 DNA 纳米结构 (tDFN) 可以稳定地锚定在细胞膜表面,从而实现细胞友好、稳定和均质的单细胞封装。鉴于DNA框架能够调节界面上功能分子的空间排列,研究人员实现了均匀稳定分布在细胞表面的DNA生长成核位点,在单细胞封装的稳定性、细胞相容性和可控降解之间取得了平衡,此外,DNA封装表现出抵抗机械刺激诱导的细胞自噬的能力,这种能力除了提供细胞机械保护外,还可能为未来某些自噬相关疾病的机制研究提供新的工具模型。DNA 封装可以与多种识别分子结合,例如抗体、适体和用于碱基配对的 DNA 突出端,从而赋予封装细胞新的所需识别能力。这可能会扩展该系统在再生医学和细胞治疗中的应用潜力。
参考文献:
- [1] M. N. Hsu, S.-C. Wei, S. Guo, D.-T. Phan, Y. Zhang, C.-H. Chen, Small 2018, 14, 1802918. doi: 10.1002/smll.201802918
- [2] W. Youn, E. H. Ko, M.-H. Kim, M. Park, D. Hong, G. A. Seisenbaeva, V. G. Kessler, I. S. Choi, Angew. Chem. Int. Ed. 2017, 56, 10702. doi: 10.1002/anie.201703886
- [3] C. Liang, J. Chen, M. Li, Z. Ge, C. Fan, J. Shen, Chem. Commun. 2022, 58, 8352. doi: 10.1039/D2CC03451D
- [4] T. Aikawa, T. Konno, K. Ishihara, Soft Matter 2013, 9, 4628. doi: 10.1039/C3SM50394A
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.




















No comments yet.