导读
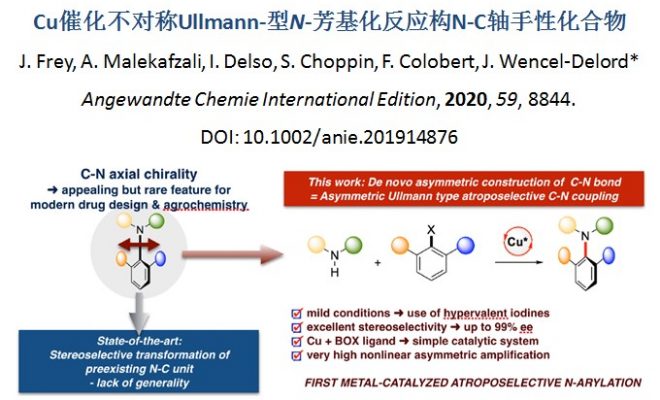
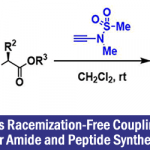
N-C轴手性化合物广泛应用于药物设计、农业化学、新型手性配体以及材料化学领域,因此,发展全新的N-C轴手性化合物不对称合成方法学成为化学家们关注的焦点。目前,合成N-C轴手性化合物方法包括非金属催化的去对称化反应[1]、苯胺衍生物的N-官能团化反应[2]、胺前体的环加成反应[3]以及N-Ar骨架的C-H官能团化反应[4]等,然而,有关金属催化的不对称芳基胺化反应构建N-C轴手性骨架却未有文献报道。在上述背景研究的基础上,法国Strasbourg大学Wencel-Delord课题组报道了在温和反应条件下,铜催化下,由高价碘试剂参与的阻转选择性Ullmann-型N-芳氨基化反应,能以中等至良好的收率和良好至优良的对映选择性获得一系列N-C轴手性化合物。该方法成功克服了Buchwald-Hartwig偶联反应和Ullmann偶联反应中存在的需要高温条件以及对阻转选择性Ullmann-型N-芳氨基化敏感等问题(Figure 1)。相关研究成果发表于
“Enantioselective synthesis of N-C axially chiral compounds by Cu-catalyzed atroposelective aryl amination”
Johanna Frey, Alaleh Malekafzali, Isabel Delso, Sabine Choppin, Françoise Colobert, and Joanna Wencel-Delord* Angew. Chem. Int. Ed. 2020, 59, 8844-8848. DOI: 10.1002/anie.201914876
Figure 1 合成N-C轴手性化合物的新方法
论文概要
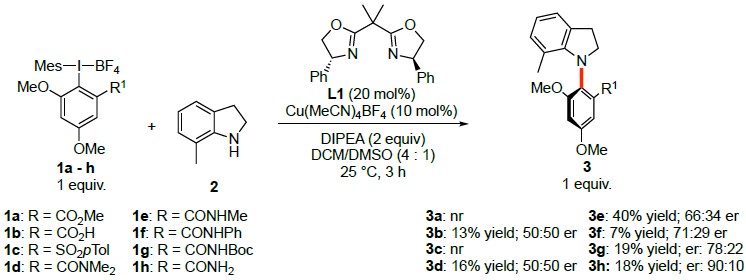
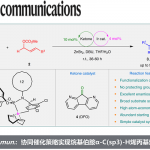
以二氢吲哚2为模板底物,作者对高价碘试剂1a-h、催化剂、碱等反应条件反复筛选,确定最优反应条件(Scheme 1,2):高价碘试剂1h为模板底物,以10 mol% Cu(MeCN)4BF4与20 mol% L1作为手性催化体系,Lewis酸为BF3•(OEt)2和DIPEA作为碱[下图反应条件中原作者遗漏BF3•(OEt)2],DCM/DMSO为溶剂,在室温反应条件下反应18小时,能以76%的收率和>98%的收率得到3h。
Scheme 1 条件筛选
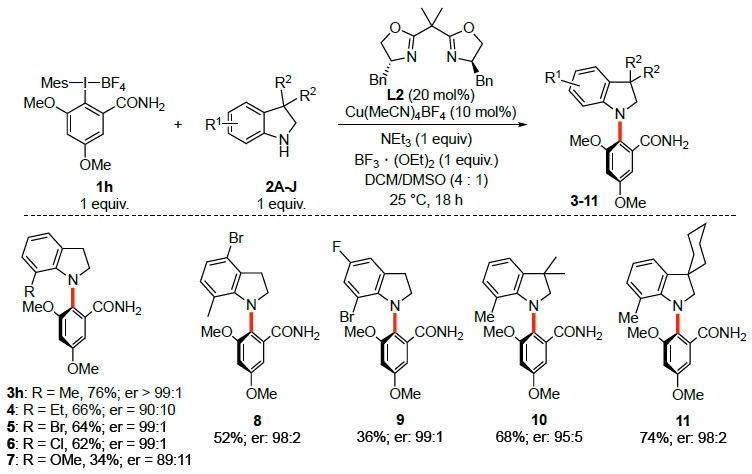
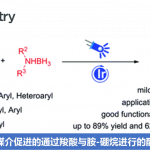
在最优反应条件下,作者考察了二氢吲哚的底物范围(Scheme 2)。各种7位吸电子取代、既有吸电子基团又有供电子基团取代的二氢吲哚以及3-二取代二氢吲哚能较好地适应上述最佳的反应条件,能以中等至良好的收率和优良的对映选择性得到相应产物。但7位为给电子取代的二氢吲哚只能以良好的对映选择性得到相应产物。
Scheme 2 二氢吲哚的底物范围
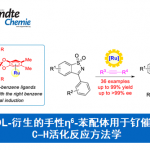
接下来,作者考察了各种高价碘试剂的适用范围(Scheme 3)。高价碘试剂中2-位为OiPr取代时,7-甲基或7-溴取代的二氢吲哚均能较好的适应最优反应条件,均能以良好的收率和优良的对映选择性得到相应产物。高价碘试剂中2-位为甲基取代同时4-位为氢时,各种7位吸电子以及给电子取代的二氢吲哚均能以良好的对映选择性得到相应产物,但未取代的二氢吲哚只能得到消旋产物。当高价碘试剂对位为甲氧基取代或甲基时,产物的收率会降低。同时,各种2-溴、氯以及三氟羰基取代的高价碘试剂能与二氢吲哚反应较好,均能以中等的收率和优良的对映选择性得到相应产物。四氢喹啉也能适应反应条件,但只能以较低的收率和良好的对映选择性得到相应产物。
Scheme 3 高价碘试剂的底物范围
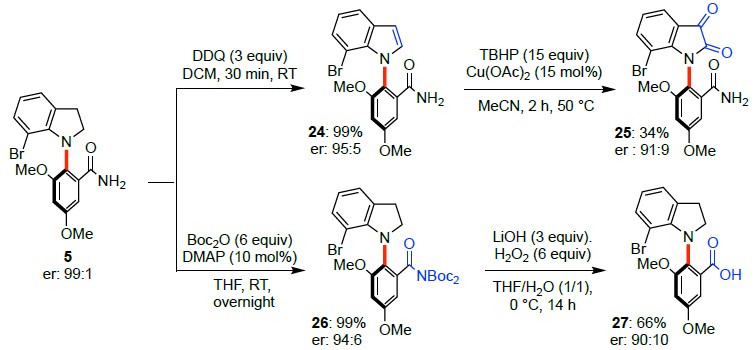
为了证明反应的应用潜力,作者进行了一系列衍生反应(Scheme 4)。5可被氧化为轴手性吲哚化合物24或二氢吲哚-2,3-二酮25。同时,5的酰胺可被Boc基团保护生成26,26又可被转化为相应的羧酸27。
Scheme 4 衍生反应
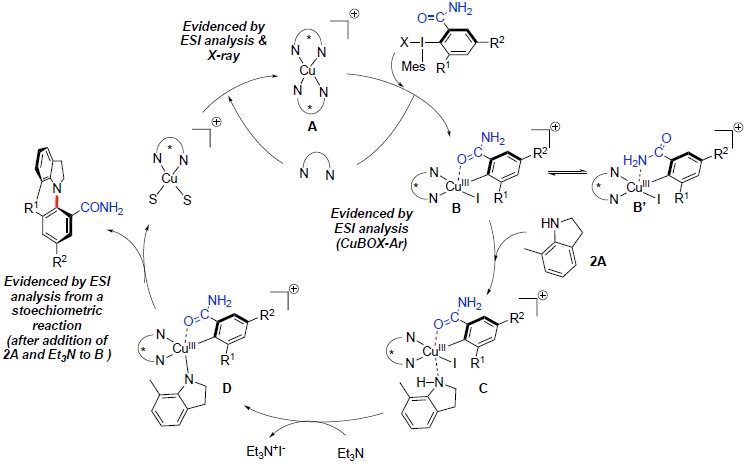
根据实验结果和之前的报道,作者推测可能的反应机理(Scheme 5):1)生成Cu(BOX)2配合物A;2)高价碘试剂1h与配合物A发生配位、氧化加成过程生成中间体B;3)在催化剂作用下,中间体B与二氢吲哚2A发生与Cu中心配位生成中间体C;4)中间体C在三乙胺作用下转化为中间体D;5)最后,中间体D经过还原消除反应生成轴手性产物。
Scheme 5 反应机理
论文总结评价
法国Strasbourg大学Wencel-Delord课题组报道了在温和反应条件下,铜催化下,由高价碘试剂参与的不对称Ullmann-型N-芳基化反应,能以中等至良好的收率和良好至优秀的对映选择性得到一系列N-C轴手性化合物。该方法成功的克服了Buchwald-Hartwig偶联反应和Ullmann偶联反应中存在的需要高温条件以及对空间位阻敏感等问题
参考文献
- [1] E. Diener, A. J. Metrano, S. Kusano, S. J. Miller, J. Am. Chem. Soc. 2015, 137, 12369-12377. DOI:10.1021/jacs.5b07726
- [2] Fan, X. Zhang, C. Li, Z. Gu, ACS Catal. 2019, 9, 2286-2291. DOI:10.1021/acscatal.8b04789
- [3] Tanaka, K. Takeishi, K. Noguchi, J. Am. Chem. Soc. 2006, 128, 4586-4587. DOI:10.1021/ja060348f
- [4] Li, X. Yan, J. Zhang, W. Guo, J. Jiang, J. Wang, Angew. Chem. Int. Ed. 2019, 58, 6732-6736. DOI:10.1002/anie.201901619
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.