本文作者:杉杉
导读
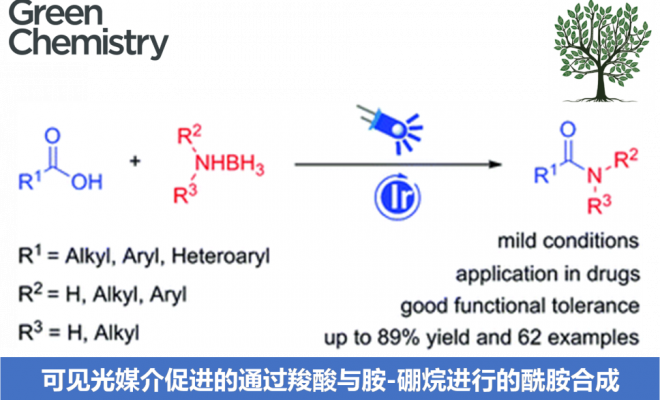
近日,河南师范大学陈学年与马艳娜课题组合作在Green Chemistry中发表论文,报道采用光催化的羧酸与胺-硼烷 (amine-borane)之间的去氧酰胺化 (deoxygenative amidation)方法学,进而完成一系列官能团化的酰胺分子的构建。该方法学具有反应条件温和、原料易得、底物范围广泛、优良的官能团兼容性等优势。同时,作者通过对部分药物分子后期官能团化 (late-stage functionalization)以及克级规模实验的研究,进一步证实该方法学具有优良的合成应用价值。
Visible light-mediated synthesis of amides from carboxylic acids and amine-boranes
Y.Miao, J.Kang, Y. Ma, X. Chen, Green Chem.2021,23, 3595. doi: 1039/D1GC01157J.
正文
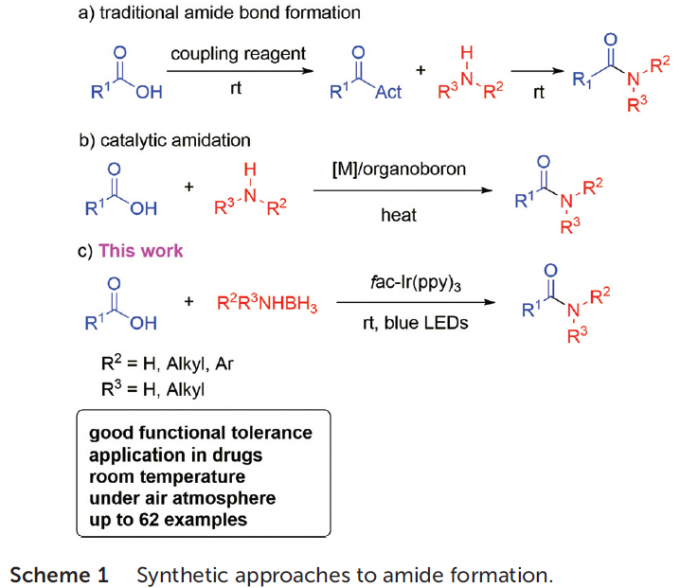
酰胺骨架广泛存在于天然产物、药物以及农用化学品等相关的分子结构中。羧酸与胺的直接缩合是构建酰胺分子最为经典的方法,然而,这一方法通常需要苛刻的反应条件,抑制羧酸铵盐形成,进而使该方法在合成中的进一步应用受到较大的限制。为了解决这一问题,目前已开发出多种偶联试剂,进而对羧酸底物进行活化,使羧酸与胺的直接缩合过程能够在更加温和的反应条件下进行 (Scheme 1a)。然而,偶联试剂的选择,通常使反应过程的原子经济性显著降低。为提高上述缩合反应方法学的原子经济性,采用金属催化或硼催化形成酰胺键的方法学作为一种有效的替代方案已有诸多文献报道[1]-[6]。然而,却需要更高的反应温度 (Scheme 1b)。最近,Ramachandran等[7]采用胺-硼烷配合物 (amine-borane, NH3BH3)作为双重反应试剂 (dual-purpose reagent),进而能够高效地完成一系列羧酸底物的酰胺化反应。然而,较高的反应温度,使这一反应方法学的底物应用范围受到较大限制。因此,需要发展更为通用与绿色的反应策略,进行酰胺分子的构建。
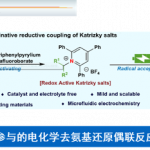
近年来,光氧化还原催化策略备受关注,同时,这一策略中,通过单电子转移 (SET)过程形成的酰基自由基,同样能够应用于羧酸分子的活化。2015年,Wallentin等[8]报道首例在可见光催化条件下,采用芳香羧酸作为起始原料进行的烯基化合物串联酰基芳基化反应方法学 (tandem acylarylation)。并且,Wallentin小组[9]进一步开发出在光氧化还原催化条件下,烯基化合物的多组分1,2-酰基烷基化 (1,2-acylalkylation)反应方法学。之后,Zhu与Xie等[10]-[13]相继报道在可见光氧化还原催化下,采用羧酸与氢硅烷 (hydrosilanes)[10]或H2O[11] 试剂参与的烯基化合物的氢酰化反应 (hydroacylation)、通过氢硅烷[12]或D2O[13]试剂参与的羧酸去氧还原 (deoxygenative reduction)或氘代反应 (deuteration)方法学。然而,目前,酰基自由基在可见光媒介反应中的相关应用,则仅限于将酰基自由基应用于碳-碳多重键 (carbon-carbon multiple bond)的直接加成,最终获得醛或氘代醛[14]。同时,采用光氧化还原催化的方式实现羧酸直接转化为酰胺的方法学策略则尚未有文献报道。在此,本文报道首例通过SET过程产生酰基自由基,并选择适宜的胺源 (amine source)进行捕获,进而形成相应酰胺键的合成转化策略。
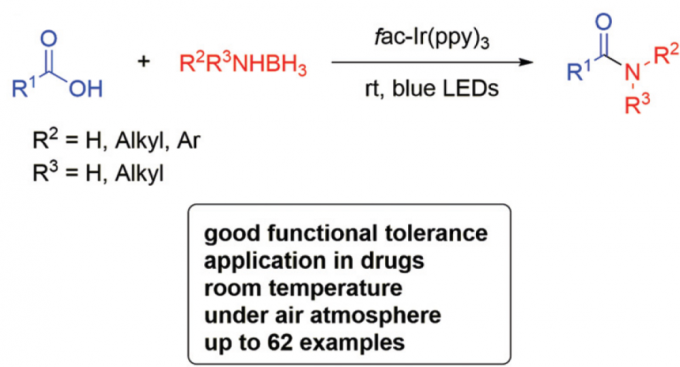
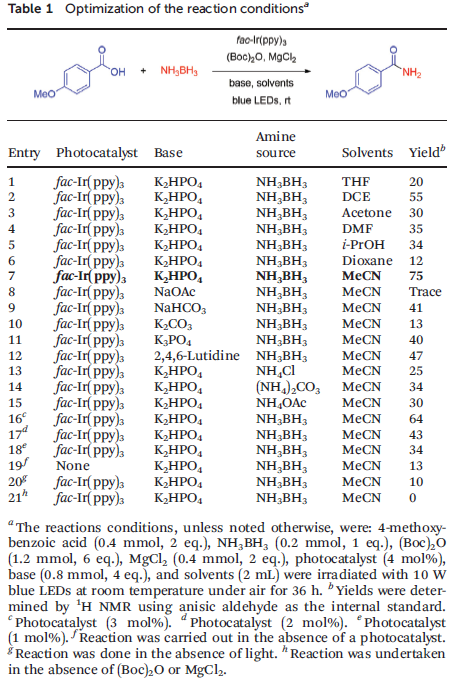
首先,作者采用4-甲氧基苯甲酸与NH3BH3 (胺源)之间的反应作为模型反应,进行了相关反应条件的优化筛选 (Table 1)。确定最佳的反应条件为:采用fac-Ir(ppy)3作为光催化剂,K2HPO4作为碱,同时,加入MgCl2对Boc2O进行活化,在乙腈溶剂中,蓝光LED照射下进行反应。最终,获得75%收率的酰胺产物 (entry 7)。
在获得上述最佳反应条件后,作者开始对羧酸底物的应用范围进行考察(Scheme 2)。研究表明,一系列芳基中具有不同取代基团的芳香羧酸底物,均能够与上述反应条件良好地兼容,并获得相应酰胺产物1–33。同时,萘基以及杂芳基取代的羧酸底物,同样有效地参与上述酰胺化过程,并获得相应的产物34–38。而且,一系列脂肪族羧酸同样能够与上述的酰胺化反应条件较好地兼容,并获得产物39–42。然而,对于具有较高立体位阻的底物,例如2,4,6-三甲基苯甲酸与三苯基乙酸,则无法顺利完成上述的转化过程 (Scheme 2)。
接下来,作者对胺-硼烷配合物的应用范围进行深入研究 (Scheme 3)。实验结果表明,一系列由一级胺与二级胺形成的胺-硼烷配合物,均能够有效地完成上述的去氧酰胺化反应,并获得相应的二级与三级酰胺产物43–48。同时,研究发现,由环二级胺形成的硼烷配合物同样能够较好地与上述去氧酰胺化的反应条件兼容,并获得相应酰胺产物49与50。值得注意的是,芳胺-硼烷配合物中,芳基取代基的电子效应对反应活性存在显著的影响,具有吸电子基团取代的芳胺-硼烷配合物,反应收率出现显著降低 (52,15%)。
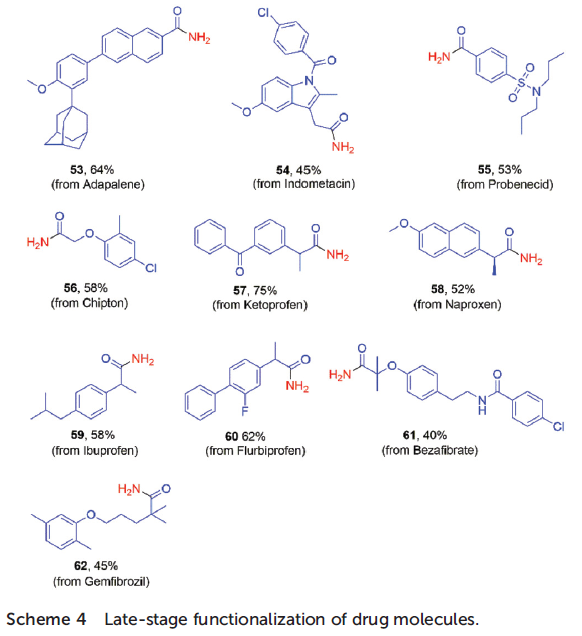
为了进一步阐明上述光氧化还原去氧酰胺化 (photoredox deoxygenative amidation)方法学的合成应用价值,作者采用这一全新的酰胺化方法学,对部分药物分子进行相应的后期修饰 (late-stage modification, Scheme 4)。实验结果表明,一系列具有敏感性官能团 (例如酰胺、酮等)的结构较为复杂的羧酸底物均能够与NH3BH3有效地反应,以中等至良好的收率,获得相应的酰胺产物53–62。接下来,该小组进行上述光氧化还原去氧酰胺化反应方法学的克级规模实验研究。研究发现, 4-甲氧基苯甲酸与NH3BH3的克级放大实验,同样能够获得65%收率的4-甲氧基苯甲酰胺 (Scheme 5)。
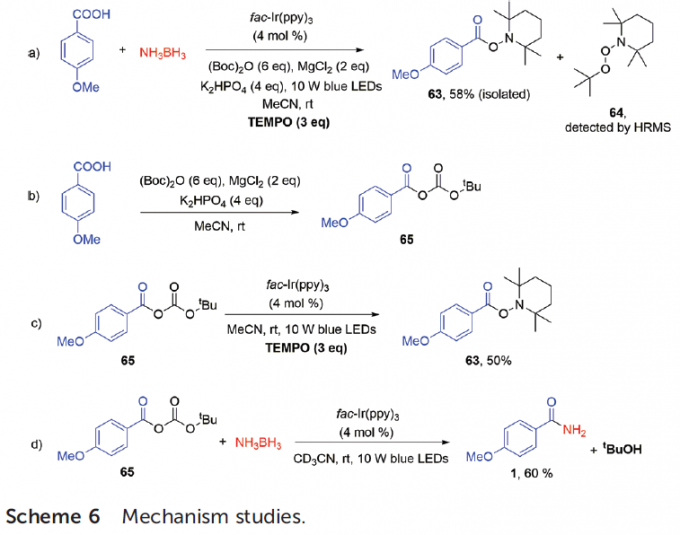
为了进一步阐明相关的反应的机理,作者进行一系列相关的控制实验研究 (Scheme 6)。首先,作者发现,在标准反应条件下,加入自由基捕获剂TEMPO,能够使预期的酰胺化反应受到完全抑制,同时,分离出58%收率的酰基自由基捕获产物 (acyl radical-trapping product)63以及叔丁基自由基捕获产物64,进而表明反应机理步骤中涉及酰基自由基与叔丁基自由基的形成 (Scheme 6a)。接下来,作者发现,室温条件下,4-甲氧基苯甲酸与Boc2O、MgCl2以及K2HPO4在乙腈溶剂中的反应,能够获得酸酐产物65 (Scheme 6b)。较为有趣的是,在乙腈溶剂与蓝光 LED照射的条件下,将TEMPO加入至酸酐65与光催化剂的混合物中,最终能够获得50%收率的自由基捕获产物63 (Scheme 6c)。这一结果表明,光催化剂参与酰胺化过程的循环。同时,作者假设,叔丁氧基负离子在反应过程中起重要作用。此外,该小组进一步观察到,酸酐65与NH3BH3在上述的最佳条件下进行反应时,能够获得60%收率的酰胺产物1,并通过NMR与GC-MS检测出叔丁醇副产物 (Scheme 6d)。
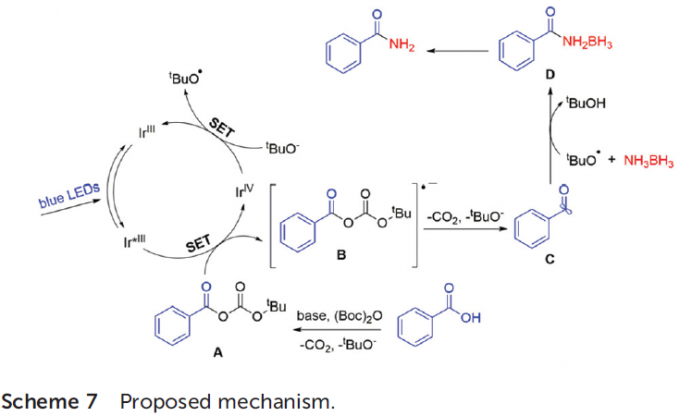
根据上述实验结果以及前期的文献报道[15]-[16],作者提出一种合理的反应机理 (Scheme 7)。首先,在碱K2HPO4存在下,羧酸与(Boc)2O以及MgCl2原位反应,形成酸酐A。在可见光照射下,光催化剂fac-Ir(ppy)3形成长寿命的激发态Ir*III配合物。接下来,酸酐A与具有较强还原性的Ir*III配合物经历SET过程,形成自由基前体B与IrIV配合物。通过自由基前体B的碎片化过程,产生酰基自由基C与叔丁氧基负离子以及CO2。之后,叔丁氧基负离子与IrIV配合物经历SET过程,形成叔丁氧基自由基与基态的IrIII配合物,进而完成相应的催化循环。最后,酰基自由基C与NH3BH3以及叔丁氧基自由基进一步反应,生成酰胺-硼烷配合物D,并通过进一步转化,产生相应的酰胺产物。
总结
河南师范大学陈学年与马艳娜课题组合作报道首例反应条件温和、高效并通用的采用可见光媒介促进的光氧化还原去氧酰胺化反应方法学。该方法学能够通过羧酸与胺-硼烷配合物直接构建一系列酰胺分子。同时,该方法学具有原料易得、底物适用范围广泛以及优良的官能团兼容性高等优势。此外,通过对部分药物分子的后期官能团化与克级规模实验的研究,进一步阐明这一方法学的合成应用价值。
























No comments yet.