本文作者:杉杉
导读
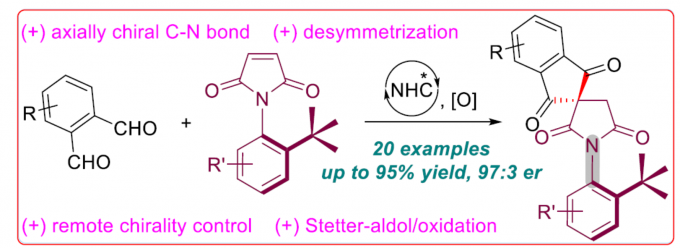
虽然利用轴手性C-C键的构建来进行阻转选择性的合成一些双芳基化合物的方法已经很成熟了,但对于轴手性C-N键化合物的合成却相对较少。本文将介绍一种通过N-杂环卡宾催化阻转选择性合成具有轴手性C-N键的N-芳基琥珀酰亚胺(succinimides)化合物的反应,包含了N-芳基马来酰亚胺(maleimides)的去对称化过程。此外,该反应涉及二醛与前手性N-芳基马来酰亚胺的分子间Stetter-Aldol串联反应,并通过氧化得到N-芳基琥珀酰亚胺,具有良好的收率和ee 值。印度科学研究所的Garima Jindal、Subrata Mukherjee和A. T. Biju为共同通讯作者。
NHC-Catalyzed Desymmetrization of N-Aryl Maleimides Leading to the Atroposelective Synthesis of N-Aryl Succinimides
Soumen Barik, Sayan Shee, Soumik Das, Rajesh G Gonnade, Garima Jindal, Subrata Mukherjee, and A. T. Biju
Angew. Chem. Int. Ed. ASAP DOI: 10.1002/anie.202016938
正文
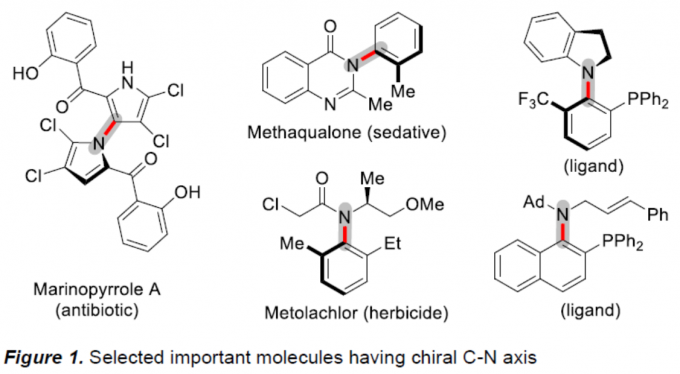
具有轴手性C-N键的化合物,广泛存在于天然产物、药物、农用化学品等中。如Marinopyrrole A可用作抗生素、甲喹酮(Methaqualone)作为安眠和镇静药、异丙甲草胺(Metolachlor)作为除草剂等(Figure 1)。同时,此类化合物也作为不对称催化反应中的有效配体。
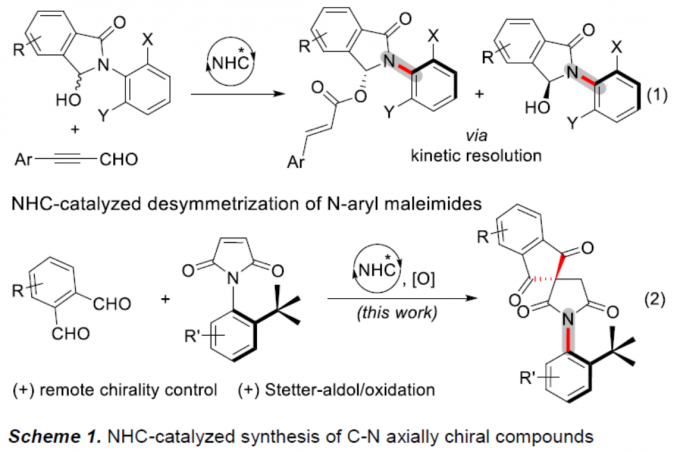
自Curran等[1]首次通过马来酰亚胺和N-烷基苯甲酰胺来构建具有C-N轴手性的化合物以来,催化阻转选择性合成C-N轴手性分子受到大量关注。近年来,已报道了多种过渡金属催化或有机催化的策略用于合成具有C-N轴的手性分子。另一方面,虽然已实现N-杂环卡宾(NHC)催化阻转选择性合成C-C轴向手性化合物[2],但对于NHC催化合成具有C-N轴手性化合物却很少被研究。2018年,Wang等报道了NHC催化从而合成具有C-N轴手性化合物[3],涉及苯甲酸酯动力学拆分过程(Scheme 1, eq 1)。鉴于动力学拆分策略的局限性,作者设想可通过NHC催化N-芳基马来酰亚胺的去对称化反应,从而合成具有轴手性C-N键的N-芳基琥珀酰亚胺(具有原子经济和阻转选择性)(eq 2)。值得注意的是,近期Chi等[4]报道了NHC催化环状1,3-二酮的去对称化反应合成螺环化合物。
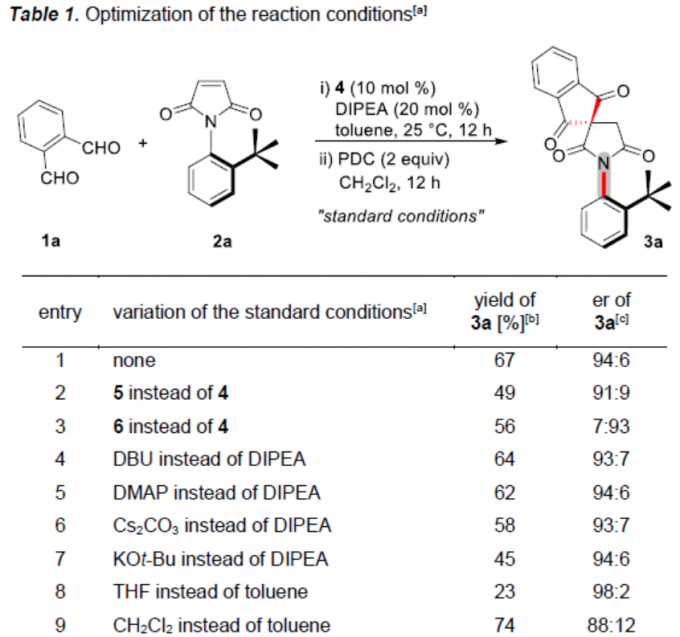
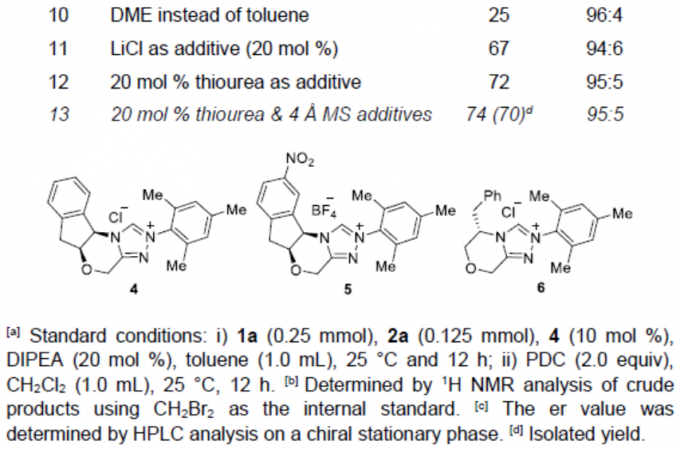
首先,作者以二醛1a和N-芳基马来酰亚胺2a作为模型底物,进行了相关反应条件的筛选(Table 1)。反应的最佳条件为:以10 mol%手性三唑盐卡宾4为催化剂,同时加入20 mol%的 DIPEA和硫脲,先于甲苯溶剂中反应,随后使用PDC氧化,从而获得70%收率和95:5 er的目标产物3a。
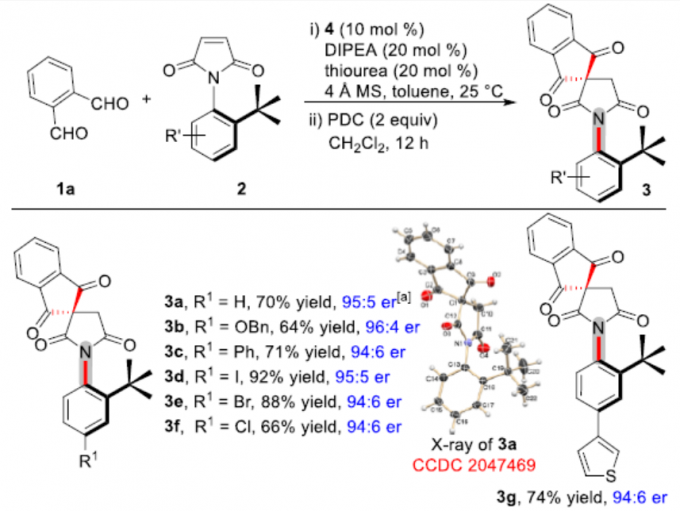
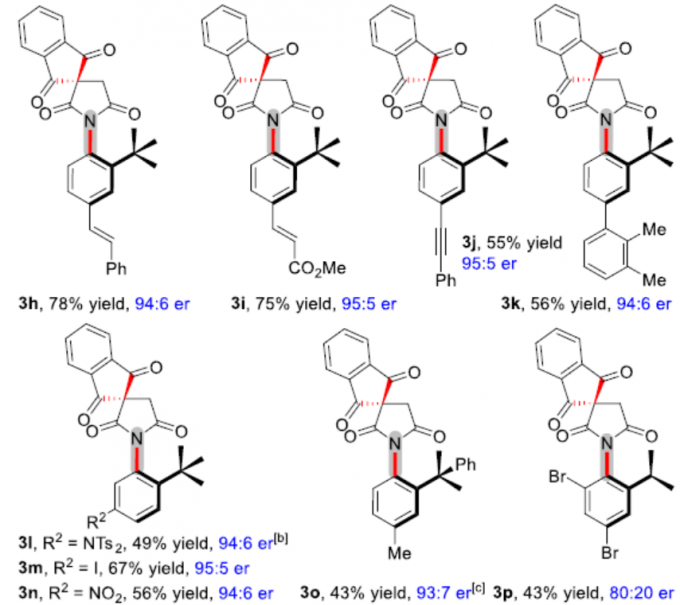
在获得上述最佳反应条件后,作者开始对马来酰亚胺底物进行了扩展(Scheme 2)。当芳基的R1取代基为各种给电子、卤素、杂芳基、烯基、炔基时,均可获得相应的N-芳基琥珀酰亚胺3a–3j,收率为55-92%,er为94:6-96:4。同时,芳基上具有2,3-二取代的芳基底物,也可获得产物3k。然而,对于有吸电子基团的底物,反应未能正常进行。芳基的邻位具有较大空间位阻的底物(叔丁基和异丙基),也可顺利反应,获得产物3l–3p。然而,使用邻位具有异丙基的底物时,产物3p的选择性有所降低。
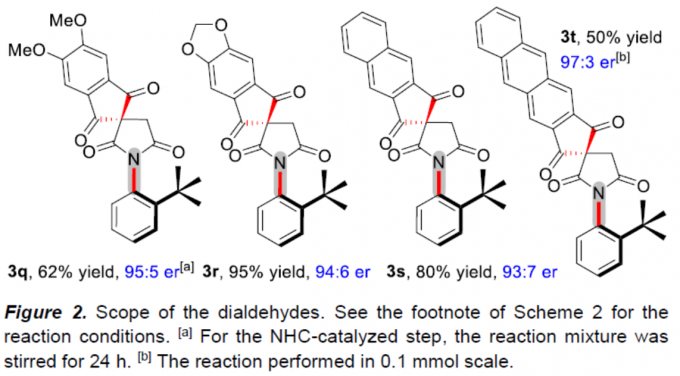
随后,作者对二醛的底物范围进行了扩展(Figure 2)。结果表明,对各种对称的1,2-二醛底物,反应均具有良好的耐受性,以中等至良好的收率和高选择性形成了所需的N-芳基琥珀酰亚胺3q–3t。
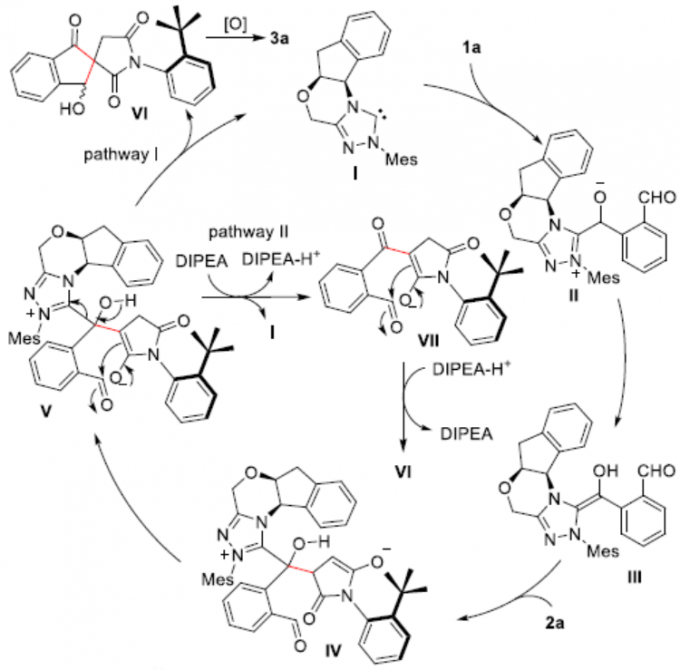
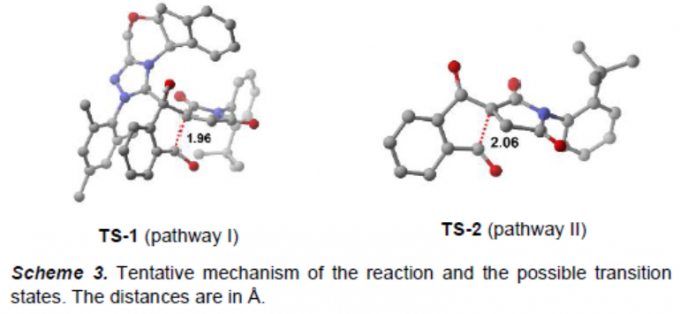
在这里,作者提出了一种可能的反应机理(Scheme 3)。首先,卡宾I与二醛1a经加成形成中间体II,再经质子转移,形成Breslow中间体III。其次,2a与III进行亲核加成形成中间体IV,再经质子转移形成中间体V。紧接着,中间体V可通过两种途径转化为醇中间体VI。在pathway I中,中间体V经分子内醛醇缩合反应(通过过渡态TS-1),形成醇中间体VI。在pathway II中,通过在碱基和NHC离解的过程中进行抽取质子后获得中间体VII,再经过渡态TS-2和质子转移以进行分子内羟醛反应,得到醇中间体VI。同时,通过TS-2和TS-1过渡态的能量对比表明,在没有NHC时,醛醇缩合反应很可能发生。最后,醇中间体VI可被PDC氧化,形成所需的产物3a。
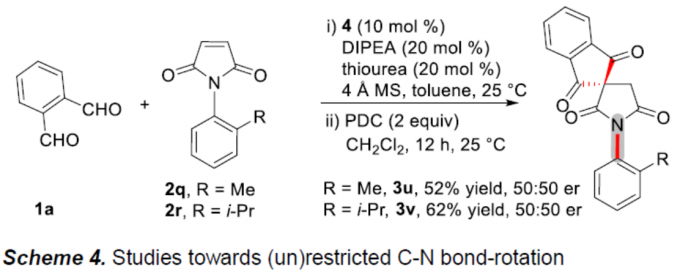
此外,作者也对C-N轴手性的起源进行了研究(Scheme 4)。当使用甲基取代叔丁基时,获得52%收率的外消旋产物3u,从而表明甲基很有可能允许C-N键不受限制地旋转。同样,使用带有异丙基的马来酰亚胺底物2r,结果相似。
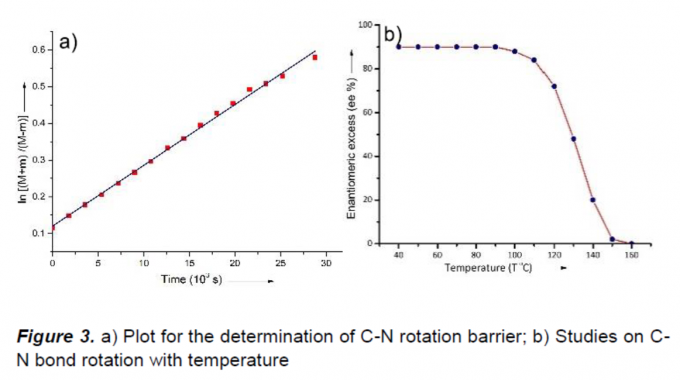
同时,作者还对影响C-N轴旋转的因素进行了研究(Figure 3)。当将产物3a置于甲苯反应2小时,在小于90 ℃时,ee值保持90%,但超过90 ℃时,ee大幅下降,从而表明在高温下C-N键的旋转不受限制。
总结
本文主要报道了N-芳基马来酰亚胺的去对称化反应,可合成具有轴手性C-N键的N-芳基琥珀酰亚胺化合物。同时,该反应具有反应条件温和、底物范围广泛、高收率和选择性等特点。此外,该反应涉及分子间的Stetter反应、分子内的醛醇缩合反应、串联氧化反应等。




















No comments yet.