作者:杉杉
导读:
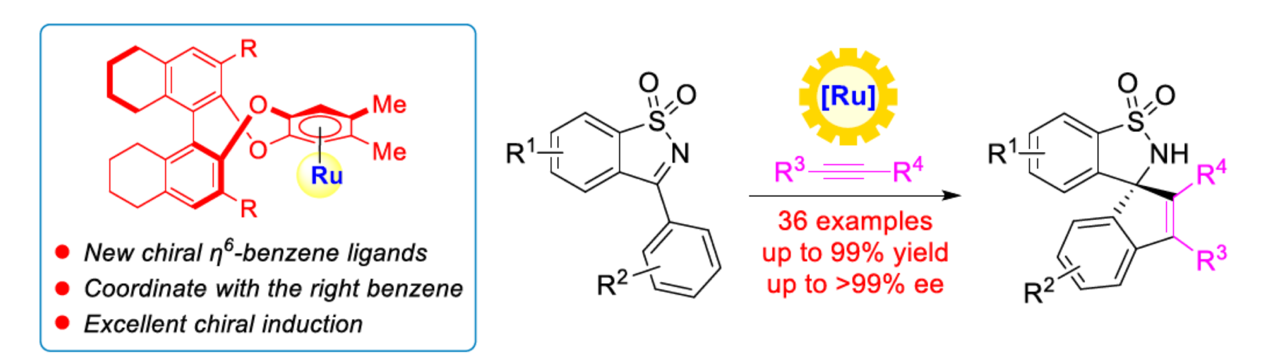
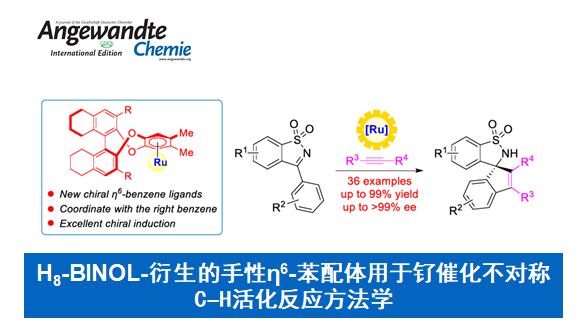
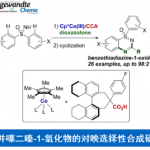
近日,中山大学的汪君课题组在Angew. Chem. Int. Ed.中发表论文,开发一种全新的轴手性Ben(η6-benzene)配体,其衍生自易得的(S)-H8-BINOL((S)-5,5′,6,6′,7,7′,8,8′-octahydro-1,1′-bi-2-naphthol)。同时,相关的手性BenRuII催化剂可有效地催化N-磺酰基亚胺与炔烃的不对称C−H活化反应方法学,进而成功完成一系列手性螺环磺内酰胺 (spirocyclic sultams)分子的构建。
H8-BINOL-Derived Chiral η6-Benzene Ligands: New Opportunities for the Ruthenium-Catalyzed Asymmetric C−H Activation
J. Li, G. Wang, W. Guo, J. Jiang, J. Wang, Angew. Chem. Int. Ed. 2024, ASAP. doi: 10.1002/anie.202405782.
正文:
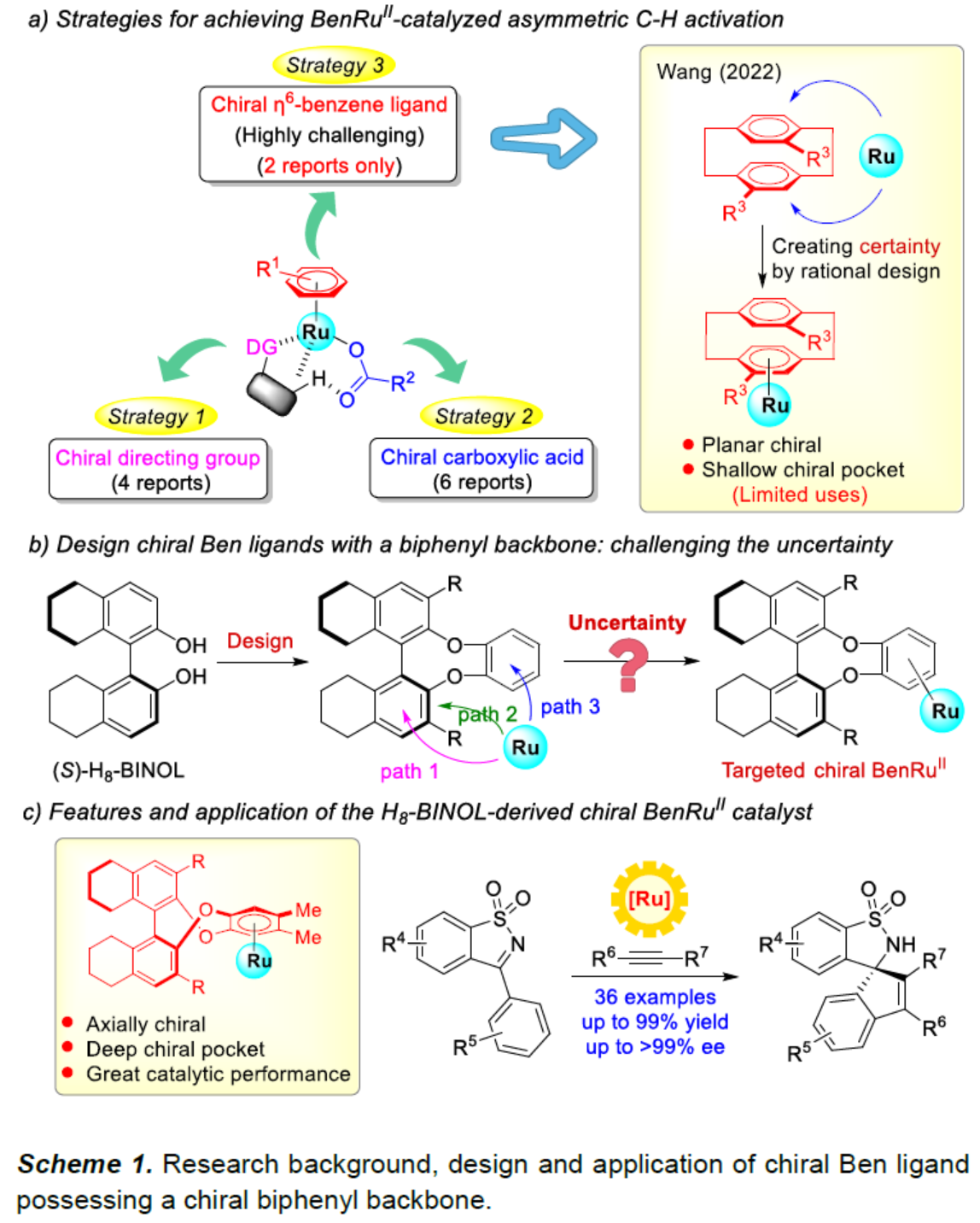
钯、铑与钌是催化C−H活化最常用的三种过渡金属。然而,与钯[1]或铑[2]催化体系相比,钌[3]催化不对称C−H活化反应方法学却较少有相关的研究报道。目前,对于BenRuII催化不对称C−H活化主要涉及三种策略 (Scheme 1a),即使用手性导向基团[4]、使用手性羧酸[5]以及利用手性Ben配体[6]。其中,对于利用手性Ben配体的反应方法学,却较少有相关的研究报道。同时,此类反应存在三种可能的金属配位途径,从而极具挑战。这里,中山大学的汪君课题组设计了一种由(S)-H8-BINOL衍生的新型轴手性Ben配体 (Scheme 1b)。同时,相关的手性BenRuII催化剂成功应用于N-磺酰基亚胺与炔烃的不对称C−H活化反应方法学,进而成功完成一系列手性螺环磺内酰胺分子的构建 (Scheme 1c)。
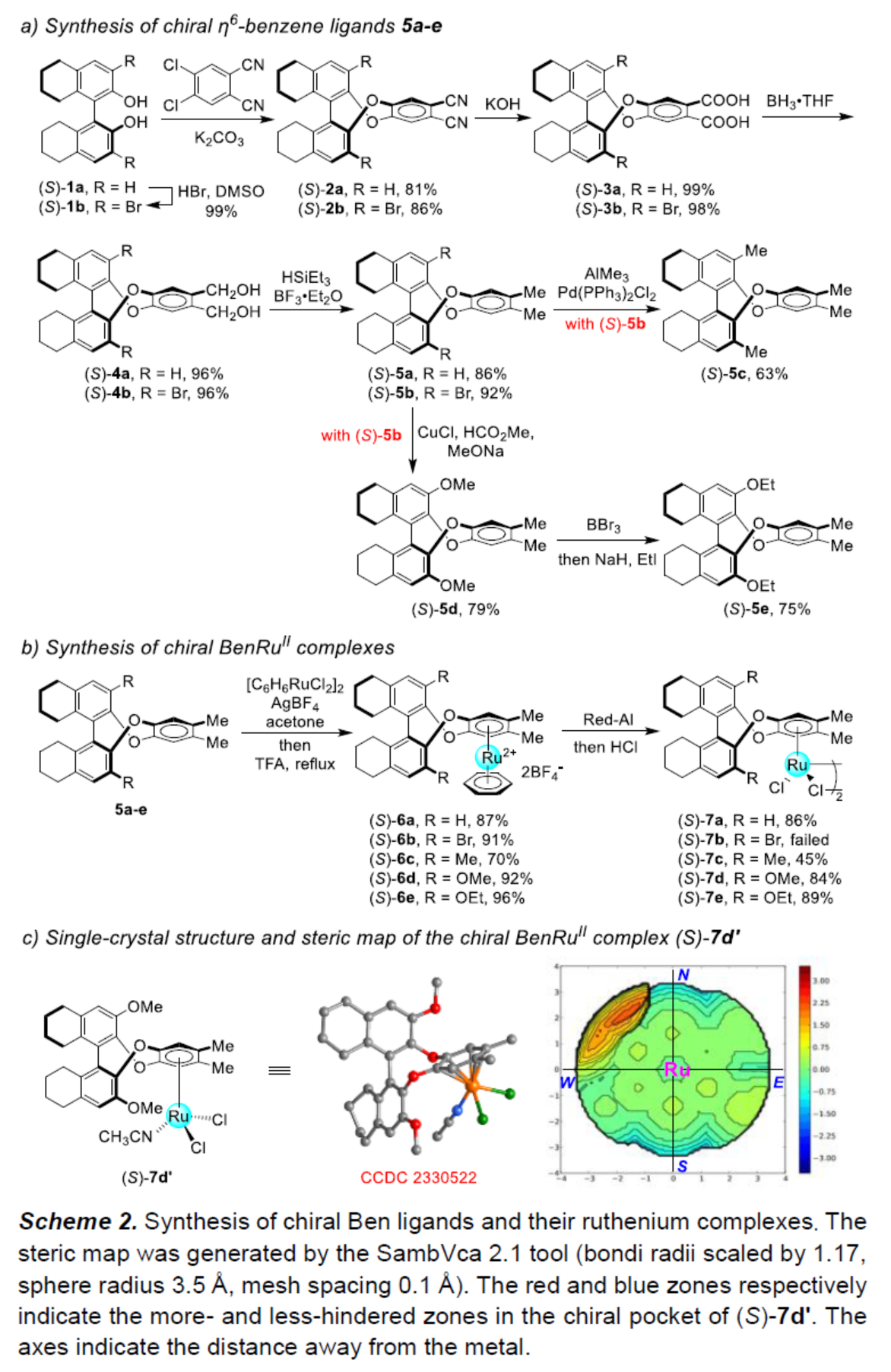
首先,作者合成了手性η6-benzene配体5a–5e (Scheme 2a)。同时,通过进一步的衍生化,作者制备了几种手性BenRuII配合物7a 与7c–7e (Scheme 2b)。并且,通过(S)-7d’的单晶结构表明,配位的位点选择性由空间位阻决定,并且在西北象限 (northwest quadrant)具有显著的空间位阻 (Scheme 2c)。
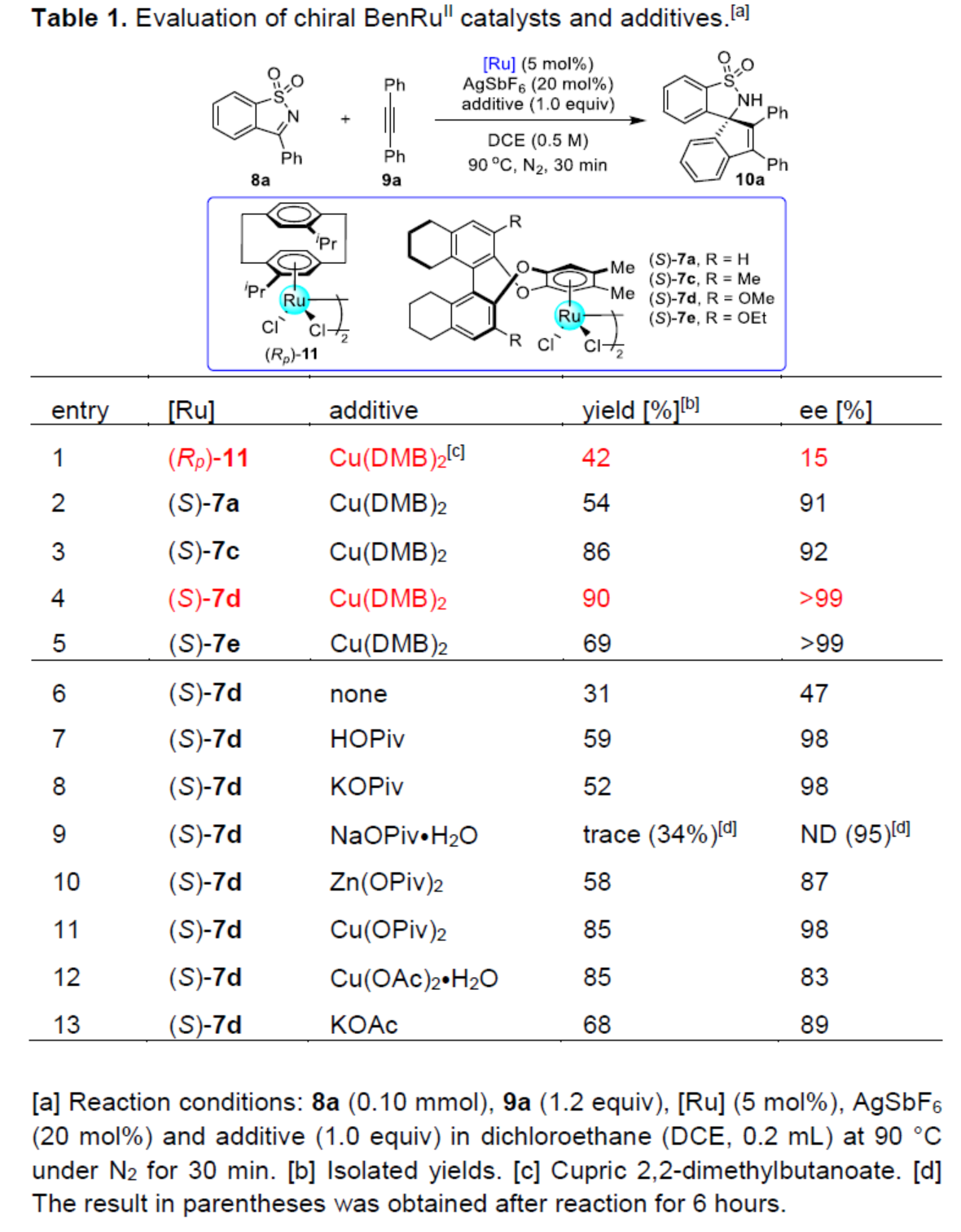
其次,作者采用N-磺酰基亚胺衍生物8a与二苯基乙炔(9a)作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用(S)-7d作为催化剂,AgSbF6作为氧化剂,Cu(DMB)2作为添加剂,在DCE反应溶剂中,反应温度为90 oC,最终获得90%收率的产物10a (>99% ee)。
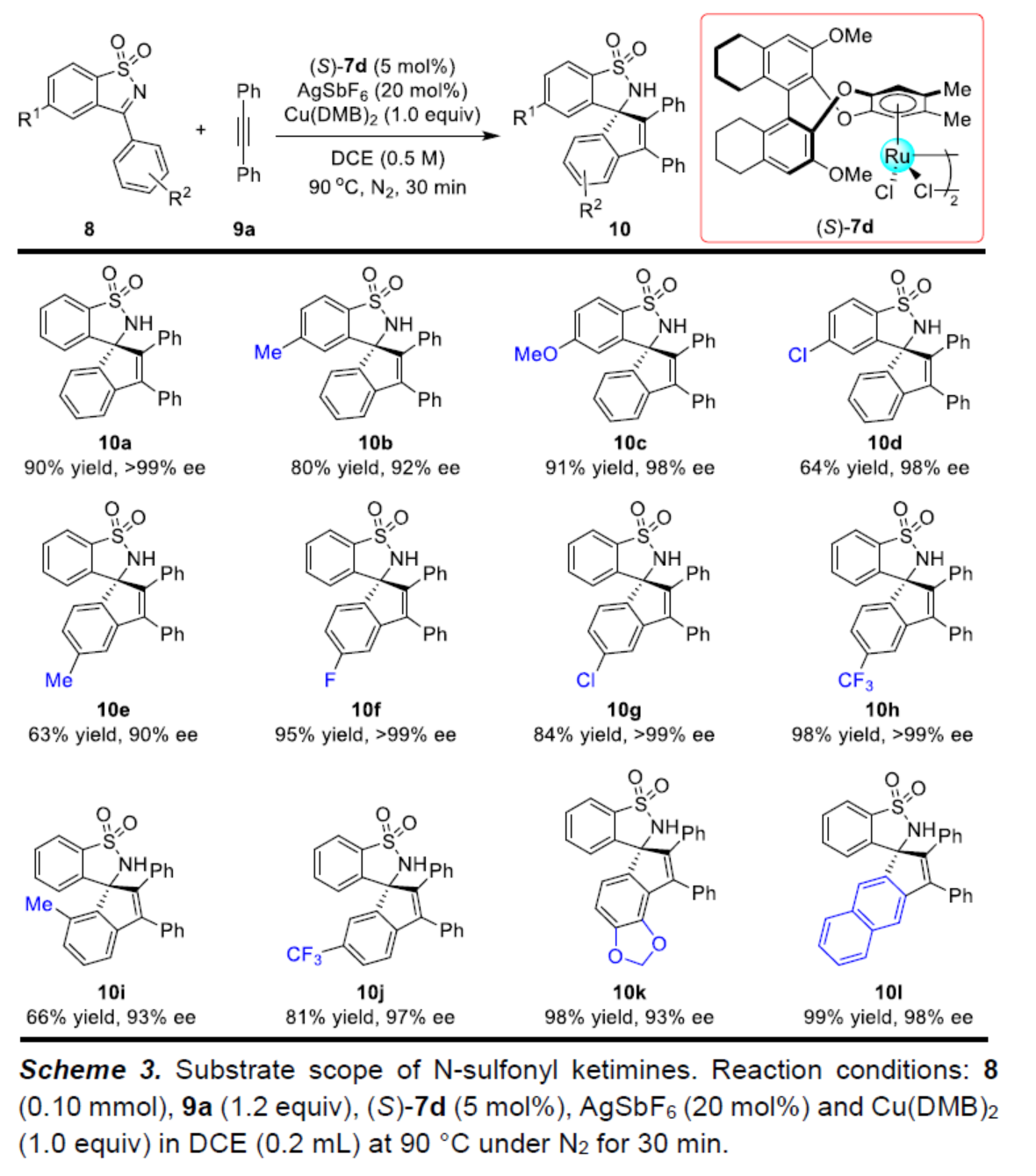
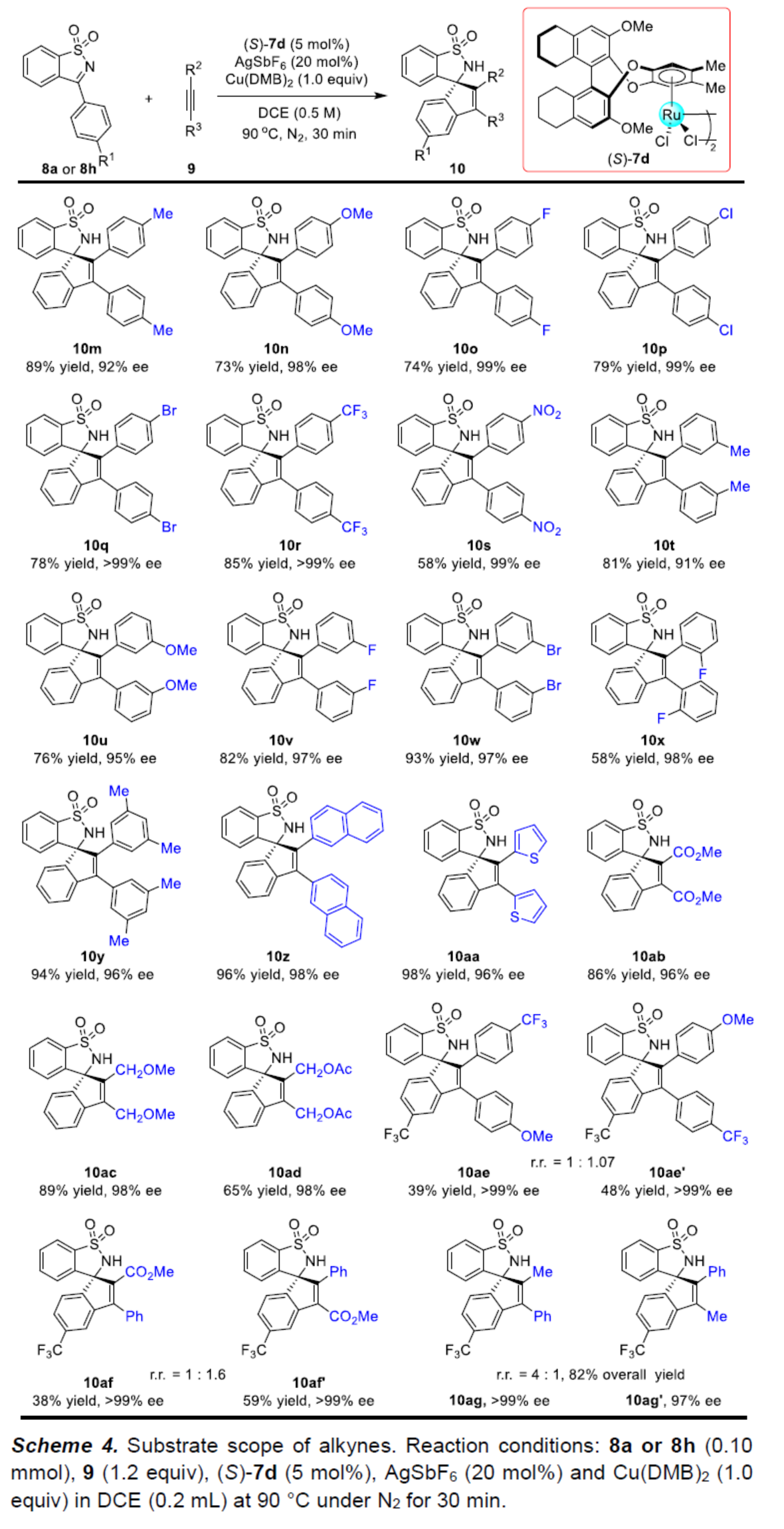
在上述的最佳反应条件下,作者分别对一系列N-磺酰基亚胺衍生物底物 (Scheme 3)以及炔烃底物 (Scheme 4)的应用范围进行深入研究。


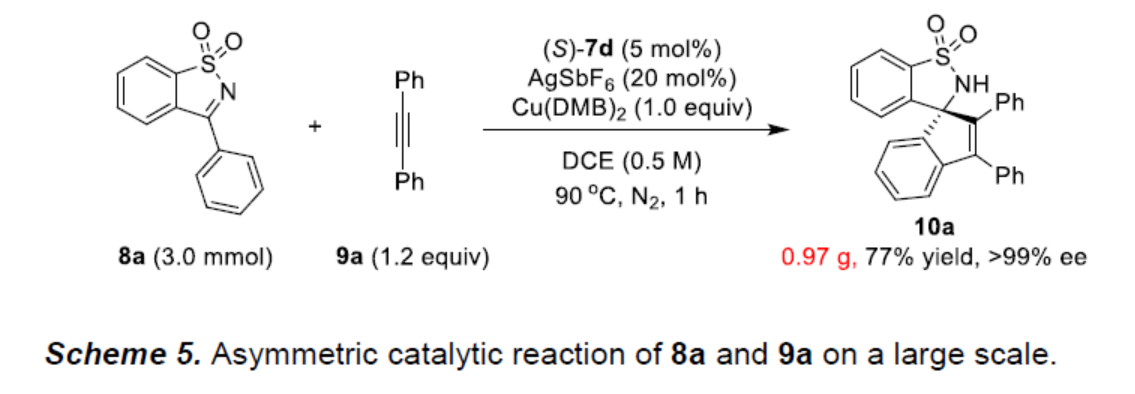
之后,该小组通过如下的克级规模实验研究进一步表明,这一全新的不对称C−H活化策略具有潜在的合成应用价值 (Scheme 5)。
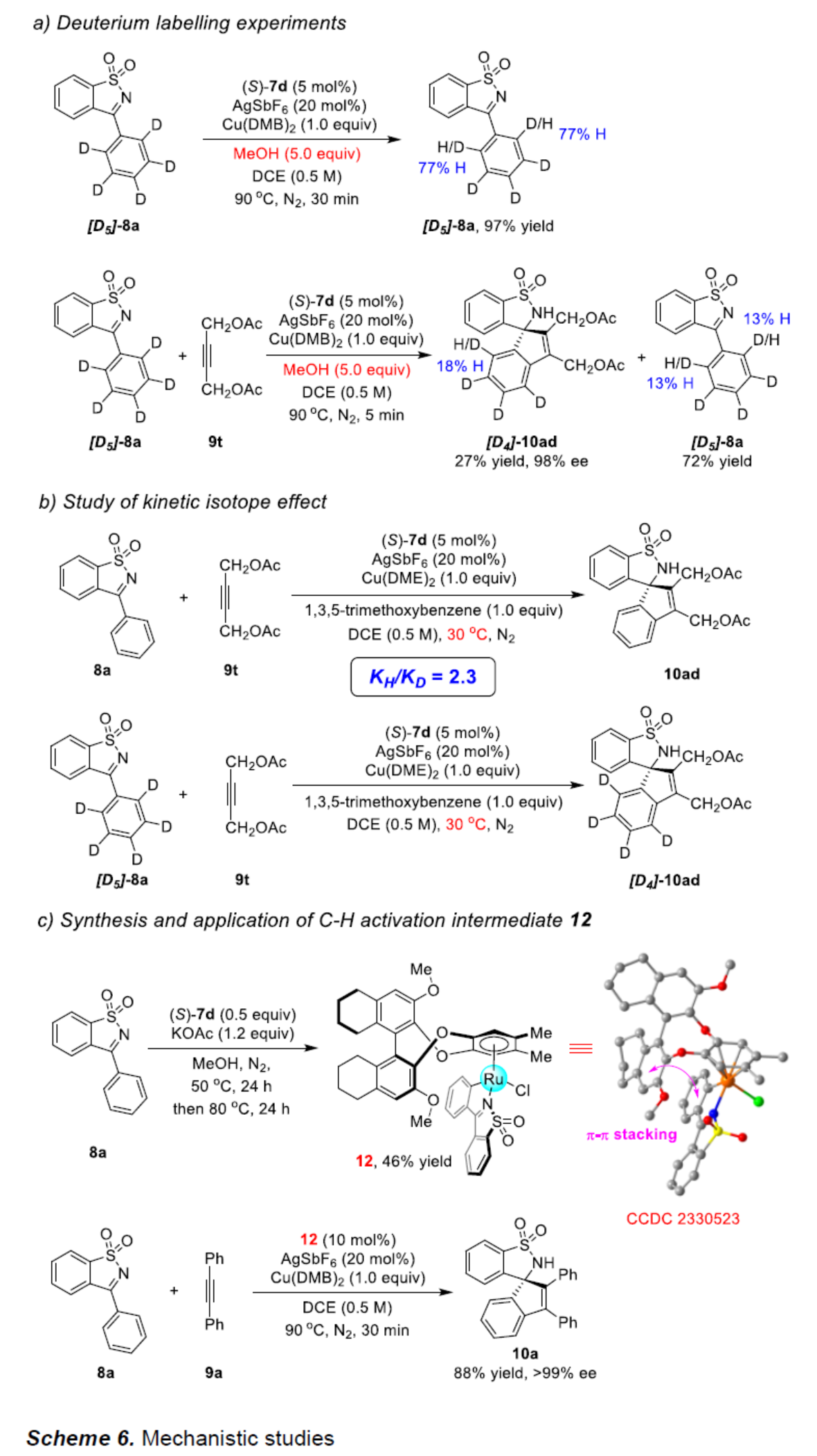
接下来,作者对上述不对称C−H活化过程的反应机理进行进一步研究 (Scheme 6)。

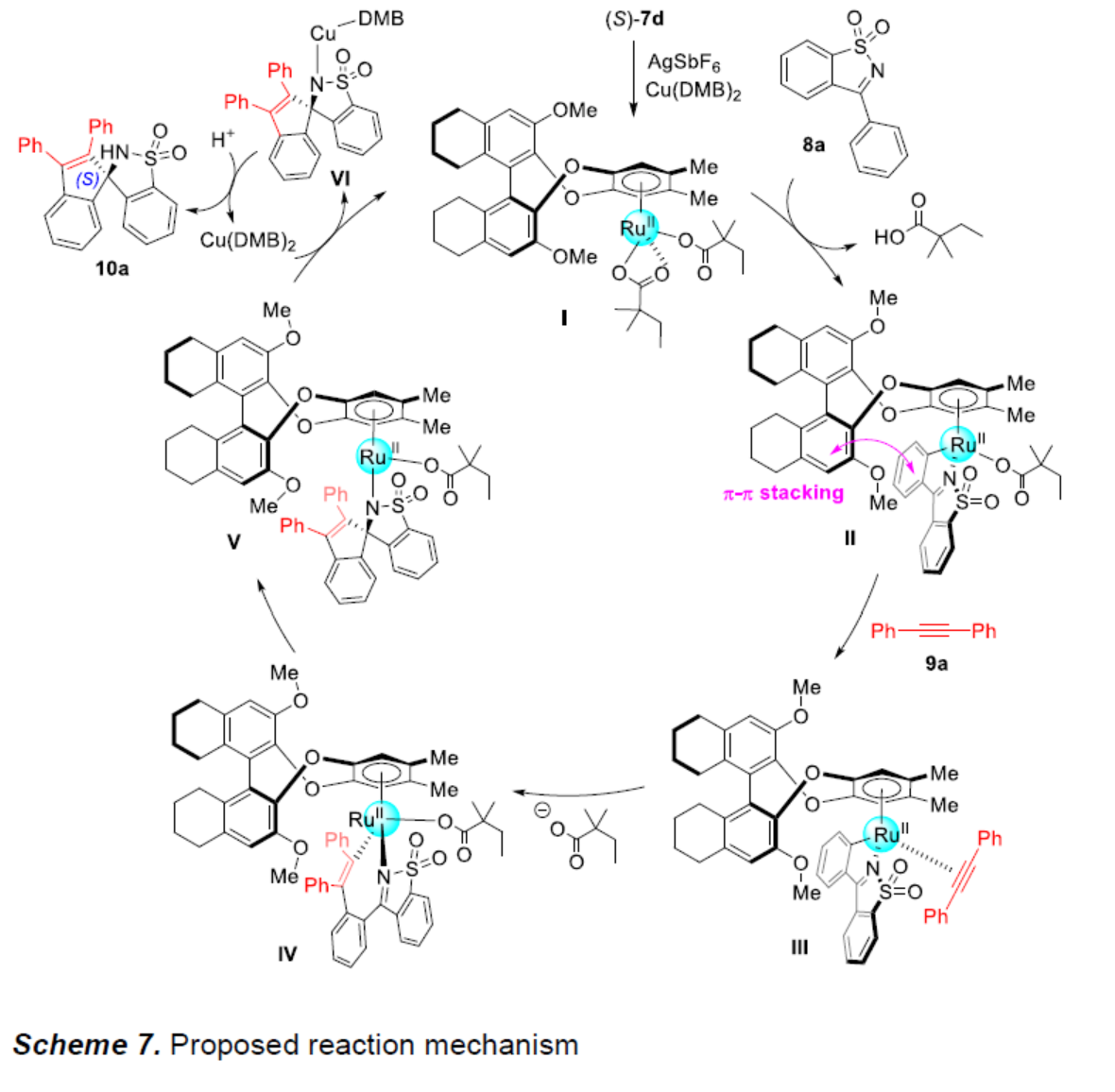
基于上述的实验研究以及前期相关的文献报道[7],作者提出如下合理的反应机理 (Scheme 7)。
总结:中山大学的汪君课题组设计了一种由(S)-H8-BINOL衍生的新型的轴手性Ben配体。同时,相关的手性BenRuII催化剂成功应用于N-磺酰基亚胺与炔烃的不对称C−H活化反应方法学,进而成功完成一系列手性螺环磺内酰胺分子的构建。这一全新的对映选择性合成转化策略具有底物范围广泛、优良的官能团兼容性以及优良的对映选择性等优势。
参考文献:
- [1] K. Yang, M. Song, H. Liu, H. Ge, Chem. Sci. 2020, 11, 12616. doi: 10.1039/D0SC03052J.
- [2] C. Liu, S. Y. Yin, F. Zhao, H. Yang, Z. Feng, Q. Gu, S. You, Chem. Rev. 2023, 123, 10079. doi: 10.1021/acs.chemrev.3c00149.
- [3] H. Liang, J. Wang, Chem. Eur. J. 2023, 29, e202202461. doi: 10.1002/chem.202202461.
- [4] G. Li, Q. Liu, L. Vasamsetty, W. Guo, J. Wang, Angew. Chem. Int. Ed. 2020, 59, 3475. doi: 10.1002/anie.201913733.
- [5] T. Zhou, P. Qian, J. Li, Y. Zhou, H. Li, H. Chen, B. Shi, J. Am. Chem. Soc. 2021, 143, 6810. doi: 10.1021/jacs.1c03111.
- [6] H. Liang, W. Guo, J. Li, J. Jiang, J. Wang, Angew. Chem. Int. Ed. 2022, 61, e202204926. doi: 10.1002/anie.202204926.
- [7] M. Nagamoto, T. Nishimura, Chem. Commun. 2014, 50, 6274. doi: 10.1039/C4CC01874E.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.














No comments yet.