本文作者:芃洋雪
导读
非共轭脂肪族烯烃进行光环化反应仅有铜催化的Salomon–Kochi反应,但标准的[Cu(OTf)]2•苯催化剂对空气敏感,易于光降解,并且在大位阻的烯烃底物活性较低。最近,威斯康星大学麦迪逊分校Tehshik P. Yoon课题组开发了新的铜催化剂体系,反应活性和光稳定性都增强,用于合成复杂的环丁烷结构以及天然产物,论文发表在Angew. Chem. Int. Ed.上。
Olefin-Supported Cationic Copper Catalysts for Photochemical Synthesis of Structurally Complex Cyclobutanes
Christopher Gravatt, Luis Melecio-Zambrano, Tehshik Peter Yoon*
Angew. Chem. Int. Ed. 2020, DOI:10.1002/anie.202013067
正文
环丁烷结构广泛存在于天然产物中,目前已知有2600多种天然产物含有环丁烷结构,这也促进了这类化合物的合成研究。其中光化学[2+2]环化反应是重要的方法,包括以下活化方式:
(1)在可见光或近紫外光下直接光活化烯烃化合物;
(2)三线态光敏化 具有三线态能量足够低的底物三线态敏化进行Dexter能量转移;
(3)光引起的电子转移生成烯烃自由基离子的光氧化还原反应。
然而所有这些活化模式需要π共轭烯烃底物,非共轭的脂肪族烯烃通常需要短波长(<200 nm)激发进行比光学跃迁,而商业化UV光反应器通常不适用,与此同时,通常需要高能量的三线态激发态(76–84 kcal/mol)和电化学电势,常规光氧化还原催化剂也难以实现。
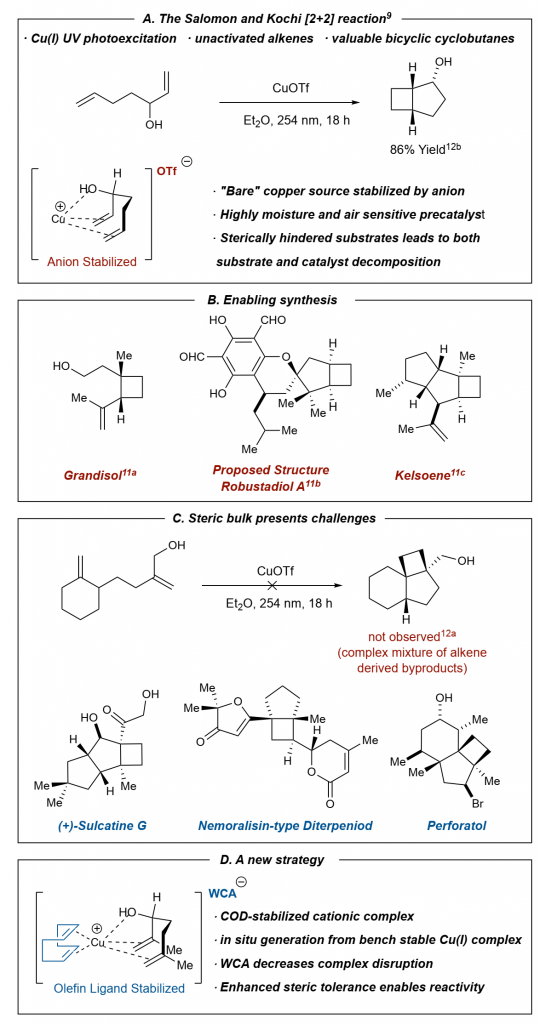
目前,仅有的一个脂肪族烯烃的[2+2]光环加成反应为Salomon–Kochi反应,使用Cu(OTf)催化剂,关键中间体为2:1的烯烃-铜络合物,可以吸收270 nm的紫外波长。尽管,Salomon–Kochi光环化反应应用在一些全合成中,但反应条件并未研究彻底,窄的底物范围也限制了它的应用。成功的环加成需要形成不稳定的铜双烯烃络合物,而且大部分底物结构会使络合物失稳,从而阻碍了反应进行。大体积的烯烃结合到铜上的效率较差,底物范围窄,需要化学家的努力克服这个障碍,拓展应用范围。
图1. Salomon–Kochi反应和催化剂. 图片来源:Angew. Chem. Int. Ed.
光环化反应的关键是催化剂,对这类催化剂,铜(Ⅰ)阳离子和双(烯烃)络合物中间体需要抗衡离子的协调能力。因此,作者推测比三氟乙酸基络合能力弱的配体,可能使铜(Ⅰ)更亲电,使大体积的烯烃可以反应。
1 催化剂设计和筛选
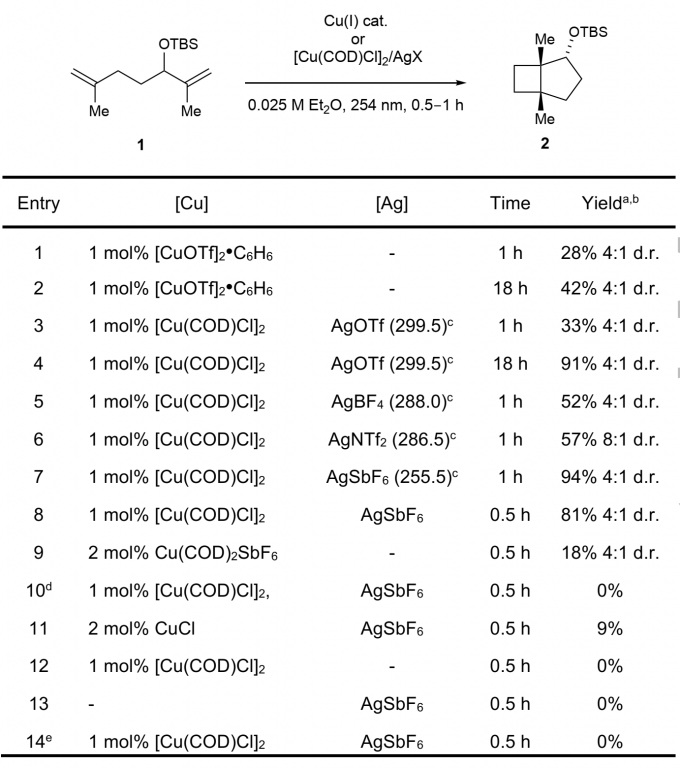
图2. 弱配位银盐原位生成催化剂的优化. 图片来源:Angew. Chem. Int. Ed.
催化剂筛选实验如图2所示,作者首先尝试二烯1这个底物(弱Samlomon底物),Salomon–Kochi反应条件中的1 mol% [Cu(OTf)]2•苯得到28%的环丁烷产物。延长激发时间没有提高收率,但发现了铜催化剂的降解。铜(Ⅰ)络合物弱配体阴离子可能增加反应速率,因此,选择合适的配体,并合成出这类催化剂是关键。二烯配体如环辛二烯COD能够稳定高度缺电子的铜(Ⅰ)中心,而且没有产生竞争性的低能量转移状态。作者又尝试 [Cu(COD)Cl]2与Ag(Ⅰ)盐发生阴离子交换反应,原位生成催化剂,代替对空气和湿气敏感的[Cu(OTf)]2•苯催化剂。[Cu(COD)Cl]2和AgOTf原位生成的催化剂与标准[Cu(OTf)]2•苯催化剂(entry 3)类似,并且延长激发时间并没有发生降解,说明双烯配体确实可以稳定铜(Ⅰ)中心。筛选过弱配位阴离子(WCAs)后发现,与共轭酸的气相酸性相关(entries 5–7),酸性越强,收率越高,最优的AgSbF6,反应时间也可缩短到0.5 h(entry 8)。随后发现,单独制备出Cu(COD)2SbF6作为催化剂的收率大幅下降(entry 9),而且对照发现每个试剂和计量比都有作用(entries 10-14)。
2 底物研究
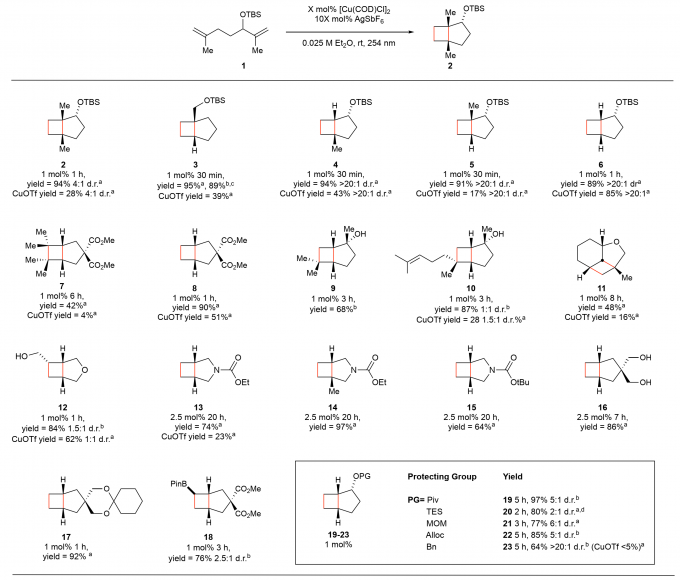
图3. 催化的光环合反应的范围和对比. 图片来源:Angew. Chem. Int. Ed.
新催化剂体系进行光环化反应的底物范围如图3所示。对于1,6-七烷烃结构(2–8),[Cu(COD)Cl]2/AgSbF6体系优于标准的[Cu(OTf)]2•苯催化剂,特别是对于大体积的底物,催化体系可以兼有的官能团有羟基、酰胺、酯、硼酸酯、保护的醇等。
3 立体化学研究
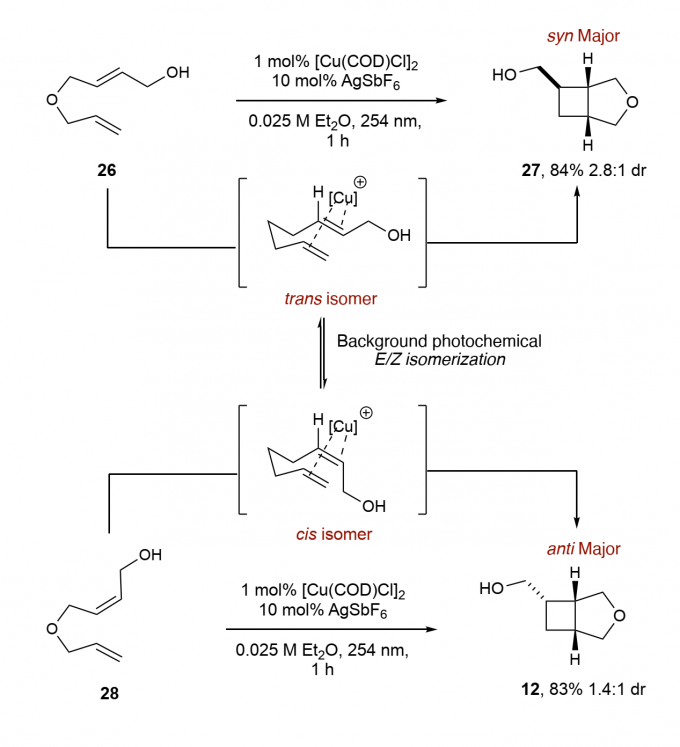
图4. 非对映异构体的起因. 图片来源:Angew. Chem. Int. Ed.
烯烃底物的立体化学在反应后失去,如trans-底物26和cis-底物28,都以较高的收率得到非对映异构体,但主要的异构体还是有差异,经过仔细研究,烯烃的异构化发生在光化学的激发阶段,环加成反应是立体专一性的,如图4所示。
4 反应应用
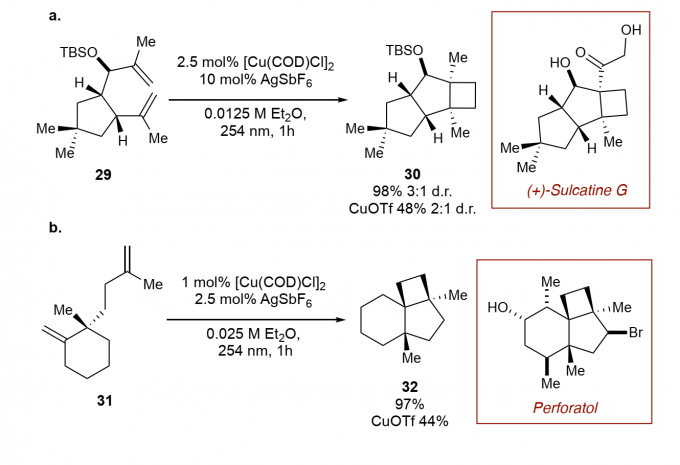
图5. 具有空间位阻的天然产物关键环丁烷3的环合反应.
图片来源:Angew. Chem. Int. Ed.
这个新催化体系,可用于合成复杂的环丁烷天然产物,如图5所示。如合成天然产物sulcatine G 的关键环,收率高达98%,因烯丙基羟基的配位作用,形成高度立体anti构型的桥环结构(30)。也可以高收率得到perforatol的环,而且为单一异构体(32)。
总结
威斯康星大学麦迪逊分校Tehshik P. Yoon课题组设计了新的铜催化剂体系,取代烯烃进行铜催化的Salomon–Kochi光环合反应生成环丁烷结构,弱配位的SbF6–抗衡阴离子提高了反应活性,易于生成铜双烯烃络合物,尽管弱配位的阳离子铜(Ⅰ)盐在反应条件下降解,但COD配体稳定了铜中心,从而不发生竞争性的电子从配体向金属转移的反应。

















No comments yet.