本文作者:杉杉
导读
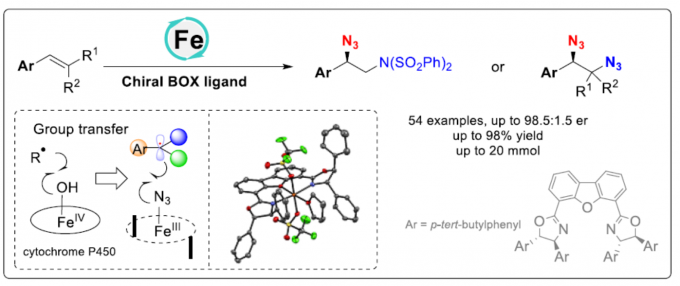
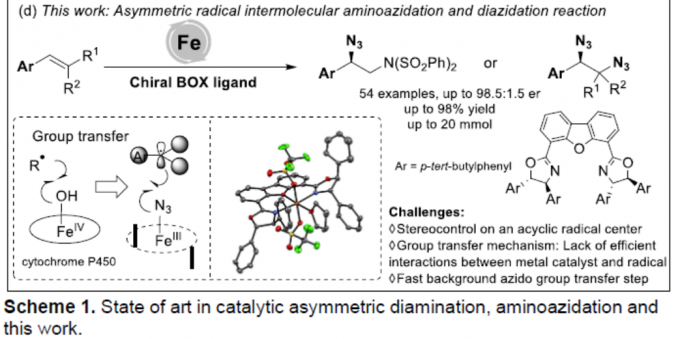
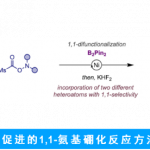
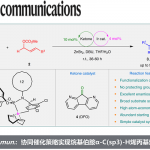
烯烃的不对称氨基叠氮化(aminoazidation)和双叠氮化(diazidation)是一类构建手性含氮化合物的有效策略。近日,中科院福建物构所鲍红丽课题组在Angew. Chem. Int. Ed. 上发表论文,报道了铁催化苯乙烯分子间的不对称氨基叠氮化和双叠化反应,该反应仅使用较低催化量的催化剂和手性配体,通过自由基机理进行,涉及无环自由基的立体控制(可能通过基团转移过程)。
Iron-Catalyzed Radical Asymmetric Aminoazidation and Diazidation of Styrenes
Hongli Bao, Daqi Lv, Qiao Sun, Huan Zhou, Liang Ge, Yanjie Qu, Taian Li, Xiaoxu Ma, and Yajun Li
Angew. Chem. Int. Ed. ASAP DOI: 10.1002/anie.202017175
正文
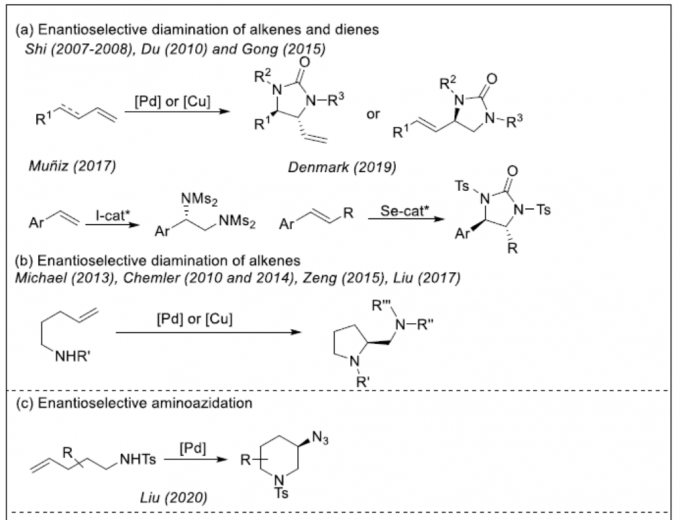
对映体富集的邻二胺化合物广泛的存在于天然产物、药物和生物活性分子中,也可作为手性配体参与不对称催化。虽然可通过醛亚胺[1]和/或亚胺[2]还原偶联合成手性二胺化合物,但烯烃或二烯的催化不对称胺化反应作为最直接且便捷的方法(Scheme 1),更加受到科学家们的关注。如Shi[3]、Du[4]、Gong[5]、Muñiz[6]和Denmark[7]等分别报道了钯、碘、有机硒催化等催化烯烃或二烯的分子间二胺化反应。Michael[8]、Chemler[9]、Zeng[10]和Liu[11] 也报道了通过一种外部胺化试剂和烯烃衍生的底物,经钯或铜催化实现分子间/内的二胺化反应,从而合成手性吲哚和吡咯烷化合物。这其中烯烃的氨基叠氮化和双叠氮化可作为互补的方法来合成邻二胺化合物。此外,有机叠氮化物也作为一种通用反应底物,可进行多种反应,如Curtius重排、Regitz重氮转移、Aza-Wittig反应、Boyer重排等。目前文献中[12]仅有一例关于应用不对称氨基叠氮化反应来合成不同的取代哌啶的实例(Scheme 1c)。对于不对称氨基叠氮化/双叠氮化反应(基于无环体系的分子间反应),仍具有挑战。前期,有文献报道了金属催化自由基叠氮化反应的机理[13],通常涉及分子间基团转移机理。本课题组根据前期对铁催化烯烃的碳叠氮化反应的研究[14],也提出了叠氮基团转移机理。受Ready等报道的对映选择性Kharasch加成反应 [15a]、Zhang等报道的对映选择性分子间自由基C-H胺化反应[15d]以及本课题组[15c]和Liu[15e]报道的苯乙烯和丙烯酰胺的不对称碳叠氮化反应的启发,在此,本课题组将进一步报道一种铁催化苯乙烯的不对称氨基叠氮化和双叠氮化反应。
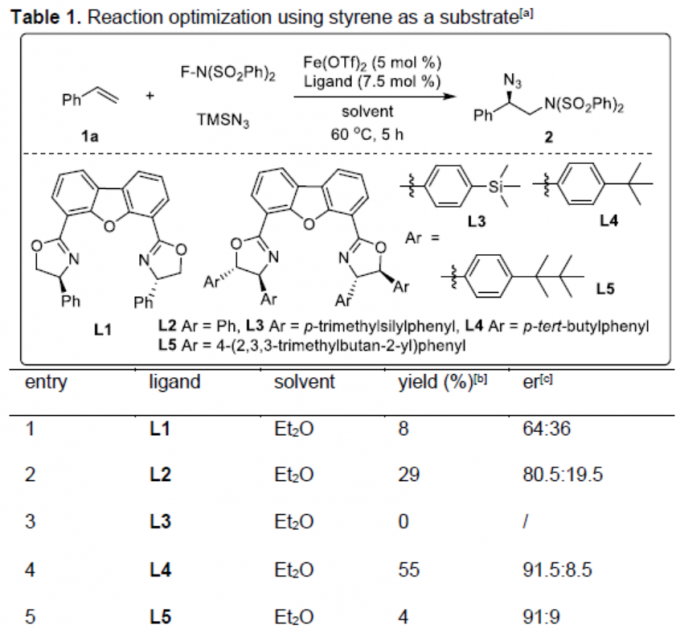
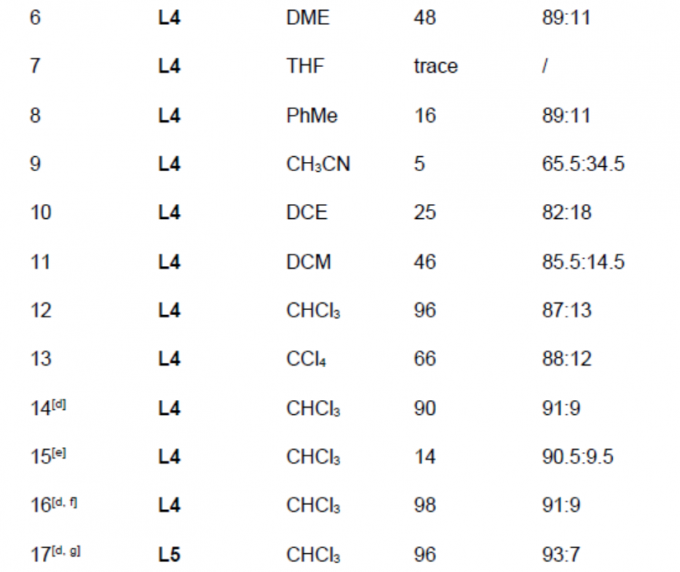
首先,作者以苯乙烯1a、NFSI(氮自由基前体)和TMSN3(叠氮源)为模型底物,进行了相关反应条件的筛选(Table 1)。反应的最佳条件为:以Fe(OTf)2 为催化剂,L5为配体,可在CHCl3溶剂中室温反应,获得96%收率和93:7 er的目标产物2。
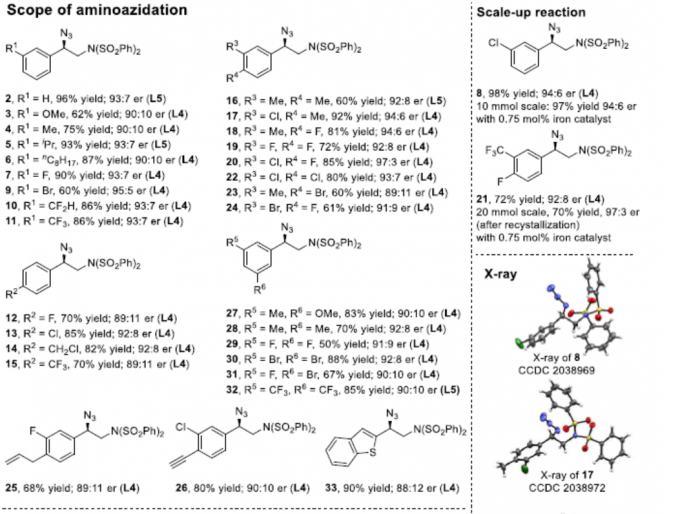
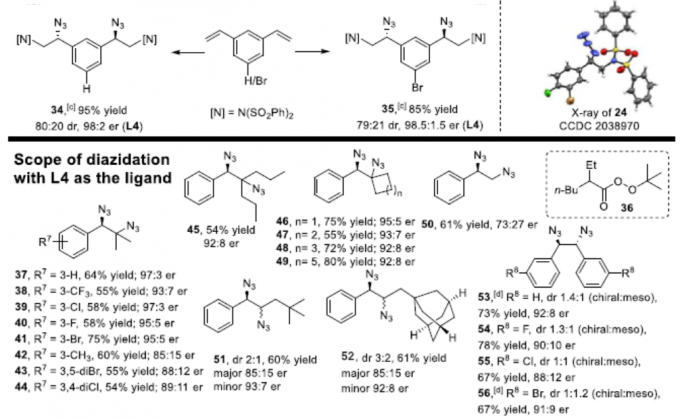
在获得上述最佳反应条件后,作者开始对苯乙烯的底物范围进行了扩展(Scheme 2)。在对氨基叠氮化反应的范围扩展时发现,一系列不同取代的苯乙烯(如各种给电子基或吸电子基)均可顺利反应,并获得良好收率和er的相应产物3–32。同时,除5、16和32外,大多数反应使用L4或L5,L4可获得更好的对映选择性。值得注意的是,若底物中同时含有乙烯基和烯丙基/炔基时,反应优先发生在乙烯基上,从而获得产物25和26。2-乙烯基苯并[b]噻吩也为合适的底物,可获得90%收率和88:12 er的产物33。此外,通过增加叠氮化试剂的量和催化剂的量,可实现1,3-二乙烯基苯和1-溴-3,5-二乙烯基苯的双叠氮化反应,获得中等非对映选择性和较高er的产物34和35。
其次,作者通过再次优化条件后发现,手性铁催化剂适用于二或三取代的苯乙烯底物。对于三取代苯乙烯底物,可获得高达97:3 er的产物37–49。对于苯乙烯底物,可获得中等收率产物50,但er较低。对于不对称苯乙烯底物,可获得含有两个不对称中心的产物51和52,每个异构体的er均为中等水平。对于对称的苯乙烯底物,可获得双叠氮化合物53–56。
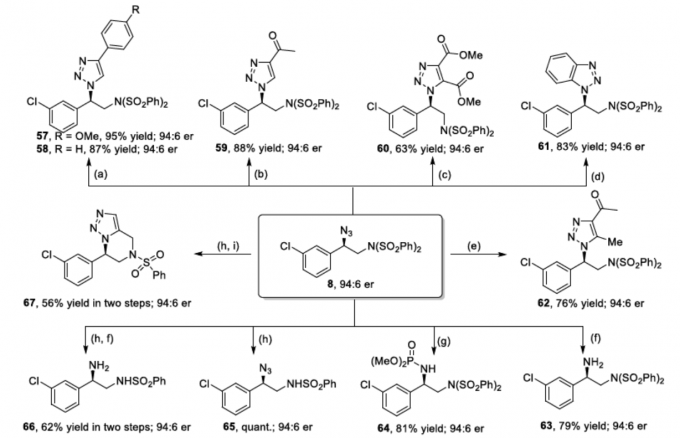
为了进一步证明反应的实用性,作者对产物8进行了后期衍生化(Scheme 3)。首先,8可与末端或内炔烃、苯炔前体或乙酰丙酮进行点击反应(Click reactions),从而获得高收率且对映选择性不损失的三唑产物57–62。其次,8可在铟粉的MeOH中回流,获得79%收率的手性伯胺63。若使用P(OMe)3还原化合物8,可获得81%收率的手性磷酰胺64。除叠氮化物以外,化合物8可经n-Bu4NF进行单脱磺酰化,以定量收率得到产物65,若经进一步还原即可获得单保护的1,2-二胺66,收率为62%。66若经一锅炔丙基化/分子内[3+2]环加成反应,可获得三唑并吡嗪衍生物67。
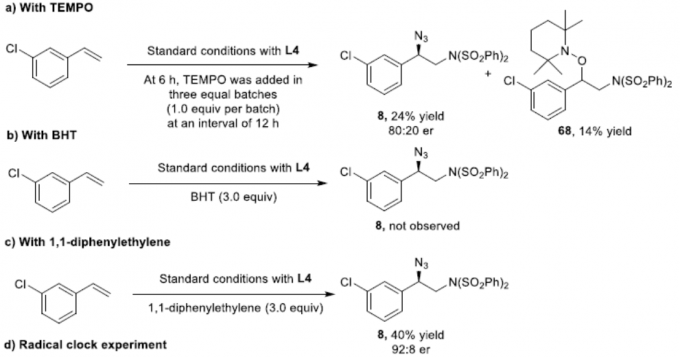
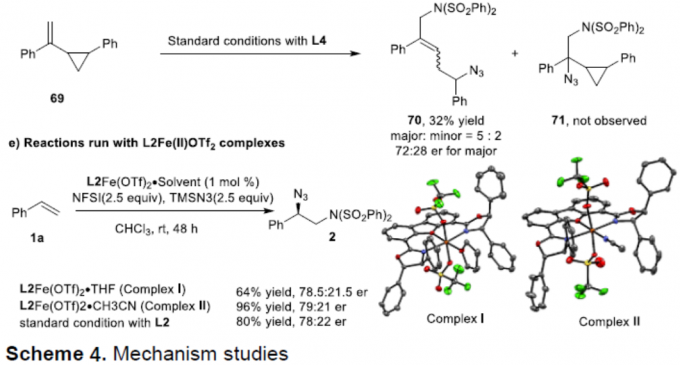
为了进一步了解反应的机理,作者进行了相关的对照实验(Scheme 4)。首先,在标准反应体系中加入TEMPO,仅获得24%收率的产物8,并分离出14%收率的氨基氧化产物68(Scheme 4a)。当加入BHT时,反应完全被抑制(Scheme 4b)。当加入1,1-二苯基乙烯时,反应也被抑制,仅获得40%收率的产物8(Scheme 4c)。在自由基钟实验中,反应以32%的收率形成开环产物70,且未获得氨基叠氮化产物71(Scheme 4d)。这些结果表明,该反应可能涉及苄基自由基的参与。其次,为了确定催化活性物质,作者合成了两种配合物L2-Fe(II)OTf2•THF和L2-Fe(II)OTf2•CH3CN,反应结果表明,L2-Fe(II)OTf2配合物可以用作催化活性物质(Scheme 4e)。
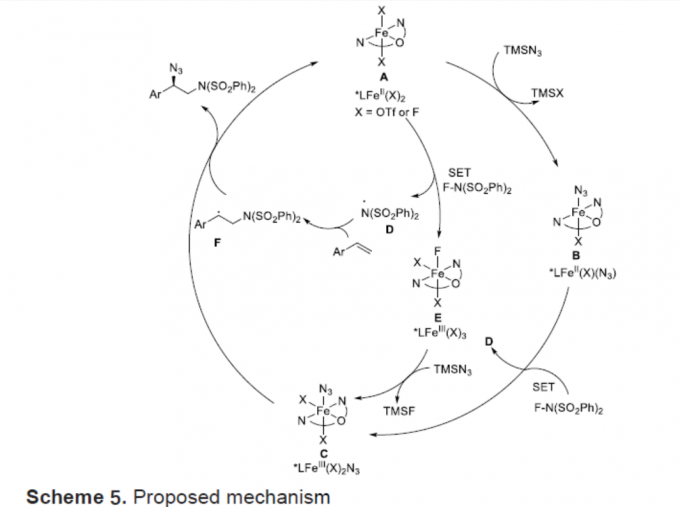
最后,作者提出了一种可能的反应机理(Scheme 5)。首先,铁催化剂与配体的配位形成铁(II)配合物(A),可与TMSN3进行配体交换,得到叠氮化铁(II)配合物(B)。紧接着,NFSI和B经单电子转移形成叠氮化铁(III)配合物(C)和双磺酰胺自由基(D)。同时,配合物A也可与NFSI经单电子转移形成配合物E和自由基(D),E与TMSN3反应生成叠氮化铁(III)配合物(C)。将双磺酰胺自由基基(D)与苯乙烯进行加成形成苄基自由基(F)。最后,苄基自由基可与配合物C经基团转移机理,从而获得目标产物并再生活性催化剂A。
总结
中科院福建物构所鲍红丽课题组报道了第一个铁催化苯乙烯的不对称氨基叠氮化和双叠氮化反应,从而合成了一系列手性胺化有机叠氮化物和二叠氮化物,并可进一步转化为各种具有价值的含氮化合物。同时,该反应具有温和的反应、广泛的底物范围、良好的官能团耐受性等特点。此外,该反应涉及苄基自由基参与。




















No comments yet.