本文作者:杉杉
导读
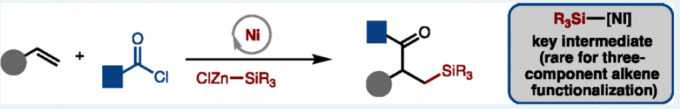
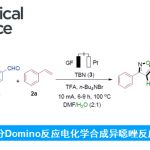
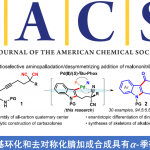
近日,印第安那大学M. Kevin Brown课题组在ACS Catal.上发表论文,报道一种镍催化烯烃的硅酰化反应(silylacylation)。该反应以烯烃、ClZnSiR3和酰氯为底物,成功合成了一系列β-甲硅烷基酮衍生物。值得注意的是,[Ni]-SiR3配合物作为催化中间体,这在以前烯烃的三组分官能化很少被研究。
Three-Component Ni-Catalyzed Silylacylation of Alkenes
Dongshun Ni and M. Kevin Brown*
ACS Catal. 2021, 11, 1858-1862. DOI: 10.1021/acscatal.0c05449
正文
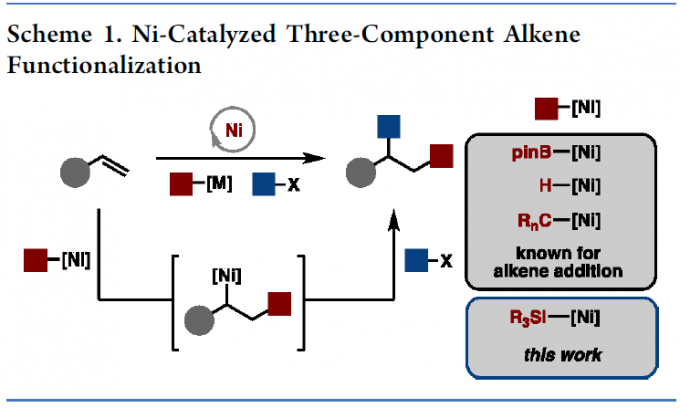
镍催化烯烃的官能化反应,可快速实现产物的复杂化,其中三组分反应是主要研究的内容。在此类反应中,涉及亲核性[Ni]-R配合物的生成,该亲核性[Ni]-R配合物可与烯烃结合以生成能够与各种亲电试剂反应的仲[Ni]-烷基配合物(Scheme 1)。迄今为止,该化学反应主要与[Ni]-Bpin、[Ni]-H、[Ni]-CRn以及几种不同的亲电试剂一起反应。对于涉及亲核性[Ni]-SiR3中间体的研究相对较少,但其可快速引入硅分子。据文献查阅,[Ni]-SiR3配合物已用于交叉偶联、脱氢烯烃甲硅烷基化和两组分烯烃官能化反应中,但在三组分烯烃官能化反应却很少被使用。如Yin等[1] 报道了Ni催化烯烃芳基甲硅烷基化反应,Kamei等[2]报道了Ni催化烯烃的甲硅烷基化反应等。
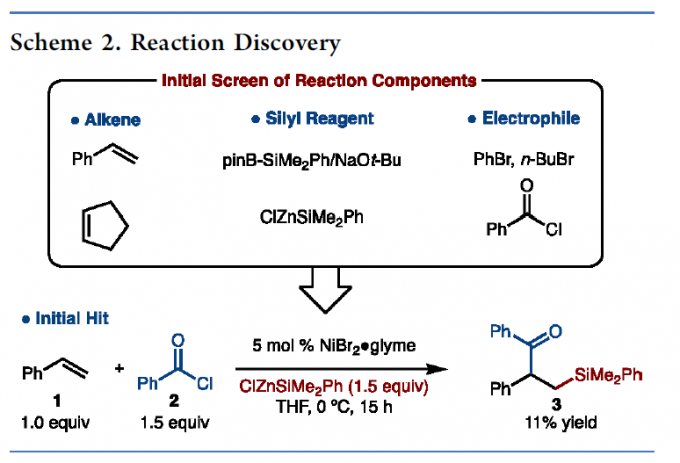
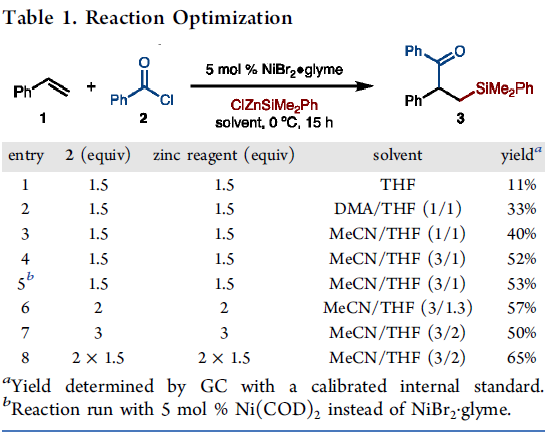
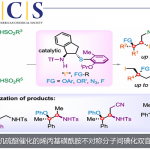
首先,作者以烯烃(苯乙烯,环戊烯)、硅试剂(pinBSiMe2Ph/NaOt-Bu,ClZnSiMe2Ph)和亲电试剂(PhBr,n-BuBr,PhCOCl)进行了筛选(Scheme 2)。最终发现,使用ClZnSiMe2Ph、苯乙烯和PhCOCl为底物时,可获得11%的甲硅烷基化产物3。此外,作者对反应条件进一步优化后发现(Table 1),当以5 mol% 的NiBr2·glyme为催化剂,可在THF/MeCN(3:2)的混合溶剂反应,获得65%收率的目标产物3。
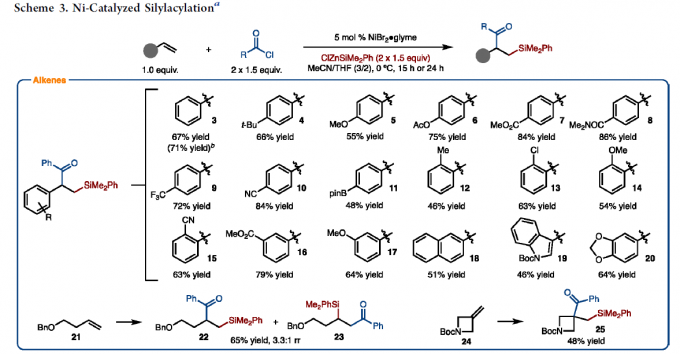
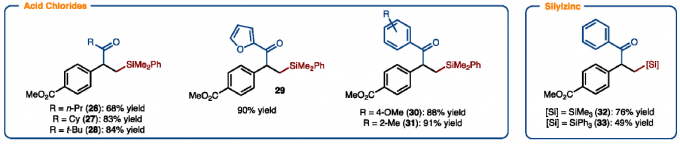
在获得上述最佳反应条件后,作者开始对底物范围进行了扩展(Scheme 3)。反应结果表明,苯乙烯的芳基取代,不受电子效应和定位效应的影响,均可获得相应的产物3–17。值得注意的是,具有吸电子基团的底物具有更高的收率。同时,具有萘基、吲哚基和胡椒基的乙烯底物,均可顺利反应,获得产物18–20。其次,未活化的烯烃21也可进行反应,获得支链(22)和线性(23)的混合物。而以烯烃24为底物时,则可获得具有季碳中心的产物25,为单个区域异构体。此外,各种烷基和芳基酰氯,均以良好的收获得产物26–31。同时,ClZnSiMe3和ClZnSiPh3均以中等收率获得产物32和33。
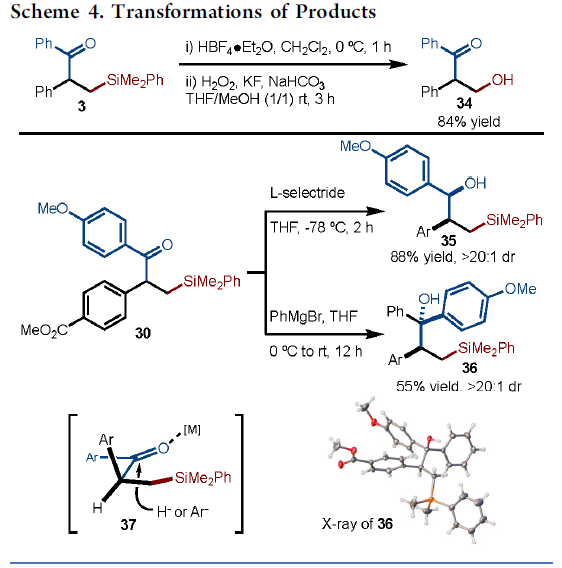
为了进一步证明反应的实用性,作者对产物进行了后期的修饰(Scheme 4)。首先,通过Tamao-Fleming氧化3可合成醇34。其次,使用L-selectride,可轻松实现酮30的还原,获得手性醇35,dr > 20:1。而使用PhMgBr时,可实现高选择性的加成反应,获得具有季碳中心的手性醇产物36,其中37为反应可能的过渡态。
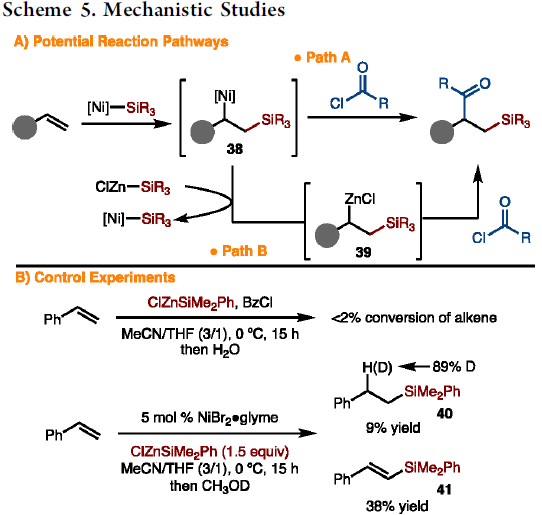
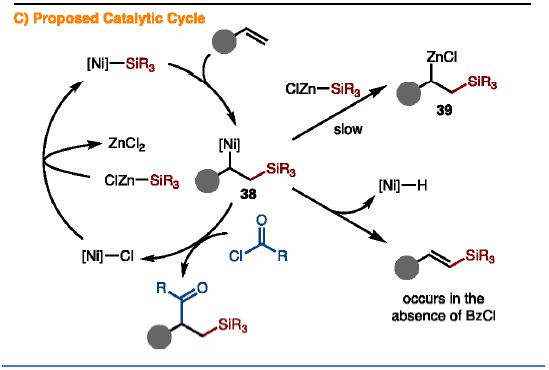
为了进一步了解反应的机理,作者进行了相关的对照实验(Scheme 5)。首先,反应可能涉及两种途径(Scheme 5A),在Path A中,烷基-[Ni]-配合物38直接与酰氯反应,生成目标产物。在Path B中,烷基-[Ni]-配合物38与ClZnSiR3进行金属转移形成烷基-ZnCl中间体39,再与酰氯反应生成目标产物。同时,以苯乙烯、ClZnSiMe2Ph和BzCl为底物时,在无Ni催化剂时,仅获得微量的产物,这与先前报道的一致[3]。而在Ni催化剂下,体系无亲电子试剂时,形成40和41的混合物,表明Ni催化加成ClZnSiMe2Ph,可能是通过原位生成的烷基-Zn-中间体的质子化形成了40,而41是通过β-氢化物消除而形成。同时,根据中间步骤的相对速率对比,形成烷基-ZnCl中间体39的重金属化必须比β-氢化物消除生成41慢。此外,在标准反应条件下观察到所需的三组分偶联产物优先形成41,所以烷基-[Ni]-配合物38的直接亲电捕获必须比消除β-氢化物更快。因此,Path A最有可能,具体过程如下(Scheme 5C),首先,[Ni]-SiR3与烯烃加成,形成烷基-[Ni]-配合物38。随后,配合物38与酰氯直接反应生成产物,并再生催化剂。对于烷基-[Ni]-配合物与酰氯的反应机理,可通过直接加成或通过氧化加成/还原消除进行。
总结
印第安那大学M. Kevin Brown课题组报道了一种涉及[Ni]-SiR3配合物作为催化中间体,实现烯烃官能化的反应。同时,该反应具有广泛的底物范围,各种烯烃、硅试剂和亲电试剂均与体系兼容。通过对产物的后期衍生化,进一步证明了反应的实用性。机理研究表明,生成烷基-[Ni]-配合物38可与亲电试剂直接反应。












No comments yet.