本文作者:杉杉
导读
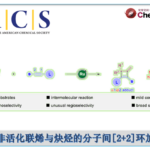
近日,武汉大学雷爱文和陕西师范大学高子伟课题组在Green Chem.发表论文,通过电化学过程,实现了硫氰化烯胺酮(thiocyanatedenaminones)的高度立体选择性合成,涉及C-H键硫氰化(thiocyanation)以及乙烯基C-N键氨基转移(transamination)的过程。同时,各种芳基烯胺酮均与体系相容,以高达87%的收率获得所需的硫氰化烯胺酮化合物。值得注意的是,该反应无需外部氧化剂、电解质和过渡金属催化剂。此外,克级实验进一步证明了反应的实用性。相关成果发表于近期Green Chem.,其中武汉大学雷爱文教授及其课题组成员Lu Lijun和陕西师范大学高子伟教授为共同通讯作者。
Electrochemical oxidative thiocyanation and amination ofenaminones towards the synthesis of multi-substituted alkenes
Fangling Lu, Kan Zhang, Yanxiu Yao, Ying Yin, Jiafu Chen, Xinwei Zhang, Yin Wang, Lijun Lu,Ziwei Gao, Aiwen Lei
Green Chem. ASAP DOI:10.1039/D0GC03590D
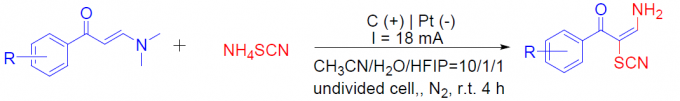
正文
有机硫氰酸酯(thiocyanates)作为一类重要的骨架,广泛存在于药物和农用化学品中。此外,有机硫氰酸酯还作为通用的中间体,可用于合成各种具有价值的含硫化合物,如磺酸、硫杂环、硫醇、硫化物等。因此,构建有机硫氰酸酯的方法引起了化学家的广泛关注,如芳基硫醚的传统氰化(cyanation)方法和芳环上的亲核或亲电取代反应 [1]。近年来,涉及过渡金属催化[2]、氧化剂氧化[3]或光氧化还原催化[4]的硫氰化反应已成为合成有机硫氰酸酯更为有效的策略。2019年,Wan课题组[5]报道了可见光诱导烯胺酮的硫氰化。随后,Wu课题组[6]以空气为终端氧化剂,实现了可见光促进被活化酮的氨基硫氰化。最近,Duan课题组[7]使用烯胺酮、KSCN和NBS为底物,实现了溶剂控制的硫氰化反应。然而,此类反应存在一定的局限性,如有限的底物范围、必需的过渡金属催化剂或光催化剂等。
电化学氧化还原反应,作为一种高效且环保的方法。可使用廉价、可再生且本质安全的电子作为无质量试剂进行电合成,以活化有机分子以生成反应性中间体,符合绿色化学的需求。近些年来,电化学C-H硫氰化也取得一定的进展。如2010年,Becker课题组[8]报道了芳族化合物的阳极硫氰化反应,随后,该课题组又实现了烯烃的两步阳极硫氰化法。此外,由于电解质是电解反应的基本元素,而在许多电化学反应中,辅助电解质仅用于导电,在反应后会浪费掉。因此,若能使用可充当电解质的底物,则符合原子经济性的特点。在此,本文将介绍一种在无金属、无外部氧化剂和无外部电解质的条件下,通过电化学阳极氧化从而高效构建硫氰化烯胺酮衍生物的方法。
首先,作者以(E)-3-(二甲基氨基)-1-苯基丙-2-烯-1-酮1a和硫氰酸铵2a作为模型底物,进行了相关反应条件的筛选(Table 1)。反应的最佳条件为:以CH3CN/H2O/HFIP作为混合溶剂,氮气保护下,在无隔膜的电解槽中以18 mA恒定电流持续反应4 h,即可获得84%收率的目标产物3a。
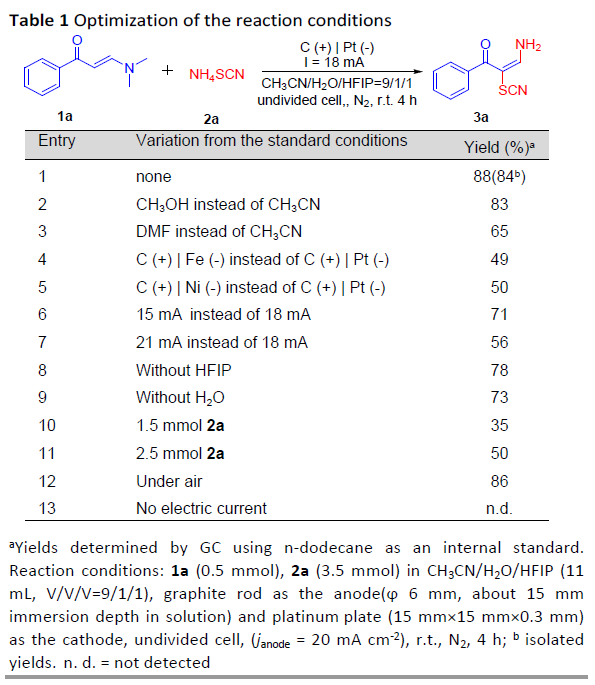
在获得上述最佳反应条件后,作者开始对烯胺酮底物1进行了扩展(Scheme 1)。反应结果表明,苯环上的取代基,不受电子效应和定位效应的影响,均可获得相应的产物3a–3q。值得注意的是,具有卤素取代基的底物(3g–3m),同样与体系兼容,为进一步功能化提供了多种可能。此外,杂环和多环芳烃均以50-75%的收率获得相应的产物3r–3v。然而,对于其它N, N-二取代的烯胺酮在标准反应条件下未能进行反应,如2w和2x。
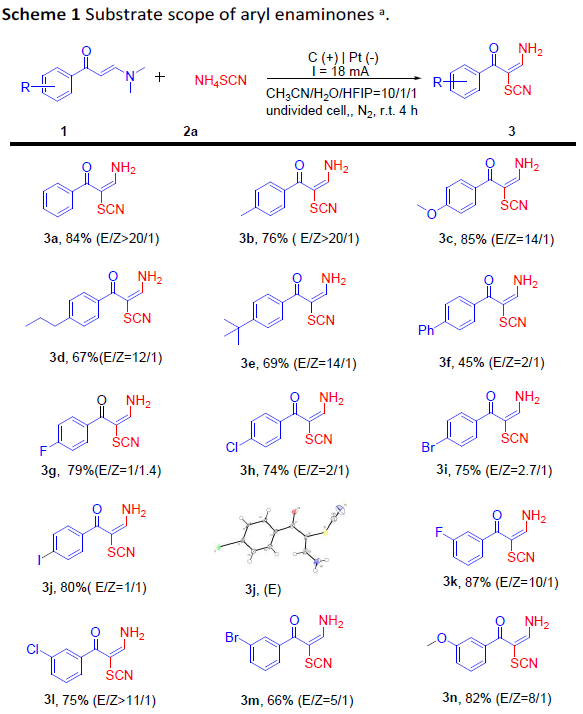

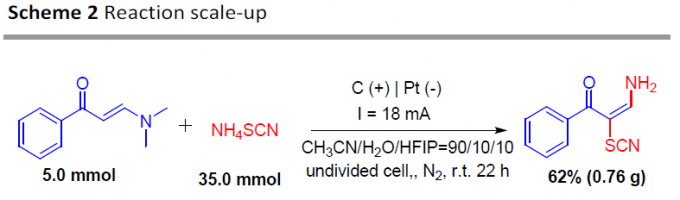
随后,为了进一步证明反应的实用性,作者进行了克级实验(Scheme 2)。反应结果表明,1a与2a可顺利进行反应,获得62%收率的目标产物3a。
为了进一步了解反应的机理,作者进行了相关的对照实验(Scheme 3)。当在标准条件下加入1,1-二苯乙烯(DPE)时,仅获得25%收率的硫氰化烯胺酮,同时通过GC-MS检测到DPE-SCN加合物。这些结果表明,反应可能经历了自由基途径,硫氰基自由基中间体可能参与了转化。其次,当使用KSCN代替NH4SCN时,未观察到所需的产物,表明产物的氨基源自NH4SCN。此外,通过对两种标准底物1a和2a的循环伏安(CV)实验表明,在1.59 V处观察到1a的氧化峰,在1.49 V处观察到2a的氧化峰,表明2a在阳极优先被氧化(Scheme 4)。
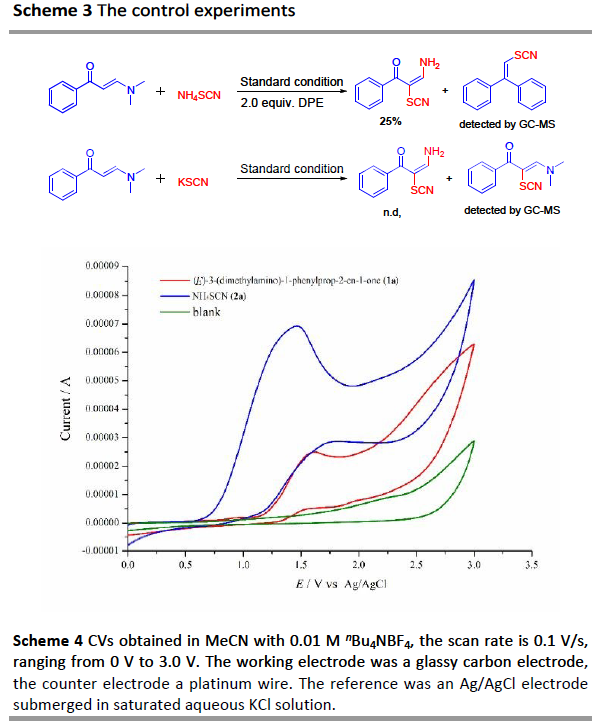
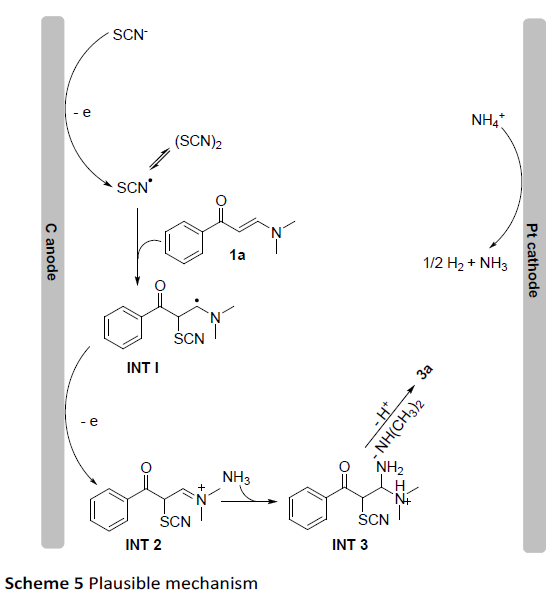
根据上述的实验和相关文献的查阅[5,6,9],作者提出了一种可能的反应机理(Scheme 5)。首先,SCN–被阳极氧化为硫氰酸自由基,然后快速二聚生成二硫键。然后,将硫氰酸自由基加到C=C双键上,生成中间体INT-1,经单电子阳极氧化,形成阳离子中间体INT-2,再被NH3亲核进攻,从而生成相应的中间体INT-3。最后,中间体INT-3经N,N-二甲基胺和质子的消除,得到所需的产物3a。此外,在阴极处,铵离子可被还原产生氨气和氢气。
总结
武汉大学雷爱文和陕西师范大学高子伟课题组报道了,一种高效且具有高度立体选择性的电化学策略,成功构建硫氰化烯胺酮衍生物。同时,该反应具有广泛的底物范围、良好的官能团耐受性、反应条件温和等特点。值得注意的是,该反应无需使用额外的金属催化剂、外部氧化剂以及电解质(底物NH4SCN可充当)。
参考文献
[1] a) T. Castanheiro, M. Gulea, M. Donnard and J. Suffert,
Eur. J. Org. Chem., 2014,
2014, 7814-7817; b) F. Teng, J. T. Yu, H. Yang, Y. Jiang and J. Cheng,
Chem. Commun.,
2014,
50, 12139-12141. d) R. Frei, T. Courant, M. D. Wodrich and J. Waser,
Chemistry,
2015,
21, 2662-2668; d) X.-H.Li, L.-G. Li, X.-L. Mo and D.-L. Mo,
Synthetic Commun.,
2016,
46, 963-970; e) W. Guo, W. Tan, M. Zhao, L. Zheng, K. Tao, D. Chen and X. Fan,
J. Org. Chem., 2018,
83, 6580-6588.
[2] a) X.-Z. Zhang, D.-L.Ge, S.-Y.Chen and X.-Q. Yu,
RSC Adv.,
2016,
6, 66320-66323. b) H. Jiang, W. Yu, X. Tang, J. Li and W. Wu,
J. Org. Chem.,
2017,
82, 9312-9320; c) Y. Chen, S. Wang, Q. Jiang, C. Cheng, X. Xiao and G. Zhu,
J. Org. Chem., 2018,
83, 716-722; d) A. Dey and A. Hajra,
Adv. Synth.Catal.,
2019,
361, 842-849; e) M. Gao, M. Y. Chen, X. Pannecoucke, P. Jubault and T. Besset,
Chem. Eur. J. 2020, 26, 15497-15500.
[3] a) J. Wu, G. Wu and L. Wu,
Synthetic Commun.,
2008,
38, 2367-2373; b) D. Yang, K. Yan, W. Wei, G. Li, S. Lu, C. Zhao, L. Tian and H. Wang,
J. Org. Chem.,
2015,
80, 11073-11079; c) H. Yang, X. H. Duan, J. F. Zhao and L. N. Guo, T
Org. Lett.,
2015,
17, 1998-2001. d) X.-Z. Zhang, D.-L.Ge, S.-Y. Chen and X.-Q. Yu, RSC Adv.,
2016, 6, 66320-66323. e) T. Kittikool and S. Yotphan,
Eur. J. Org. Chem., 2020,
2020, 961-970; f) X. Mao, J. Ni, B. Xu and C. Ding,
Org. Chem. Front.,
2020,
7, 350-354.
[4]a) W. Fan, Q. Yang, F. Xu and P. Li,
J. Org. Chem.,
2014,
79, 10588-10592; b) S. Mitra, M. Ghosh, S. Mishra and A. Hajra,
J. Org. Chem., 2015,
80, 8275-8281. c) P. Chauhan, Ritu, Preeti, S. Kumar and N. Jain,
Eur. J. Org. Chem., 2019,
2019, 4334-4340; d) Y.-J. Chen, Y.-H. He and Z. Guan,
Tetrahedron,
2019,
75, 3053-3061; e) Y. Chen, Y.-J.Chen, Z. Guan and Y.- H. He,
Tetrahedron,
2019,
75, 3053-3061; f) G. Li, Q. Yan, X. Gong, X. Dou and D. Yang,
ACS Sustain. Chem. Eng.,
2019,
7, 14009-14015.
[5] Y. Gao, Y. Liu and J.-P. Wan,
J. Org. Chem., 2019,
84, 2243-2251.
[6] P.-F. Yuan, Q.-B.Zhang, X.-L.Jin, W.-L.Lei, L.-Z.Wu and Q. Liu,
Green Chem.,
2018,
20, 5464-5468.
[7] X. Duan, X. Liu, X. Cuan, L. Wang, K. Liu, H. Zhou, X. Chen, H. Li and J. Wang,
J. Org. Chem., 2019,
84, 12366-12376.
[8] A. Gitkis and J. Y. Becker, A
ElectrochimicaActa,
2010,
55, 5854-5859; c) A. Gitkis and J. Y. Becker,
Electroanalysis,
2016,
28, 2802-2807;
[9]. Z. Yang, Y. Wang, L. Hu, J. Yu, A. Li, L. Li, T. Yang and C. Zhou,
Synthesis,
2019,
52, 711-718.























No comments yet.