本文作者:杉杉
导读
近日,德国马克斯-普朗克研究所Benjamin List教授课题组在JACS上发表论文,报道了一种快速合成高对映选择性且无保护β2-氨基酸的通用方法。该方法以新型亚胺基二亚氨基正膦酸酯(IDPi)为催化剂,以双甲硅烷基乙烯酮缩醛(bis-SKA)与甲硅烷基化的氨基甲基醚为底物,简单水解后即可获得高收率和高对映选择性的游离β2-氨基酸。值得注意的是,该方法同样可获得芳香族和脂肪族β2-氨基酸化合物。
Catalytic Asymmetric Synthesis of Unprotected β2‑Amino Acids
Chendan Zhu, Francesca Mandrelli, Hui Zhou, RajatMaji, and Benjamin List*
J.Am. Chem. Soc.ASAP DOI:10.1021/jacs.1c00249
正文
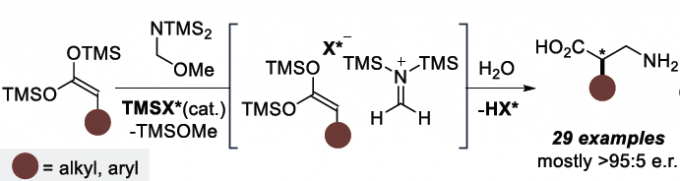
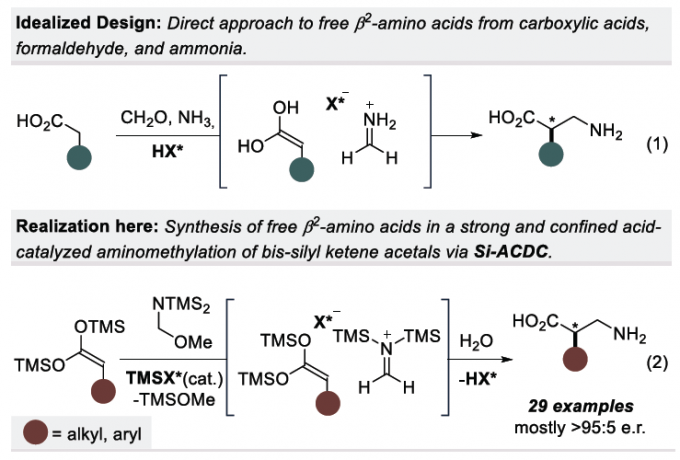
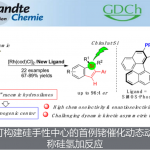
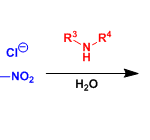
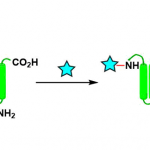
在各类氨基酸化合物中,β2-氨基酸极为重要,它们广泛存在于药物、天然产物和候选药物中。近年来,虽然多种β2-氨基酸的不对称合成方法得到开发,但对于无任何保护基直接合成游离氨基酸的催化方法尚未报道。作者设想,可通过手性酸催化羧酸、甲醛和氨的直接三组分Mannich反应进行合成(eq 1)。然而,除丙二酸衍生物以外,对于烯醇化的羧酸则无法进行相应的催化过程。对于使用预合成的双甲硅烷基乙烯酮缩醛(bis-SKA)与甲醛亚胺化合物进行的Mukaiyama型反应虽已实现非对映选择性的形式,但对于不对称形式的合成却是未知。在此,作者报道了以亚氨基二磷酸亚氨酸酯(IDPi)催化剂,实现bis-SKAs与甲硅烷基化氨基甲基醚的不对称Mukaiyama-Mannich型反应,从而获得一系列芳香族或脂肪族取代的游离β2-氨基酸(eq 2)。
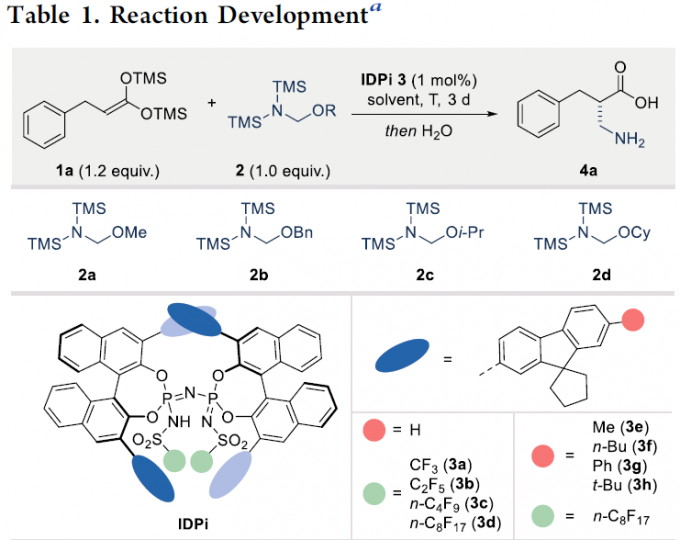
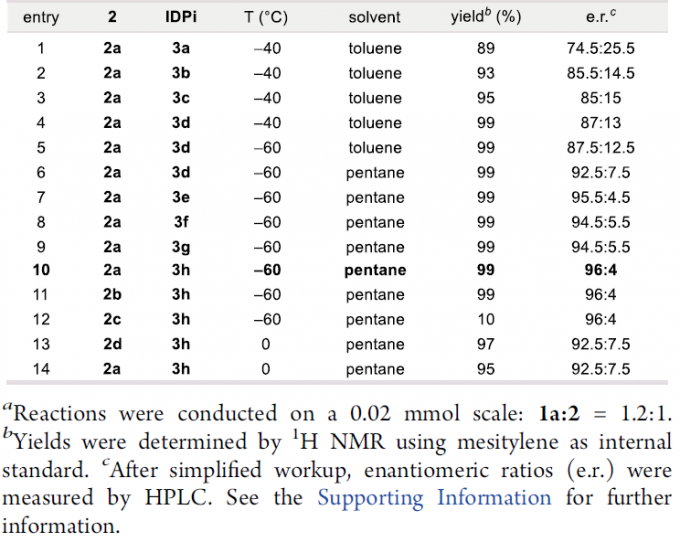
首先,作者以1a和2作为模型底物,进行了相关反应条件的筛选(Table 1)。反应的最佳条件为:当以1a和2a为底物,IDPi-3h为催化剂,可在-60 ℃下戊烷溶剂中反应,再经水解后,即可获得99%收率和96:4 e.r.的氨基酸产物4a。
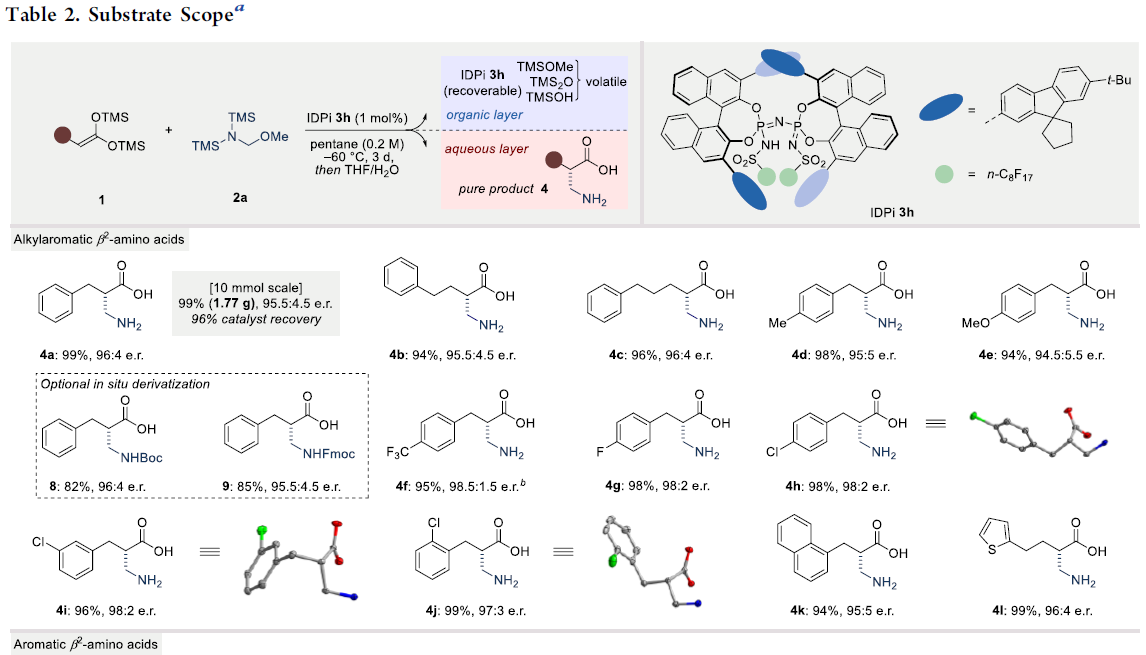
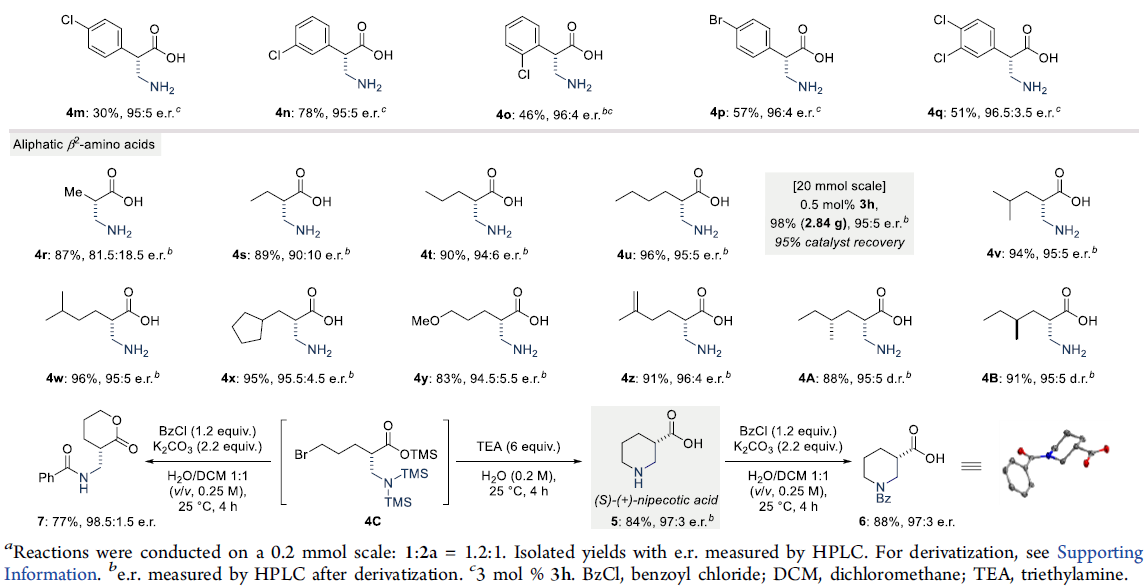
在获得上述最佳反应条件后,作者开始对bis-SKA底物1进行了扩展(Table 2)。对于烷芳基氨基酸产物扩展时发现(4a–4l),在苯基和羧酸官能团之间具有不同链长度的底物,均可顺利反应,获得产物4a–4c。同时,芳基取代不受电子效应和定位效应的影响,均可获得产物4d–4j。具有萘基、杂芳基取代的底物,也具有良好的耐受性,获得产物4k和4l。对于芳基氨基酸产物扩展时发现(4m–4q),具有不同卤代的芳基底物时,反应性均较低,需加入3 mol%的催化剂才能获得中等至良好的收率和出色对映选择性的产物。对脂肪族氨基酸产物扩展时发现(4r–4z和4A-4B),具有不同链长度的底物,均可顺利反应,获得产物4r–4u,同时对映选择性随烷基链的长度增加而增加。对于支链烷基(4v–4w)、环状烷基(4x)、甲氧基(4y)、烯烃取代的烷基链(4z)均可耐受,以优异的收率和对映选择性获得所需的产物。同时,手性底物1A和1B,均在反应中保持出色的非对映选择性,获得高收率的产物4A和4B。此外,溴代产物4C经水解,可获得84%收率和97:3 e.r.的γ-氨基丁酸摄取抑制剂(S)-(+)-乳酸5。溴代产物4C也可进行环化反应,获得77%收率和98.5:1.5 e.r.的δ-戊内酯7。值得注意的是,4a和4u的克级实验以及产物后期的衍生化(8和9),进一步证明了反应的实用性。
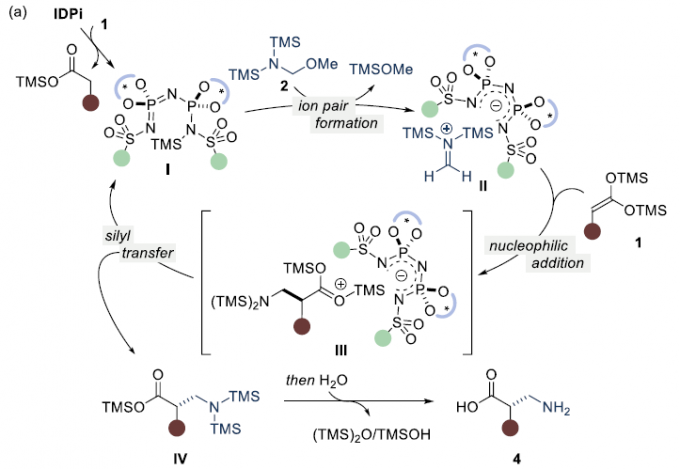
最后,作者提出了一种可能的反应机理(Figure 1a)首先,bis-SKA底物1与IDPi催化剂3进行原位甲硅烷基化反应,生成N-甲硅烷基化催化剂I和/或其非对映异构体O-Si-硅烷基同分异构体。然后,α-氨基甲基醚2与催化剂I反应,生成亚甲基亚胺阳离子-IDPi阴离子II,同时释放出TMSOMe。随后,bis-SKA 1与离子对II中的阳离子反应,得到离子对III。离子对III中的甲硅烷基从阳离子产物转移回到其它阴离子上,从而形成甲硅烷基化的产物IV,并再生催化剂I。最后,通过水解即可获得游离的β2-氨基酸4。
总结
德国马克斯-普朗克研究所Benjamin List教授课题组报道了一种通过双甲硅烷基乙烯酮缩醛(bis-SKA)与甲硅烷基化的氨基甲基醚的不对称催化反应,从而获得高收率和高对映选择性且无保护β2-氨基酸。同时,该反应具有广泛的底物范围,可合成一系列芳香族和脂肪族β2-氨基酸化合物。此外,通过克级实验以及产物后期的衍生化,进一步证明了反应的实用性。




















No comments yet.