作者:石油醚
导读:
有机硼化合物在化学、材料学、能源研究和药物化学等领域中应用广泛。作为关键合成切块,有机硼化物在各种交叉偶联反应中发挥着重要作用。近年来,硼原子保留的有机反应受到了广泛关注,其中硼迁移策略是一种获取保留硼化合物的便捷方法。目前,虽然关于1, 2-硼迁移的报道很多,但自由基诱导的1, 2-硼迁移研究相对较少,且主要以自由基加成和单电子氧化两种策略实现自由基诱导的1, 2-硼迁移,因而限制了该领域的发展。最近,成都大学李俊龙教授团队和成都中医药大学韩波教授团队合作,提出了一种创新的光促进NHC催化自由基诱导的1, 2-硼迁移酰化反应。并发表于Science Advances上
“N-Heterocyclic carbene catalytic 1,2- boron migrative acylation accelerated by photocatalysis.
Hua Huang, Zhao-Yuan Yu, Lu- Yao Han, Yi-Qi Wu, Lu Jiang, Qing- Zhu Li, Wei Huang, Bo Han*, Jun- Long Li*
Sci. Adv. 2024, 10, eadn8401. Doi: 10.1126/sciadv.adn8401”
正文:
有机硼化合物在化学、材料学、能源研究和药物化学等领域中应用广泛。作为关键合成切块,有机硼化物在各种交叉偶联反应中发挥着重要作用。此外,C-B键可以通过氧化或质子化生成相应的醇类和烃类化合物。尽管这些方法扩展了有机硼化学的应用范围,但它们主要集中在硼的多样性官能团化上。近年来,硼原子保留的有机反应受到了广泛关注,其中硼迁移策略是一种获取保留硼化合物的便捷方法。目前,虽然关于1, 2-硼迁移的报道很多,但自由基诱导的1, 2-硼迁移研究相对较少,且主要以自由基加成和单电子氧化两种策略实现自由基诱导的1, 2-硼迁移,因而限制了该领域的发展。
最近,成都大学李俊龙教授团队和成都中医药大学韩波教授团队合作,提出了一种创新的光促进NHC催化自由基诱导的1,2-硼迁移酰化反应。
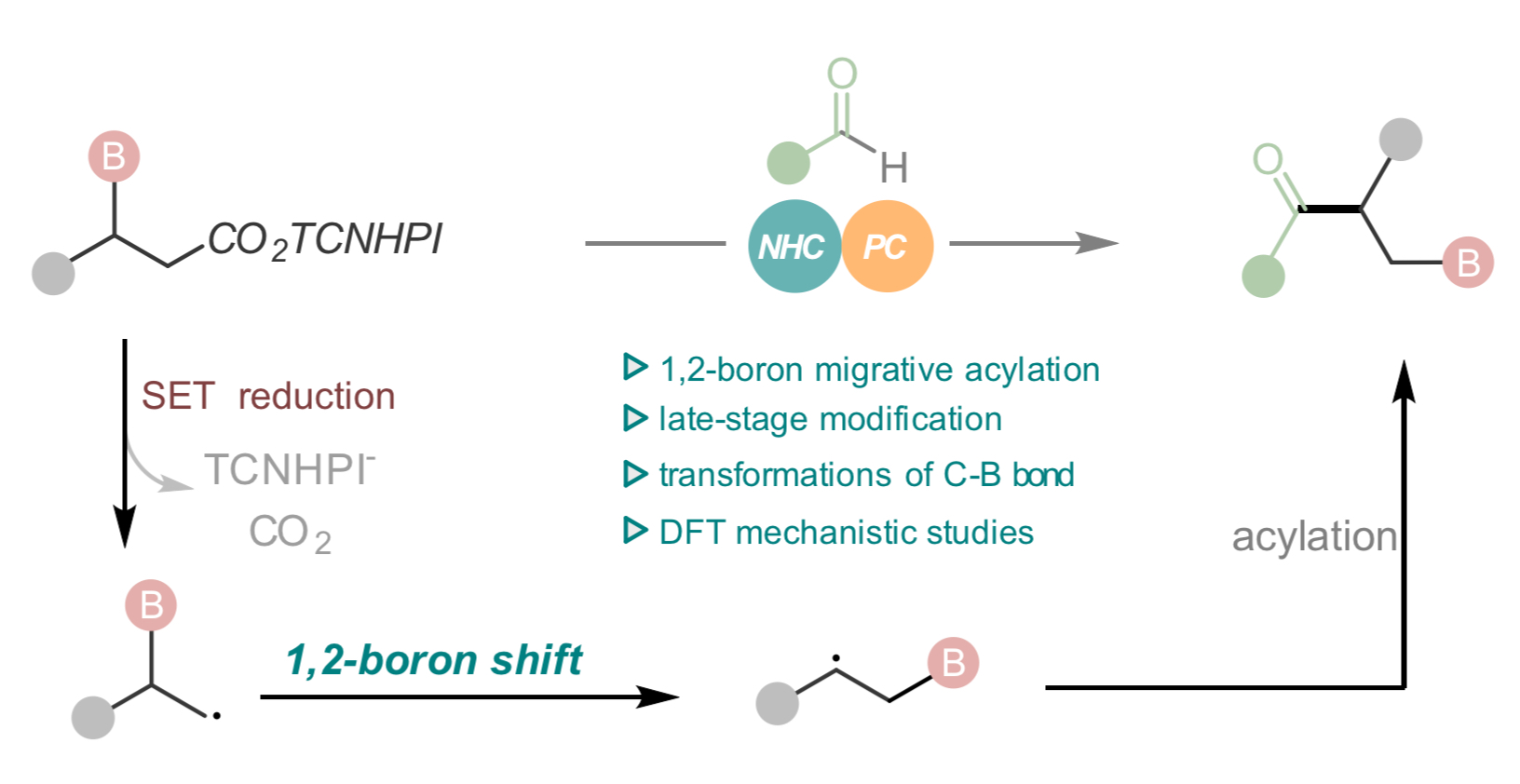
近年来,NHC催化的自由基反应取得了显著进展,该研究团队一直致力于NHC有机小分子催化的自由基反应研究(Nat. Catal. 2024, doi: 10.1038/s41929-024-01194-5; Angew. Chem. Int. Ed. 2022, 61, e202116629; Angew. Chem. Int. Ed. 2022, 61, e202207824; Angew. Chem. Int. Ed. 2020, 59, 1863-1870; Chem. Sci. 2022, 13, 2584-2590; ACS Catal. 2024, 14, 3181-3190.)。尽管NHC催化的自由基反应与氢原子迁移(HAT)策略的结合,已经成为开发具有挑战性化学反应的有力工具。然而除氢原子外,目前尚无关于NHC催化介导的其他杂原子基团迁移的报道。本项研究通过新开发的具有缺电子离去基团的β-硼酸酯底物,经“单电子还原策略”生成关键的β-硼自由基中间体,随后通过1, 2-硼迁移、自由基偶联生成一系列β-酰基硼化物。该催化策略同样适用于药物分子和活性产物的后期修饰。通过一系列机理实验和密度泛函理论(DFT)计算,研究了反应的初步机理。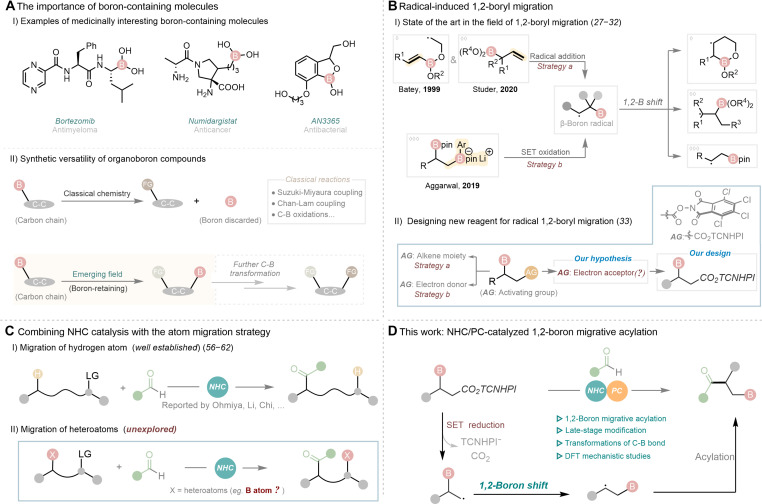
Fig. 1 Backgrounds of this study and research motivation.
该团队首先以对溴苯甲醛1a和β-硼基-N-羟基邻苯二甲酰亚胺(NHPI)酯2为模型底物,通过条件筛选结果表明:以1a和TCNHPI酯2b为底物,PC1为光催化剂,N1为氮杂环卡宾催化剂,Cs2CO3为碱,二氯甲烷/四氢呋喃(4:1)为溶剂,能够以73%的产率得到1, 2-硼迁移酰基化产物3a。
Table 1. Optimization studies.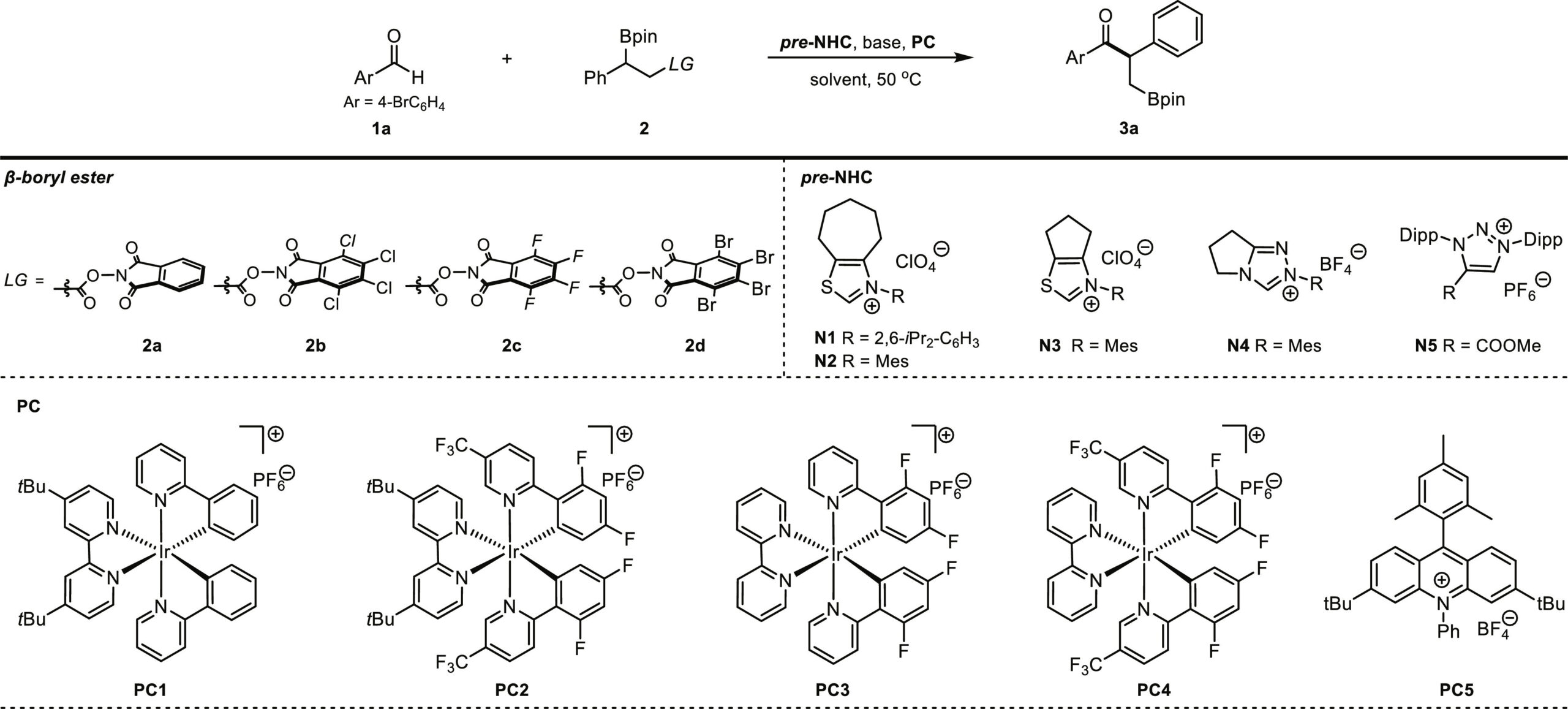
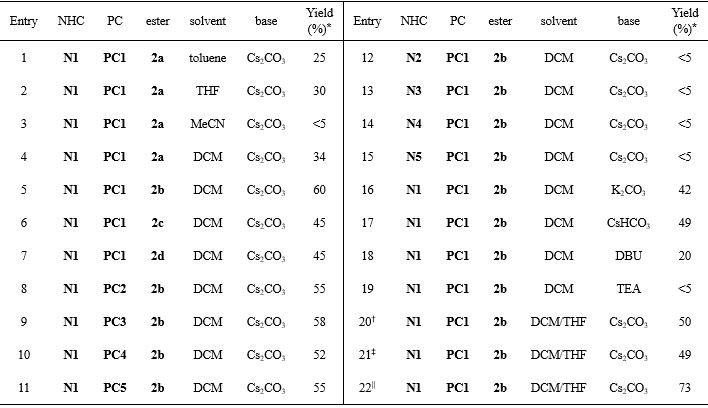
* Isolated yield of 3a. † DCM/THF = 1/1. ‡ DCM/THF = 3/2. || DCM/THF = 4/1. THF: tetrahydrofuran; DCM: dichloromethane; DBU: 1,8-diazabicyclo [5.4.0] undec-7-ene.
在最优条件下,作者对反应的普适性进行了考察。对于醛类底物,带有吸电子或供电子取代基的对位和间位苯甲醛都能与该催化体系兼容;邻位取代的苯甲醛反应也能顺利进行;双取代芳醛、稠环芳醛和各种杂芳香醛同样适用该催化体系。以脂肪醛为底物时,反应也能顺利进行。对于β-硼基TCNHPI酯类底物,芳环的对位、间位或邻位引入富电子或缺电子取代基时,该催化体系均能兼容;非苄基的TCNHPI酯底物也能顺利参与反应。其他硼源(如:Bhex、Bnep、Boct)作为1, 2-硼迁移的基团时,同样能够得到目标产物。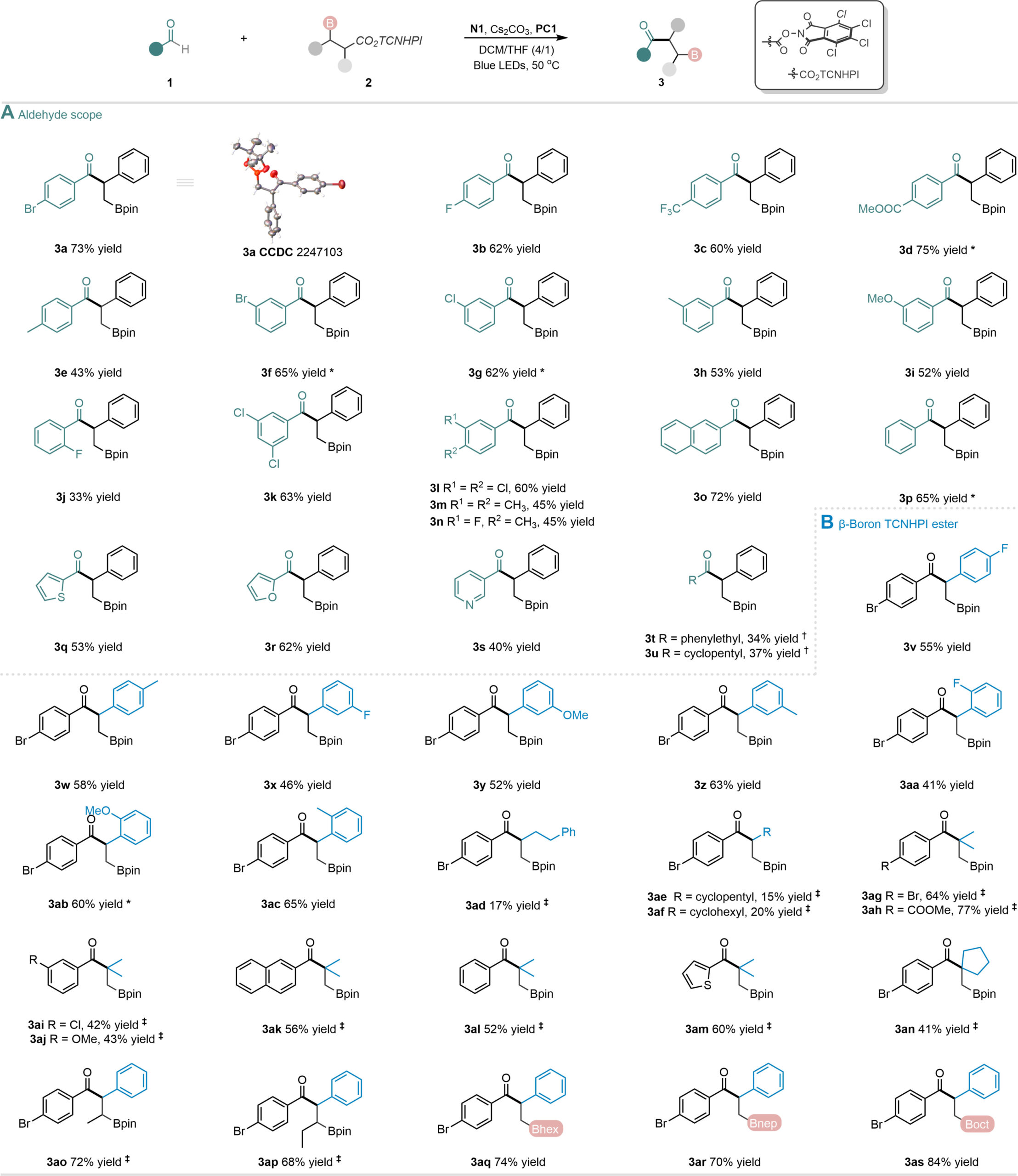
Fig. 2 Substrate scope for the catalytic reactions.
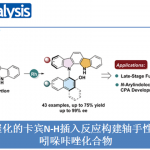
该催化体系反应条件温和,可用于多种药物骨架和生物活性分子的后期官能化。例如,非甾体类抗炎药二氟尼柳(Diflunisal)、托麦汀(Tolmetin)和萘普生(Naproxen)、降脂类药物环丙贝特(Ciprofibrate)、以及生物活性分子香叶醇(Geraniol)、紫檀芪(Pterostilbene)、姜酮(Zingerone)等。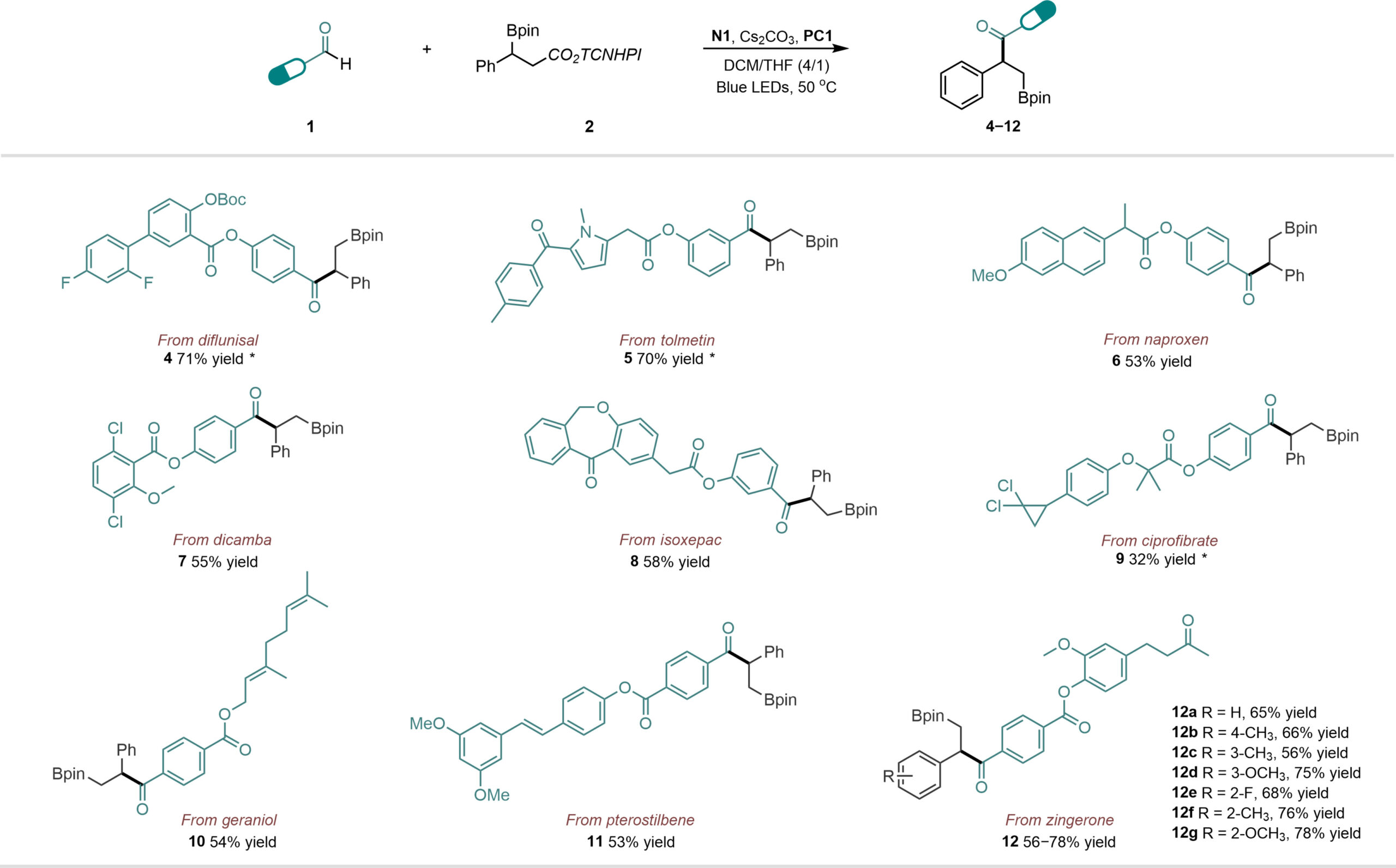
Fig. 3 Late-stage functionalization of the drug-derived or natural product-derived aldehydes.
随后,通过放大反应和对硼迁移酰化产物的进一步转化,成功实现了含硼化合物向各种官能团的衍生化(如偶联、乙烯基化、氧化、氟硼酸钾等),进一步证明了有机硼化合物的有用性。此外,作者利用课题组自主设计合成的手性噻唑鎓NHC催化剂N6,对反应的不对称控制进行了初步探索,反应能以中等的对映选择性得到1, 2-硼迁移酰化产物3a。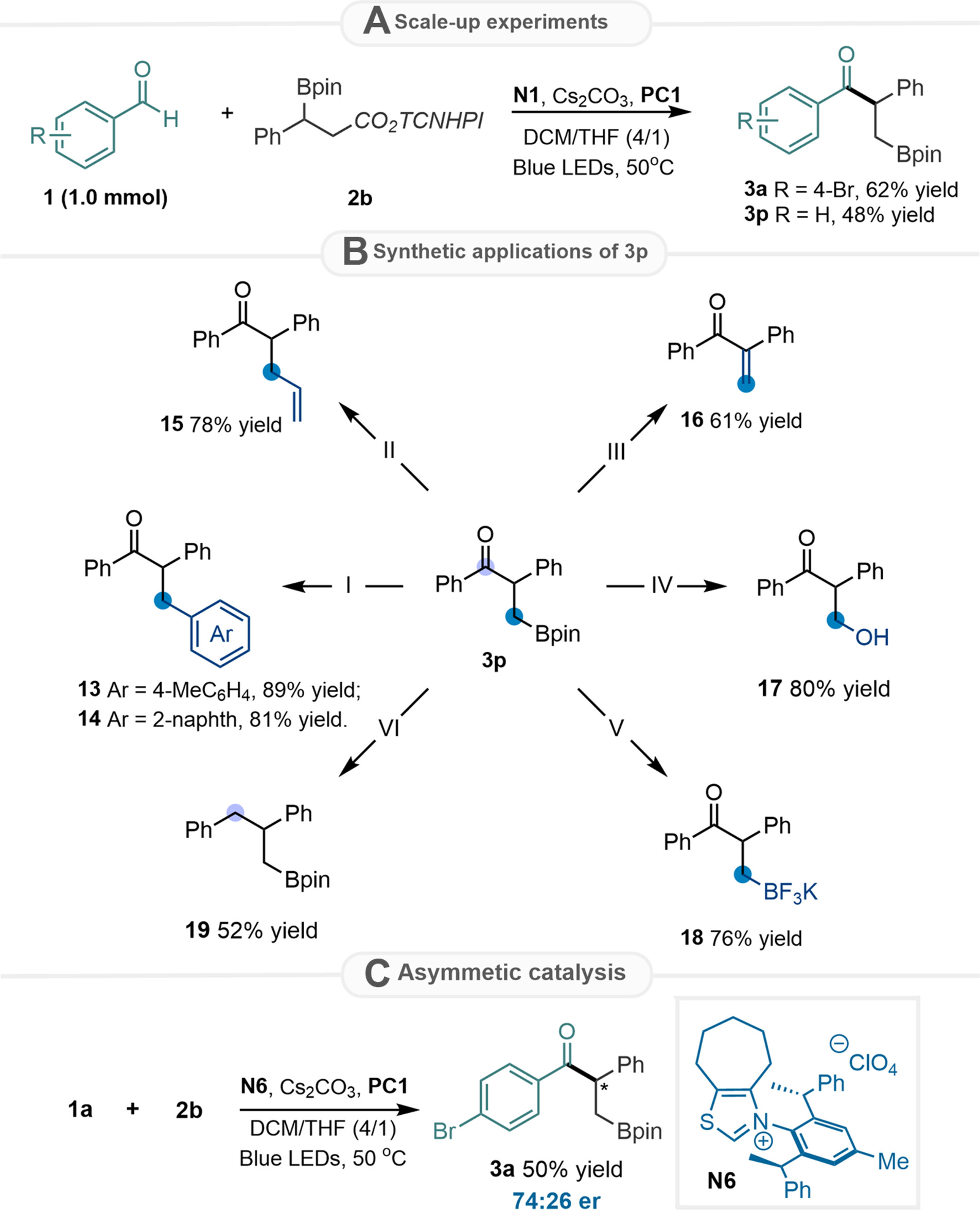
Fig. 4 Scale-up reaction, synthetic elaboration, and the attempt for an asymmetric version.
为了阐明该1, 2-硼迁移酰化的反应机理,作者进行了详细的机理实验研究。首先,通过控制实验发现,在不使用NHC催化剂的情况下,无目标产物生成。在室温且没有光催化剂和光照的条件下,无论是以2a还是2b为底物,都无法生成目标产物。在50°C且没有光催化剂和光照的条件下,以2a为底物时没有产生任何产物,但以2b为底物时生成了目标产物3a,产率为40%。通过紫外-可见吸收光谱实验,证实光催化过程是由光催化剂的激发引发的。荧光淬灭实验表明,激发态的PC1很容易被活性酯2b淬灭。通过开关灯实验以及量子产率的测定,显示该反应是催化自由基过程。此外,作者测定了2b的还原电位,表明激发态光催化剂与活性酯2b之间的单电子转移是可行的。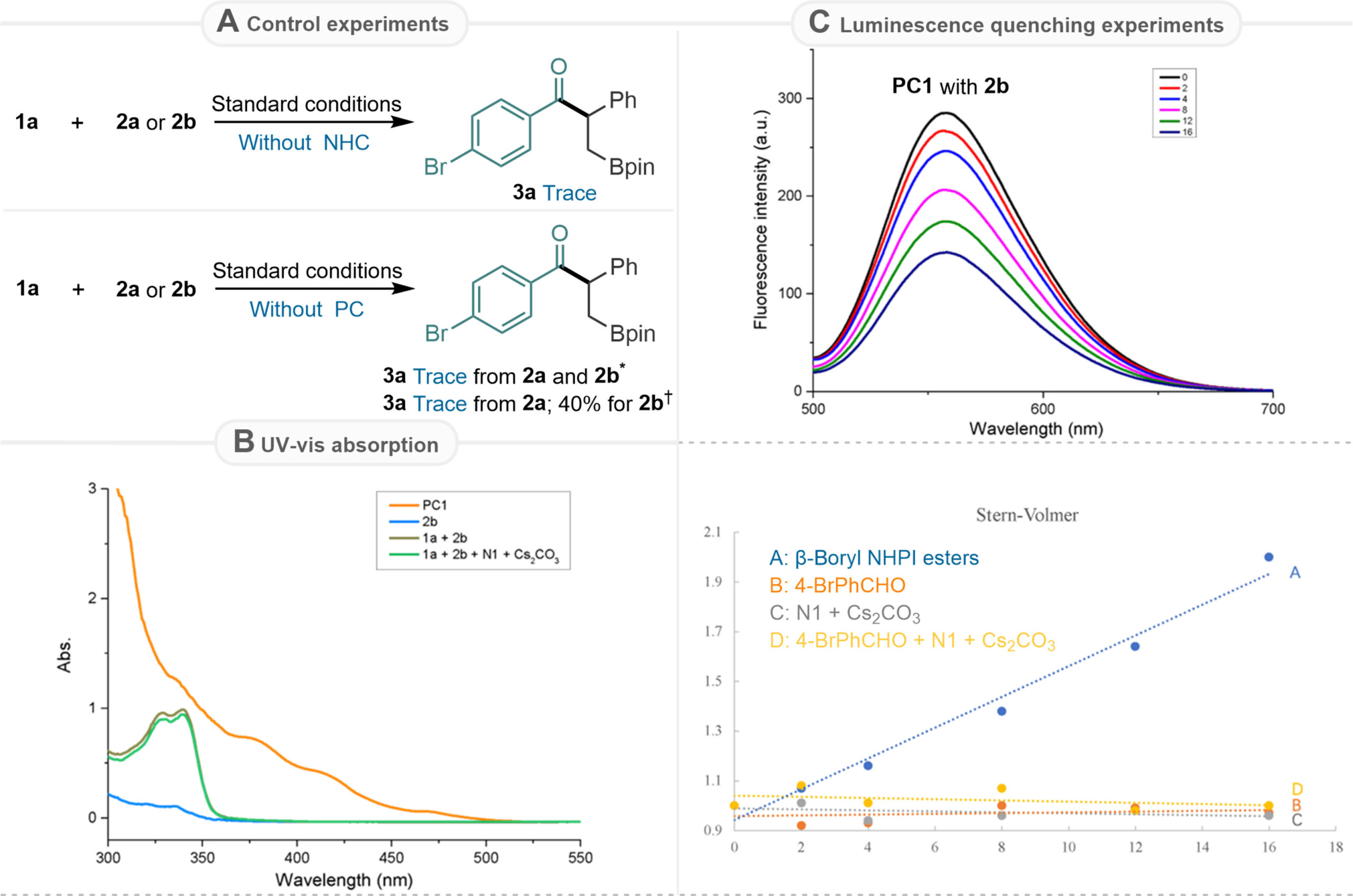
Fig. 5 Experimental mechanistic investigations. (A) Control experiments. (B) UV-vis absorption. (C) Luminescence quenching experiments. * At room temperature. † At 50 oC.
为了更深入地理解该催化策略的机理,作者进一步通过密度泛函理论(DFT)计算,研究了各反应路径的能量,为光促进的NHC催化的自由基诱导的1, 2-硼迁移酰化机理提供了可靠的依据。在此基础上,作者提出了合理的反应途径:首先,光催化剂在光照条件下被激发,随后被活性酯淬灭,发生单电子转移,生成烷基自由基IV和相应的光催化剂Ir(IV)。接下来,烷基自由基IV通过1, 2-硼迁移,转化为更稳定的自由基V。同时,在碱性条件下,醛与卡宾催化剂I缩合形成去质子化的Breslow中间体II。富电子的Breslow中间体II与光催化剂Ir(IV)发生单电子转移,再生Ir(III)光催化剂,并生成Breslow中间体衍生的酮自由基物种III。另一种可能的途径是,加热条件可以促进Breslow中间体II和活性酯2之间的直接单电子转移,生成烷基自由基IV,然后转化为更稳定的自由基V和酮自由基物种III。酮自由基物种III和自由基V之间发生自由基-自由基交叉偶联。最后,释放催化剂完成催化循环,同时生成目标产物3。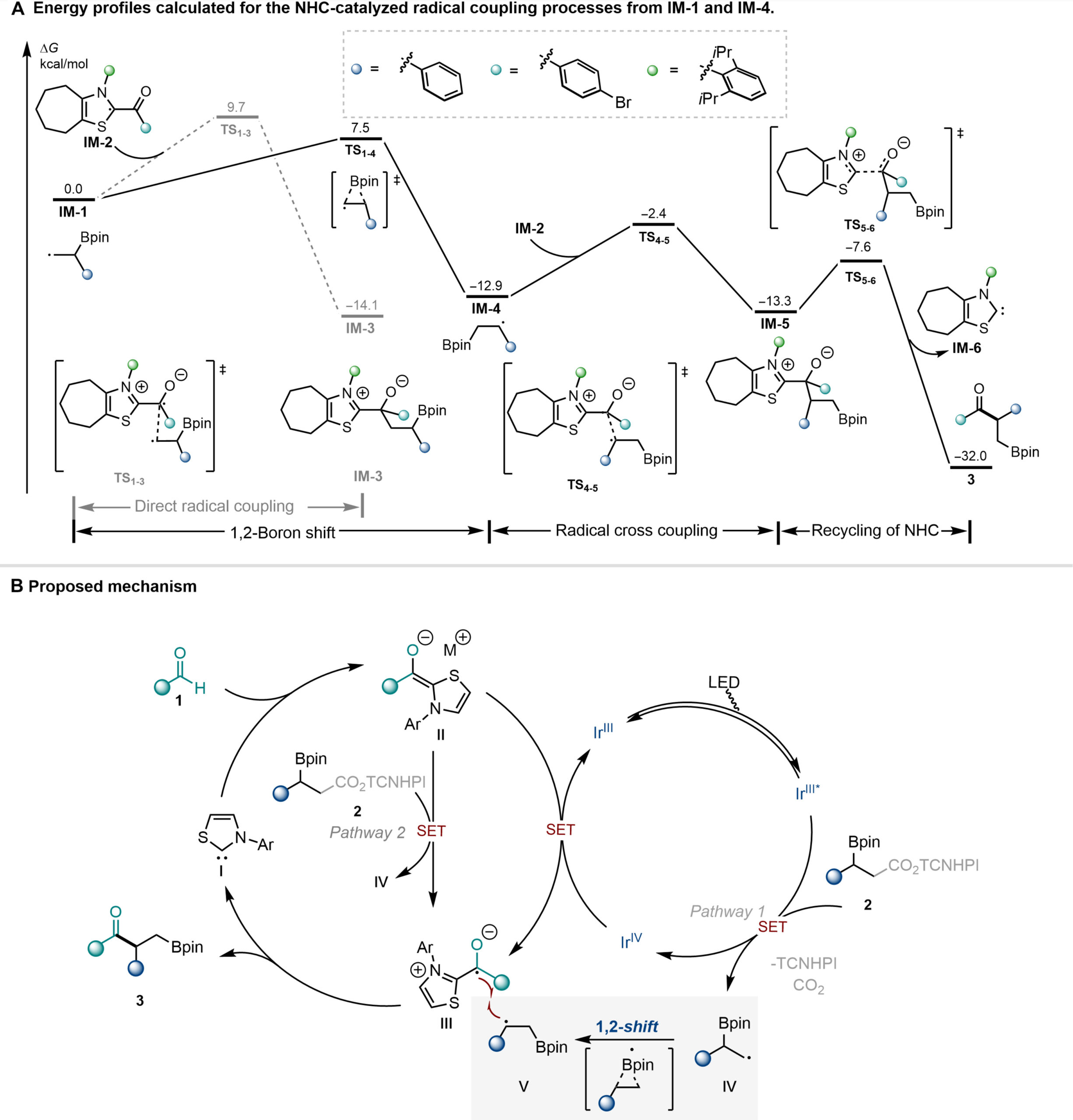
Fig. 6 DFT studies and proposed mechanism of the 1,2-boron migrative acylation.
总结:
综上,作者开发了一种“光促进的NHC自由基催化的1, 2-硼迁移酰化”反应。通过该催化策略,可以在温和条件下快速获得各种β-硼基酮化合物,可进一步将C-B键进行多样性的转化。该方法可用于药物分子和天然产物的后期修饰,作者还探索了该反应的不对称版本的可行性,得到了中等的对映选择性。最后,作者通过控制实验、光物理实验和DFT计算,进一步阐明了NHC催化1, 2-硼迁移酰化的反应机理。














No comments yet.