本文作者:Summer
导读
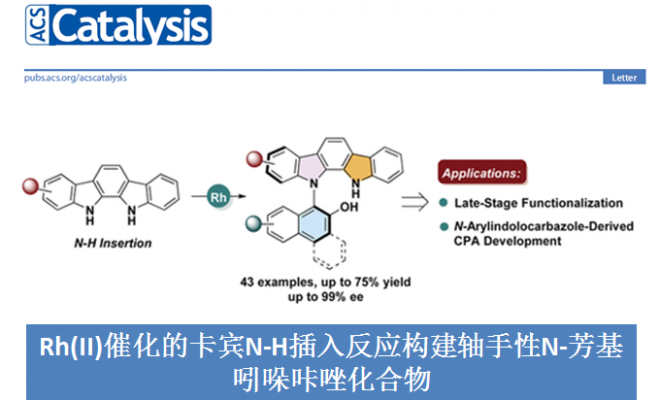
中国医学科学院北京协和医学院王磊团队开发了Rh(II)催化重氮萘醌和吲哚并[2,3-a]咔唑的卡宾N-H插入反应,能以良好的收率和优秀的阻转选择性得到一系列轴手性N-芳基吲哚咔唑化合物。同时,tjipanazole I、N-保护的Arcyriaflavin A以及苯并呋喃咔唑等生物活性分子也能发生卡宾N-H插入反应得到相应轴手性产物。此外,得到的轴手性产物可转化成相应的手性磷酸用于不对称合成。相关研究成果发表于
Qiao Ren, Tingting Cao, Chunnian He, Meihua Yang, Haitao Liu, and Lei Wang*,
ACS Catal. 2021, 11, 6135-6140. DOI: 10.1021/acscatal.1c01232
正文
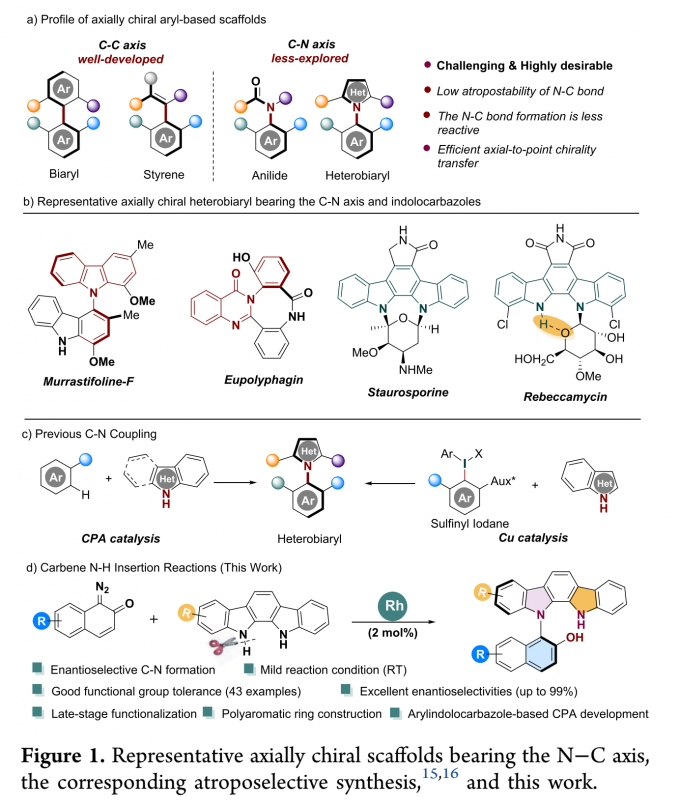
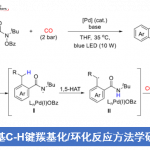
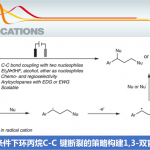
轴手性化合物广泛存在于天然产物和具有药理活性的化合物中,同时,它还可作为手性催化剂和手性配体用于不对称合成中。与研究较成熟的C-C轴手性相比,不对称合成含C-N轴的杂二芳基轴手性化合物的报道相对较少(Figure 1a&1b)。主要是因为(1)偶联反应条件严苛与C-N键的低阻转选择性;(2)竞争性反应中,反应会选择性插入活性更高的C-H键。此外,Ullman和Buchwald-Harwtig 反应因其反应条件温和底物不需预活化等优势成为形成C-N键最重要的反应之一。2012年,Fu和Peter团队实现了光诱导卤代芳基和咔唑的Ullman型C-N自由基偶联反应得到一系列消旋的N-芳基咔唑[1]。随后,Colobert团队成功实现了邻-亚砜碘与吲哚啉的Ullmann型C-N偶联反应合成了一系列轴手性N-芳基二氢吲哚化合物[2]。最近,谭斌团队实现了首例有机催化芳烃C-H键胺化反应构建一系列轴手性N-芳基咔唑化合物[3](Figure 1c)。尽管关于C-N轴手性化合物的合成方法已经有了一些进展,但应用N-H插入策略构建轴手性化合物仍然面临巨大挑战。基于上述研究背景(Nevertheless, the atroposelective synthesis involving the carbene insertion process is still overlooked.),中国医学科学院北京协和医学院王磊团队开发了Rh(II)介导的N-H插入策略构建轴手性N-芳基吲哚咔唑化合物(Figure 1d)。
(图片来源:ACS Catal.)
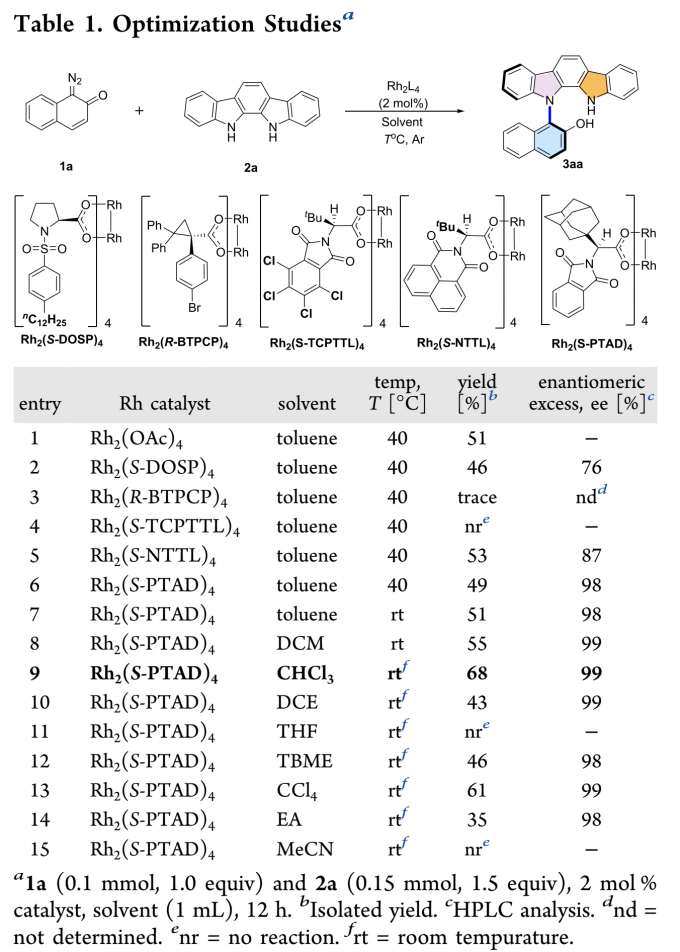
作者以重氮萘醌1a和吲哚并[2,3-a]咔唑2a为模板底物,通过对催化剂、溶剂以及温度等条件进行筛选,确定最优条件(Table 1)为:以2 mol% Rh2(S-PTAD)4为催化剂,CHCl3为溶剂,底物在室温条件下反应12 h,能以68%的收率和99%的对映选择性得到轴手性产物3a。
(图片来源:ACS Catal.)
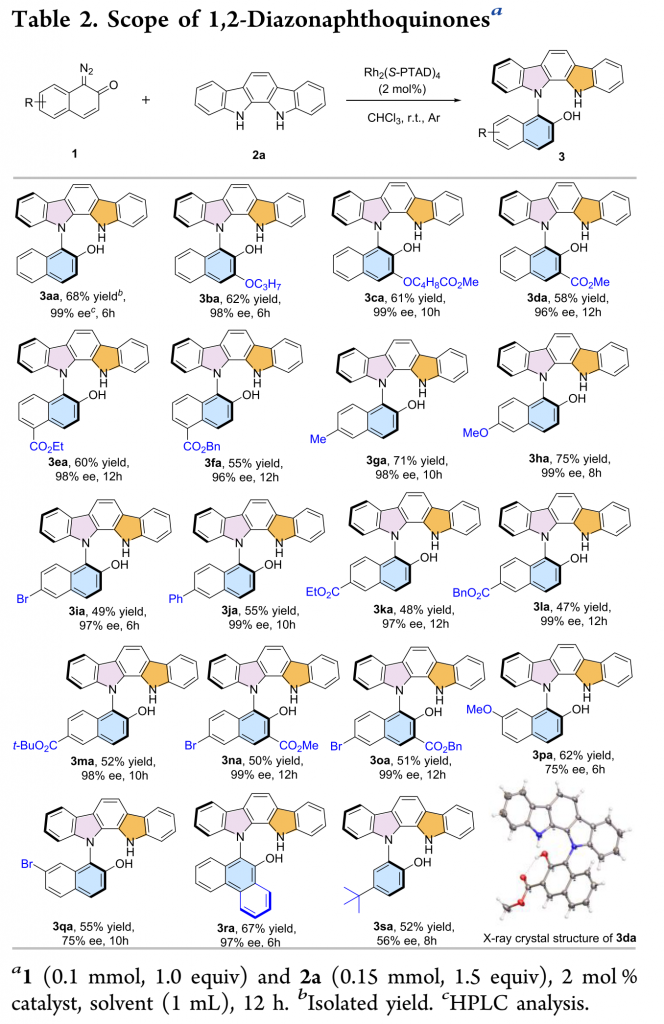
在最优反应条件下,作者对重氮萘醌的底物范围进行了考察(Table 2)。各种C3和C5位取代的重氮萘醌以重氮菲醌均能较好的适应底物范围,能以良好的收率和优秀的对映选择性得到相应产物。但C7位取代的重氮萘醌以及重氮苯醌只能以较低的对映选择性得到相应产物。其中,3da的绝对构型通过单晶确定。
(图片来源:ACS Catal.)
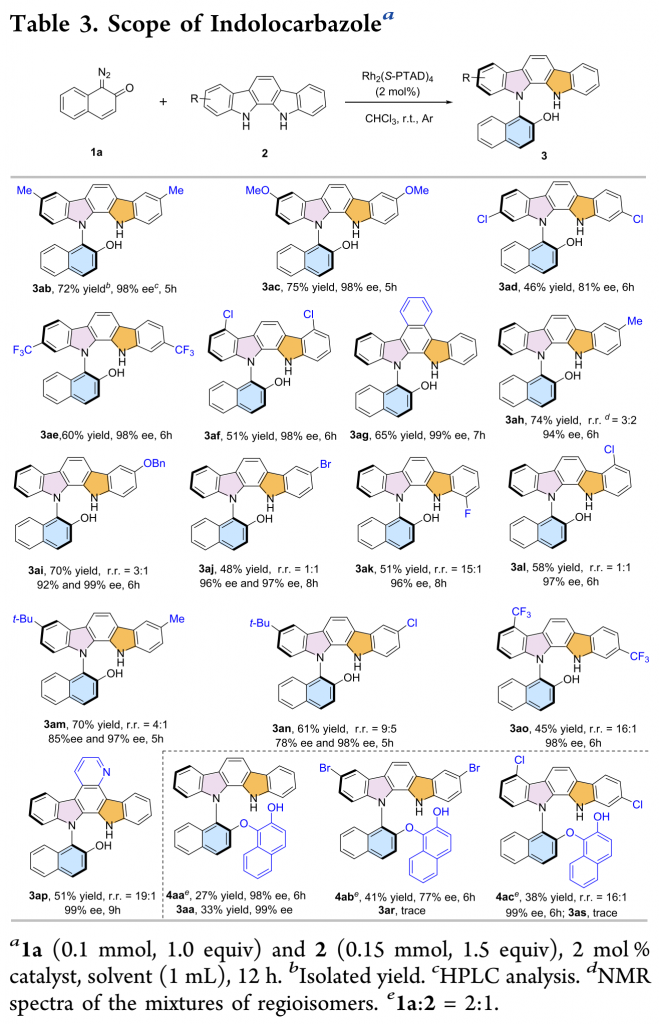
紧接着,作者考察了吲哚咔唑的底物范围(Table 3)。多种吸电子、给电子取代的对称的吲哚咔唑均能较好的适应反应条件,能以良好的收率和优秀的对映选择性得到相应产物。苄氧基、三氟甲基等官能团取代的不对称的吲哚咔唑也能较好的适应反应条件,能以良好的收率和优秀的对映选择性得到相应产物,但产物的非对映选择性较低。
(图片来源:ACS Catal.)
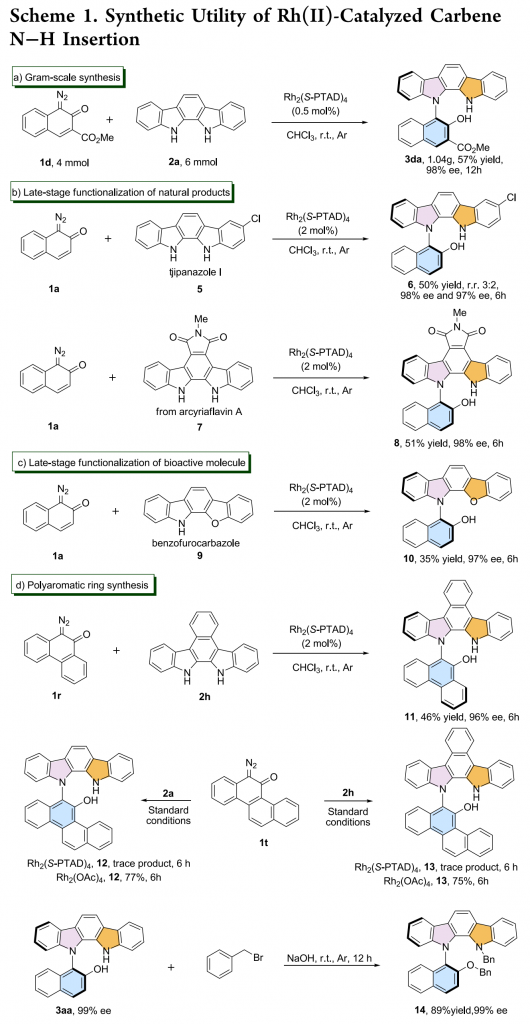
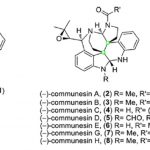
为了证明反应的应用潜力,作者进行了一系列克级反应和衍生反应(Scheme 1)。将1a扩大至4mmol,反应仍能以中等的收率和优秀的对映选择性得到相应产物(Scheme 1a)。此外,抗真菌药tjipanazole I(5)、N-保护的Arcyriaflavin A (7)以及生物活性分子苯并呋喃咔唑(9)也能较好的适应反应条件,能以中等的收率和优秀的对映选择性得到相应产物(Scheme 1b&c)。将3aa溶于CHCl3中并在90℃下反应48小时或室温下反应5个月,3aa的对映选择性均没有降低。标准反应条件下,重氮菲醌1r与苯并吲哚并咔唑2h能以高对映选择性得到轴手性聚芳族N-芳基吲哚并咔唑类化合物11,可用作OLED材料(Scheme 1d),但重氮基庚烯酮1t只能以少量的收率得到相应产物。若将催化剂换成手性Rh2(SPTAD),重氮基庚烯酮的反应能正常进行,并以优秀的收率得到相应的消旋产物。此外,在碱性条件下,3aa能与溴化苄反应生成化合物14。
(图片来源:ACS Catal.)
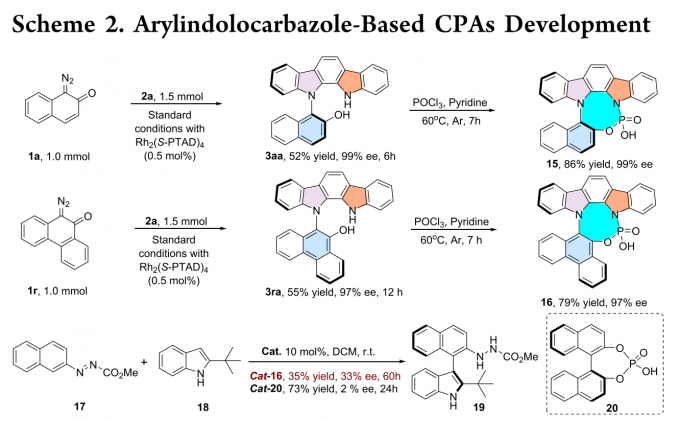
通过简单的反应条件,3aa和3ra可转化为相应的手性磷酸催化剂15和16。将上述催化剂用于偶氮苯衍生物16和2-叔丁基吲哚17的交叉偶联反应中,反应能以适当的收率和对映选择性得到相应产物。
(图片来源:ACS Catal.)
小结:中国医学科学院北京协和医学院王磊团队开发了Rh(II)催化重氮萘醌和吲哚并[2,3-a]咔唑的卡宾N-H插入反应,能以良好的收率和优秀的对映选择性得到一系列轴手性N-芳基吲哚咔唑化合物。同时,tjipanazole I、N-保护的Arcyriaflavin A以及苯并呋喃咔唑等生物活性分子也能发生卡宾N-H插入反应得到相应轴手性产物。此外,得到的轴手性产物可转化成相应的手性磷酸用于不对称合成。
参考文献
- E.Creutz, K. J. Lotito, G. C. Fu, J. C. Peters, Science 2012, 338, 647-651. DOI: 10.1126/science.1226458
- (a) J.Rae, J. Frey, S. Jerhaoui, S. Choppin, J. Wencel-Delord, F. Colobert, ACS Catal. 2018, 8, 2805- DOI: 10.1021/acscatal.7b04343 (b) J. Frey, A. Malekafzali, I. Delso, S. Choppin, F. Colobert, J. Wencel-Delord, Angew. Chem. Int. Ed. 2020, 59, 8844-8848. DOI: 10.1002/anie.201914876
- Xia, Q.-J.An, S.-H. Xiang, S. Li, Y.-B. Wang, B. Tan, Angew. Chem. Int. Ed. 2020, 59, 6775-6779. DOI: 10.1002/anie.202000585













No comments yet.