作者:石油醚
导读:
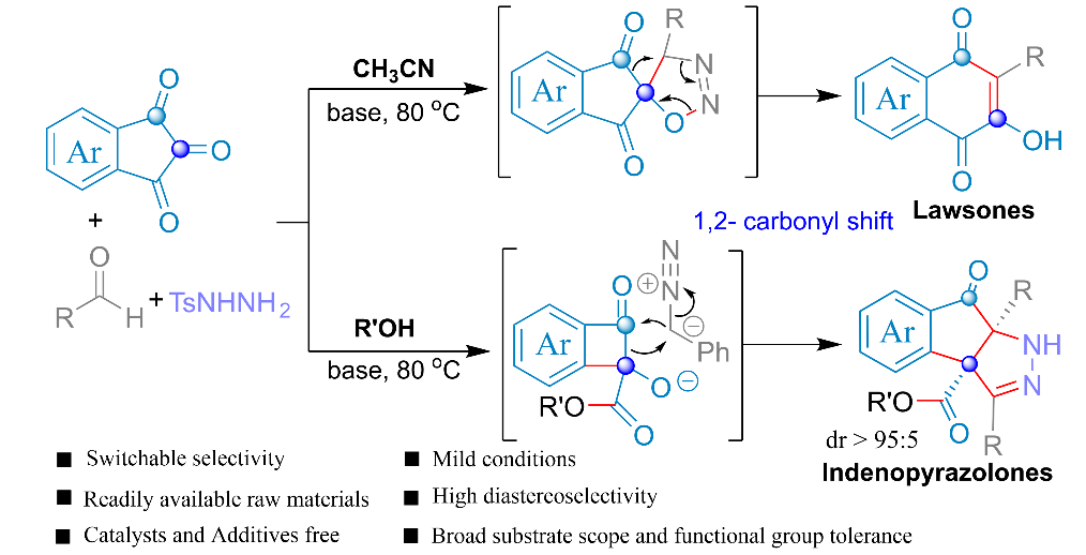
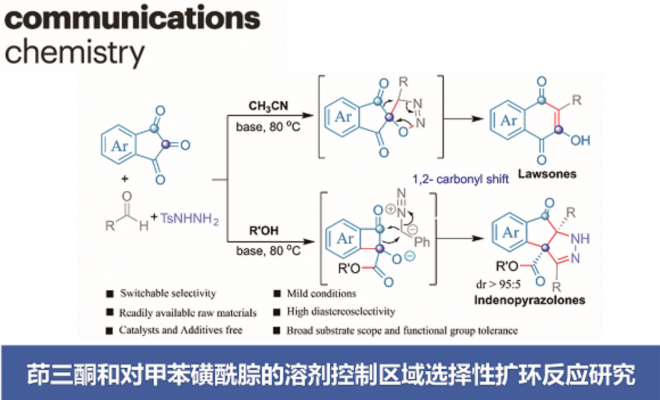
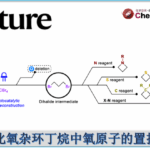
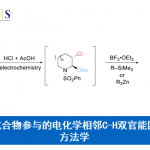
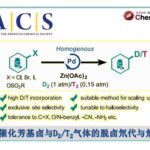
近日,云南大学金毅课题组和湖南科技大学焦银春课题组在Communications Chemistry中发表论文,报道了一种由溶剂控制的茚三酮和对甲苯磺酰腙的区域选择性扩环反应。分别在乙腈溶剂和醇类溶剂中合成了官能化的2-羟基-1,4-萘醌衍生物和茚并吡唑酮衍生物,首次实现了茚三酮的区域选择性1,2-羰基迁移环扩,具有很高的应用价值。
“Switchable synthesis of natural-product-like lawsones and indenopyrazoles through regioselective ring-expansion of indantrione.
Bingwei Hu, Wenxin Yan, Peiyun Jiang, Ling Jiang, Xu Yuan, Jun Lin, Yinchun Jiao* & Yi Jin*
Commun Chem. 2023 6, 17. Doi : 10.1038/s42004-022-00807-z.”
正文:
重氮化合物与醛或酮的同系化反应是最直接、高效延长碳链或扩环的途径之一,常被用于生物活性分子和复杂天然产物合成中[1-4]。苯并环二酮底物的扩环反应已经有了一些报道[5-7]。然而,由于1,2-芳基迁移和1,2-羰基迁移两种反应途径,苯并环二酮与重氮化合物得扩环反应面临区域选择性的难题。据了解,茚三酮的区域选择性环扩张反应尚未见报道。在此,开发了一种茚三酮与α-芳基重氮化合物的区域选择性扩环,涉及1,2-羰基迁移过程。萘醌和茚并吡唑酮衍生物存在于大量天然产物和合成化合物中,表现出多种生物活性,。此外,2-羟基-3-芳基-1,4-萘醌化合物是一类重要的药物分子骨架和分子骨架合成中间体,但其合成具有挑战性[8-11]。本文中,开发了茚三酮与α-芳基-重氮甲烷的无金属扩环反应,重氮化合物由对甲苯磺酰腙原位生成,分别在乙腈和醇溶剂中合成了萘醌衍生物和茚并吡唑酮衍生物。
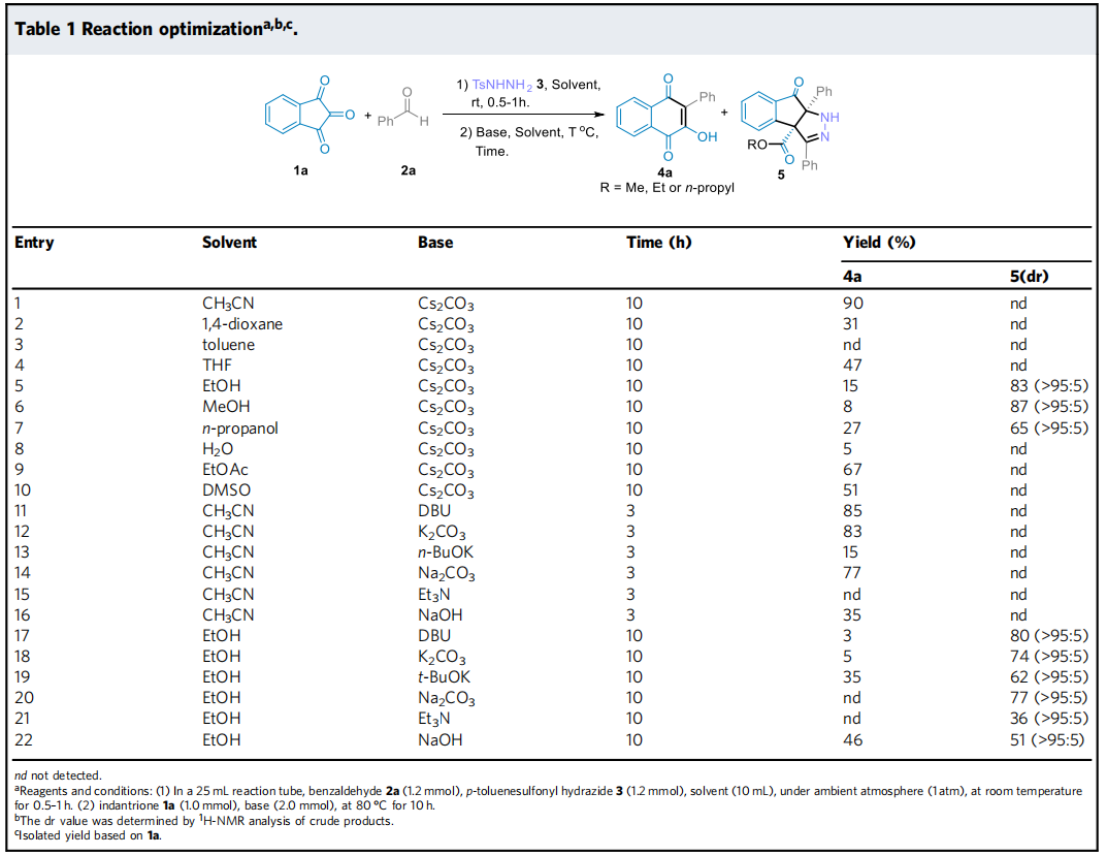
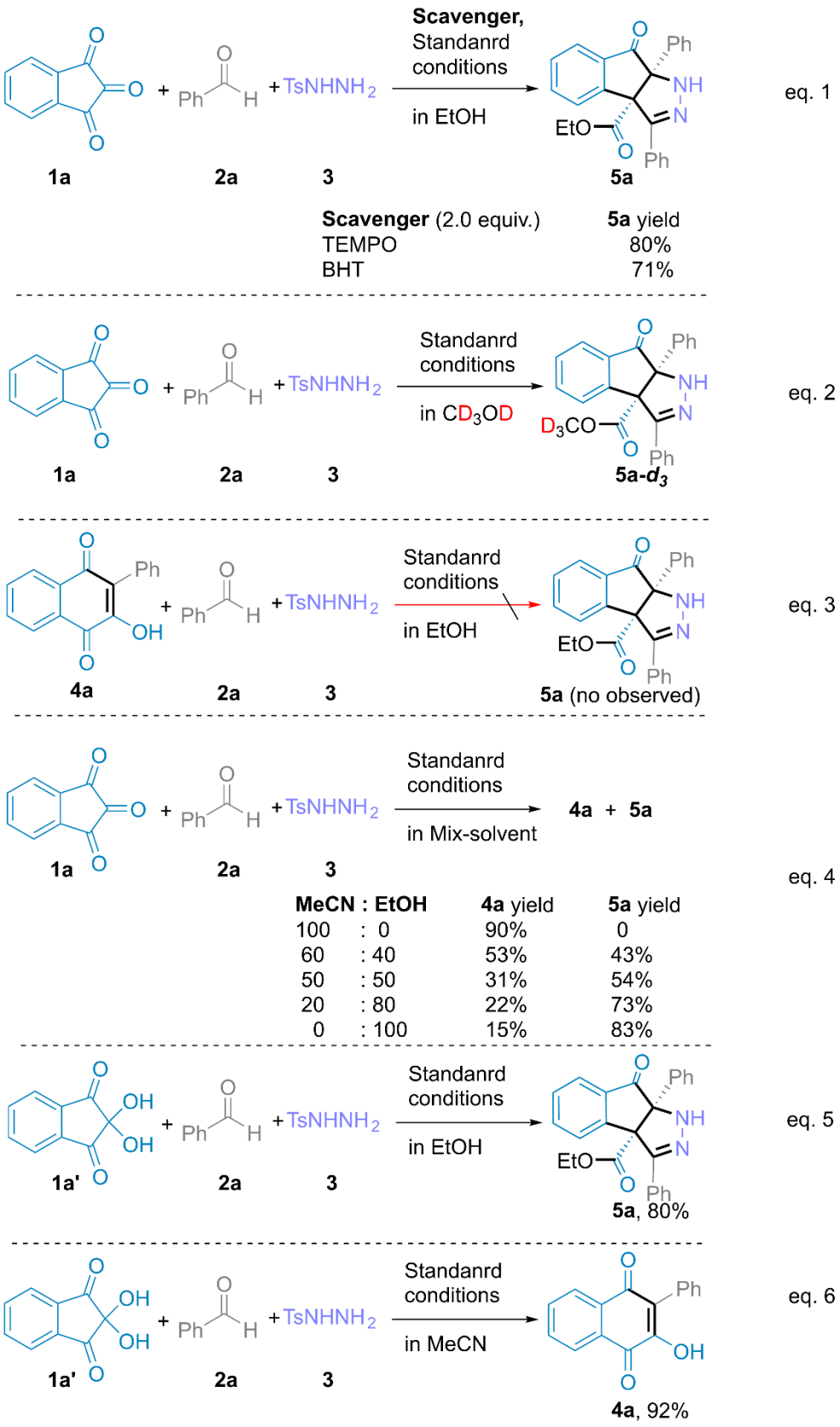
首先,作者采用苯甲醛2a和对甲苯磺酰肼3在乙腈作溶剂的条件下反应,当反应完全后向反应体系中添加茚三酮,通过一系列的条件筛选确定了最优反应条件为:以乙腈作溶剂,添加碳酸铯在80℃下反应3h,以95%产率获得4a。以乙醇、甲醇或正丁醇作溶剂,添加碳酸铯在80℃下反应10h,分别以87%、91%和58%的产率获得相应的茚并吡唑酮衍生物。
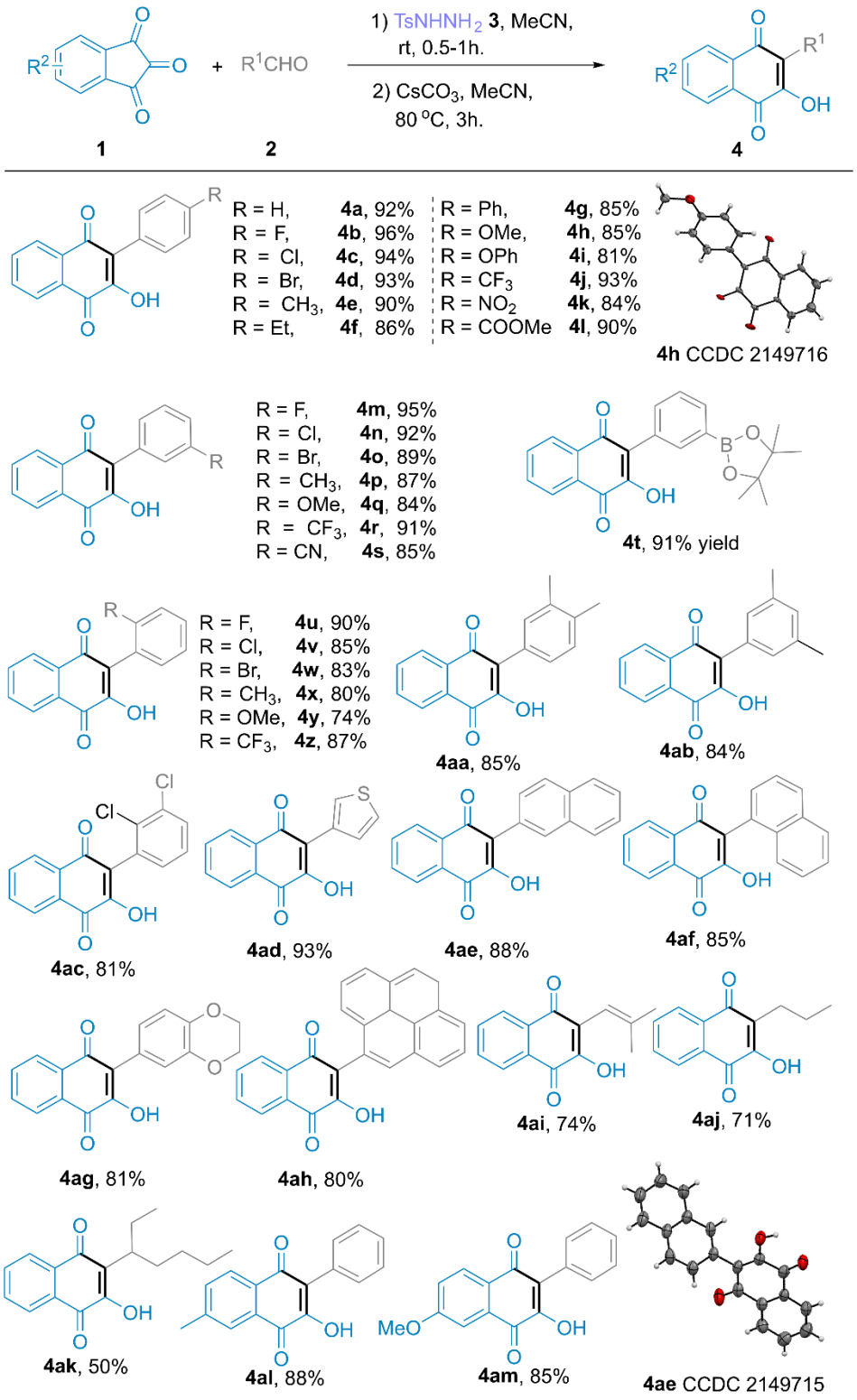
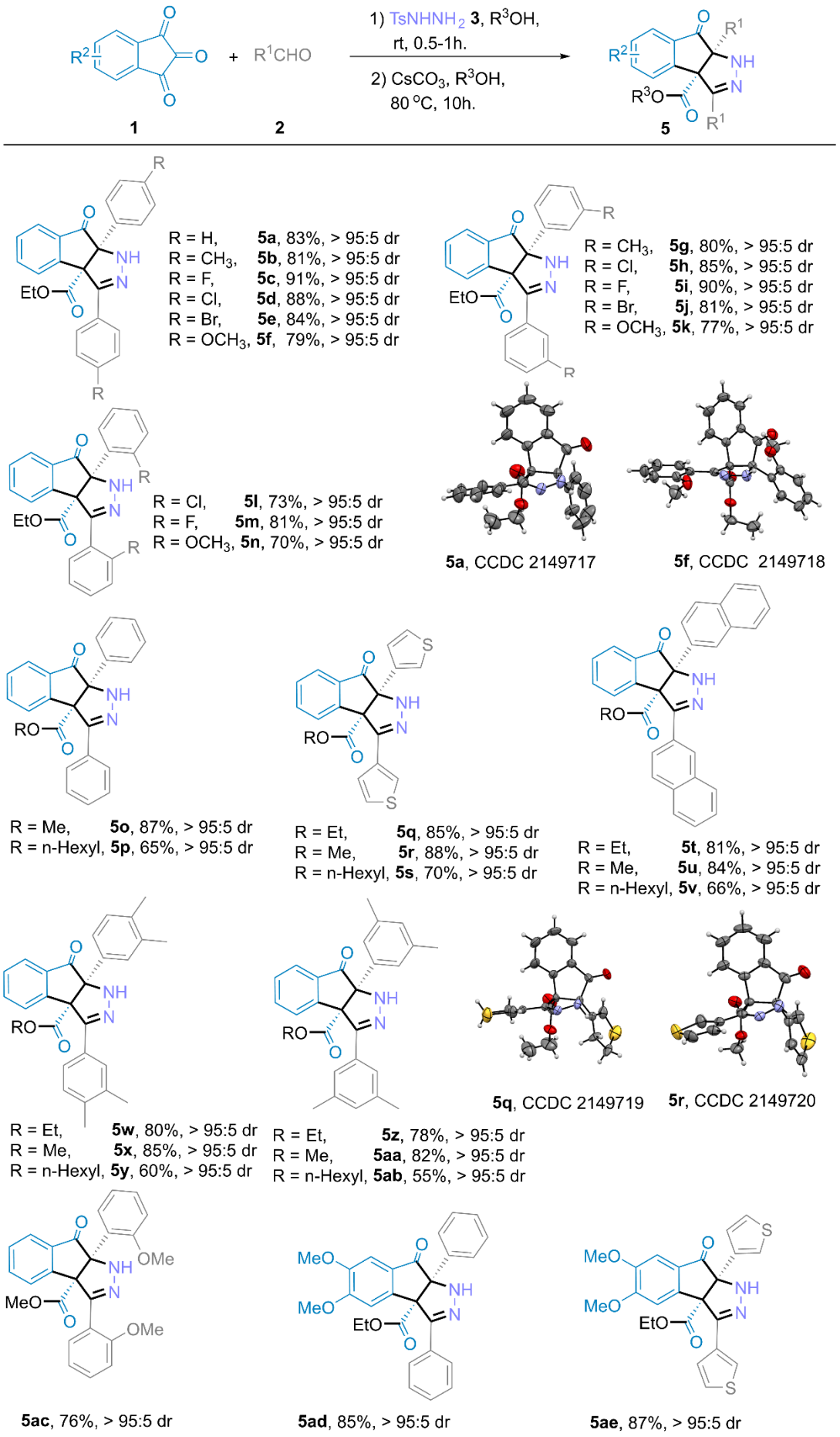
在上述最佳反应条件下,作者分别对萘醌衍生物和茚并吡唑酮衍生物的底物范围进行了深入研究。
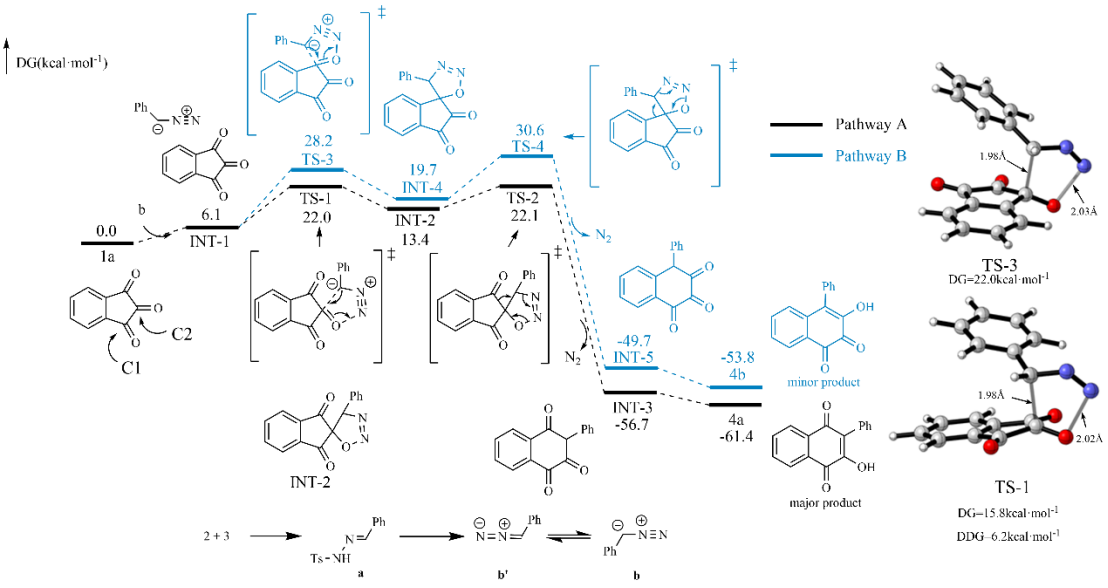
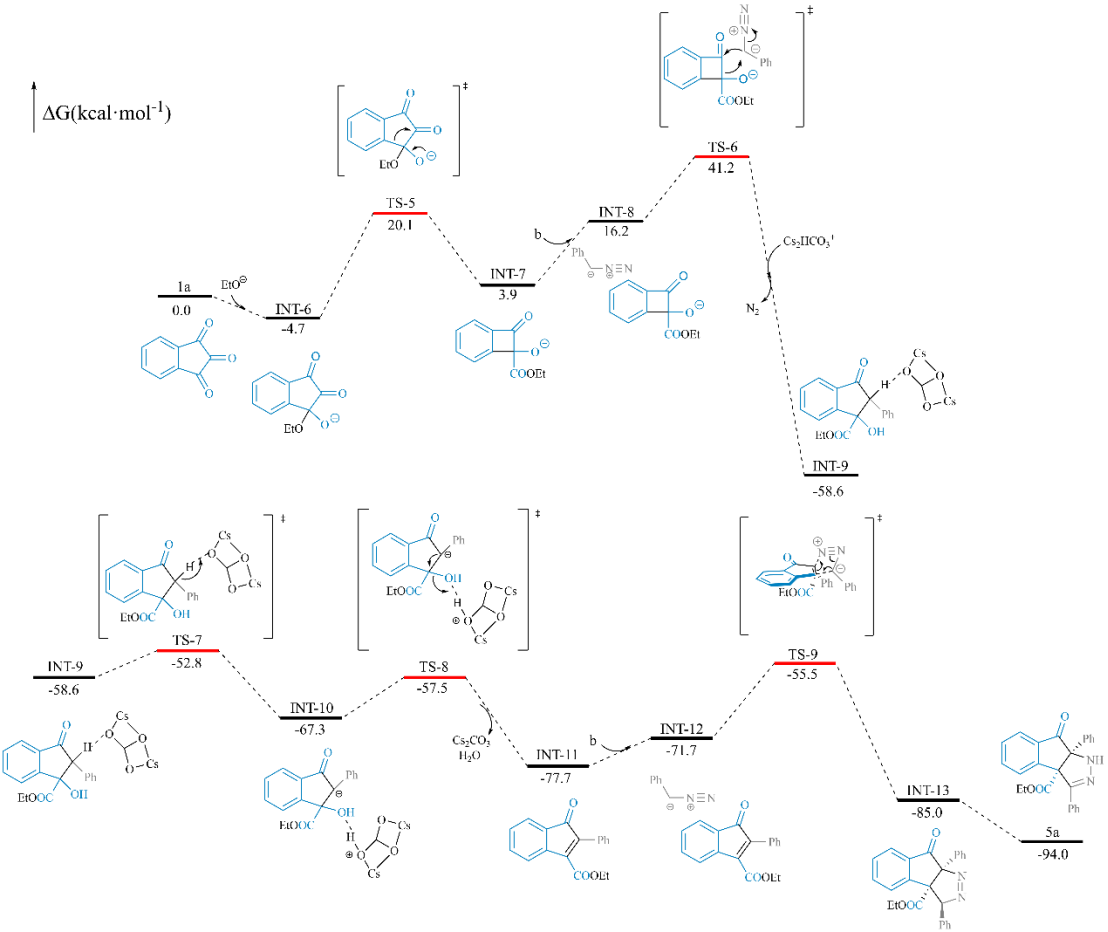
接下来,作者通过一系列控制实验和DFT模拟计算,提出了可能的反应机理。
之后,该合作团队通过一系列的研究进一步表明,该反应具有潜在的合成应用价值。
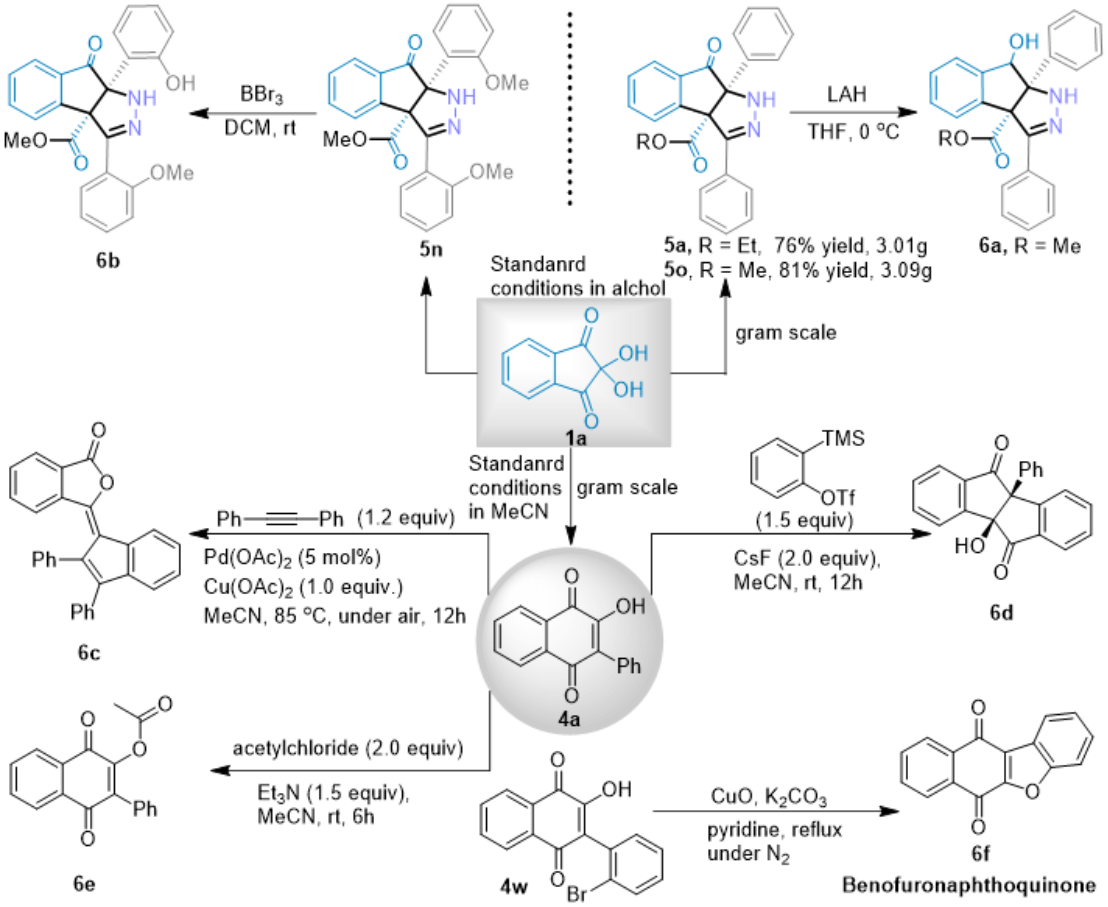
云南大学的金毅课题组成功进行了茚三酮和α-芳基重氮甲烷的首次溶剂控制区域选择性扩环反应。该反应优先提供1,2-羰基迁移产物。在乙腈溶剂中,反应产物为萘醌衍生物。在醇溶液中,反应产物为立体选择性茚并吡唑酮衍生物。具有很好的底物普适性,以高产率(高达95%)和高水平的非对映选择性(高达95:5 dr)提供了高度官能化的萘醌衍生物和茚并吡唑酮衍生物,反应条件温和,官能团耐受性高。该合成应用实例还证明了该方法具有制备有价值化合物的前景。
(金毅教授供稿)
参考文献
- [1] Ford, A. et al. Modern organic synthesis with α-diazocarbonyl compounds. Chem. Rev. 115, 9981–10080 (2015). Doi: 10.1021/acs.chemrev.5b00121
- [2] Ye, T. & McKervey, M. A. Organic synthesis with. alpha.-diazo carbonyl compounds. Chem. Rev. 94, 1091–1160 (1994). Doi: 10.1021/cr00028a010
- [3] Candeias, N. R., Paterna, R. & Gois, P. M. Homologation reaction of ketones with diazo compounds. Chem. Rev. 116, 2937–2981 (2016). Doi: 10.1021/acs.chemrev.5b00381
- [4] Tan, F. et al. Catalytic Asymmetric Homologation of Ketones with α-Alkyl α- Diazo Esters. J. Am. Chem. Soc. 143, 2394–2402 (2021). Doi: 10.1021/jacs.0c12683
- [5] Rendina, V. L., Moebius, D. C. & Kingsbury, J. S. An enantioselective synthesis of 2-aryl cycloalkanones by Sc-catalyzed carbon insertion. Org. lett. 13, 2004–2007 (2011). Doi: 10.1021/ol200402m
- [6] Hashimoto, T., Naganawa, Y. & Maruoka, K. Desymmetrizing asymmetric ring expansion of cyclohexanones with α-diazoacetates catalyzed by chiral aluminum Lewis acid. J. Am. Chem. Soc. 133, 8834–8837 (2017). Doi: 10.1021/ja202070j
- [7] Li, W. et al. A catalytic asymmetric ring-expansion reaction of isatins and α- alkyl-α-diazoesters: highly efficient synthesis of functionalized 2‐quinolone derivatives. Angew. Chem. Int. Ed. 124, 8772–8775 (2012). Doi: 10.1002/ange.201204594
- [8] Sadeghpour, M., Olyaei, A. & Adl, A. Recent progress on the synthesis of henna-based dibenzoxanthenes. N. J. Chem. 45, 13669–13691 (2021). Doi: 10.1039/D1NJ02475B
- [9] Rueping, M., Sugiono, E. & Merino, E. Asymmetric iminium ion catalysis: an efficient enantioselective synthesis of pyranonaphthoquinones and β- lapachones. Angew. Chem. Int. Ed. 47, 3046–3049 (2008). Doi: 10.1002/anie.200705110
- [10] Ramachary, D. B., Anif Pasha, M. & Thirupathi, G. Organocatalytic asymmetric formal [3+2] cycloaddition as a versatile platform to access methanobenzo [7] annulenes. Angew. Chem. Int. Ed. 56, 12930–12934 (2017). Doi: 10.1002/anie.201706557
- [11] Kaya, U. et al. Enantioselective synthesis of 4 H-pyranonaphthoquinones via sequential squaramide and silver catalysis. Chem. Commun. 52, 1669–1672 (2016). Doi: 10.1039/C5CC09592A
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载

















No comments yet.