本文作者:竹悠
导言
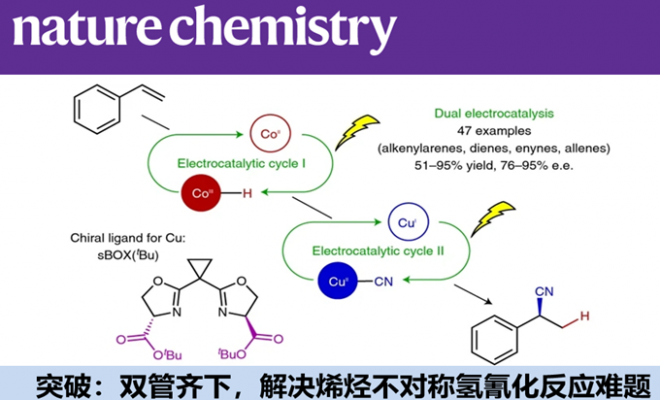
手性腈及衍生物广泛存在于药物及有生物活性的化合物中。立体选择的烯烃氢氰化反应虽是合成这类化合物的常规和有效方式,然而这些方法普遍可以广泛应用、高度兼容官能团方法。为了解决这个长期存在的难题,作者利用电化学组合两个阳离子自由基,将钴介导的氢原子转移和铜催化的自由基氰化反应结合,实现了烯烃高度选择性的氢氰化反应。电化学既不不需要化学计量的氧化剂,还可以精准控制电压,以优化化学选择性。并且DFT分析发现,手性催化剂的吸引和排斥作用,决定了C-CN键生成时的立体选择性。
正文
烯烃的氢氰化反应可以引氰基,这个过程在生产聚合物、农用化学品、化妆品、药物中都有重要的实用价值,因此开发具有广泛的底物范围,精准的化学选择性和立体选择性的烯烃的氢氰化反应具有十分重要意义。
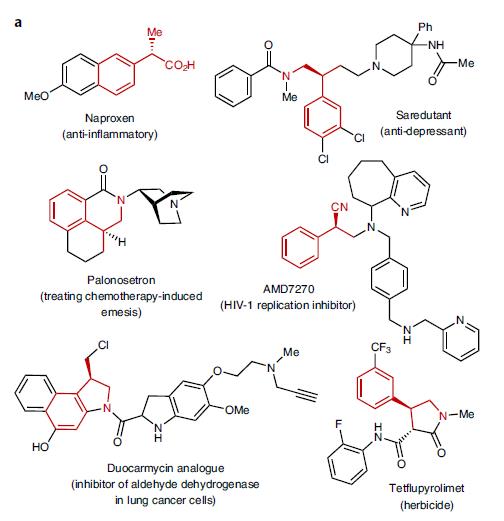
图1a. 医药和农业化学品中的芳香基丙腈衍生物
极化的π键,如C=O、C=N键的氢氰化反应再早期就已经有了详尽的研究,但C=C双键的氢氰化反应案例很少,在早期合成naproxen的案例中,曾用过渡态金属Ni催化。但是到目前为止,能达到既有底物范围广阔,又可以实现高度立体选择性的反应还是凤毛麟角。
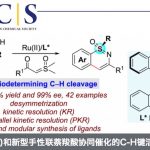
电化学合成的研究在近几年异军突起。电化学过程中产生自由基,催化剂控制自由基加成到烯烃上,可用于烯烃的双官能团化反应。最近Cornell University的Song Lin教授等采用了Co/Cu双电催化,立体选择性进行烯烃的氢氰化反应,论文发表在顶级期刊Nature Chemistry上。
Lu Song, Niankai Fu, Brian G. Ernst, Wai Hang Lee , Michael O. Frederick
Robert A. DiStasio Jr. Song Lin.
Dual electrocatalysis enables enantioselective hydrocyanation of conjugated alkenes
Nature Chemistry. 2020, ASAP, https://doi.org/10.1038/s41557-020-0469-5
反应设计和开发
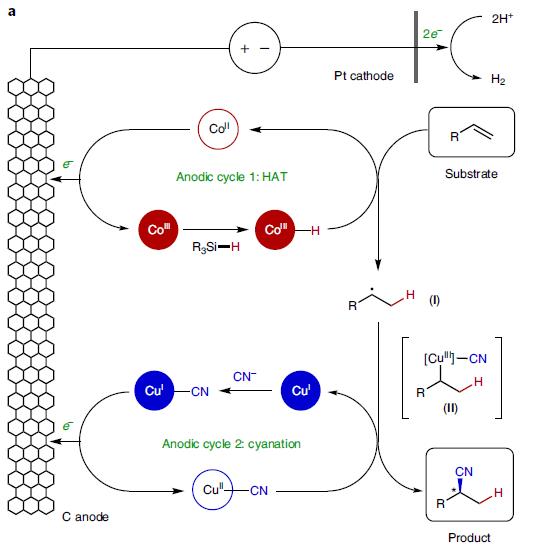
为达成这两个标准,作者需要平行产生H和 CN自由基或其等价物,因此考虑将两个金属介导的自由基反应和阳极耦合的电催化结合起来,如图2a所示。
图2a. 双电催化的烯烃的氢氰化反应
在催化循环中,CoⅢ前体和硅烷反应生成[CoⅢ]–H,然后通过氢原子转移hydrogen-atom transfer (HAT)生成自由基Ⅰ。这个中间体然后参与到氰基化循环中,经历单电子氧化加成,生成[CuⅡ]–CN中间体Ⅱ,铜中间体接着发生还原消除,生成氢氰化产物。这个反应设计,涉及了金属催化自由基反应的两个重要课题:
1、烯烃上的金属氢化物氢原子转移(MHAT),如TsCN作为氰基来源,钴催化的烯烃氢氰化反应。
2、铜催化的立体选择性自由基氰化反应。
所需的氢氰化反应是整体氧化转化,这需要通过一对单电子氧化事件使两种催化剂进行转换,以使生成的CoII和CuI物种返回到其反应性CoIII和CuII氧化态(图2a)。因此,成功实现该反应的关键在于找到可以容纳两个反应的氧化条件。一方面,钴催化的氢官能团化反应可以解决苯乙烯类底物化学选择性的问题,在氧化剂存在下,生成的苄基自由基氧化为苄基阳离子。另一方面,铜催化的氰基化反应,需要强效的氧化剂,这可能限制反应底物的范围,特别是对氧化剂敏感的官能团。而电化学可以精准调节最小电压,满足氧化剂的催化循环。
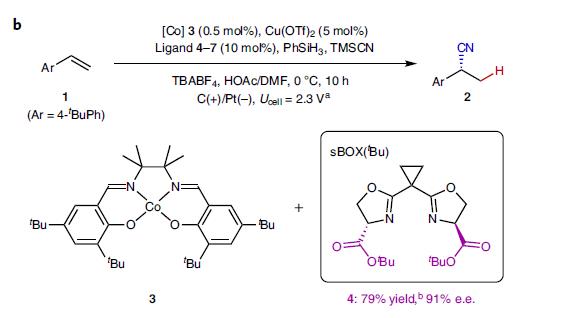
作者首先评价一系列钴和铜催化剂,因铜离子可能在阴极还原失去催化能力。筛选反应条件后,作者发现以Co(salen)络合物3 (0.5 mol%)和Cu(OTf)2 (5 mol%) 为催化剂,使用恶唑啉(BOX)型配体,PhSiH3和TMSCN作为氢自由基和氰基自由基的来源, 能以较好的收率和中等选择性得到产物。
循环伏安法研究证明,BOX配体和CN–是保证Cu催化剂在溶剂中活性的关键,以生成[Cu(BOX)(CN)n]型络合物,避免电解过程中在阴极的降解。同时,铂作为阴极材料,醋酸作为氧化剂可以保证质子还原在较低的过电势。
在配体优化中,常见的配体并没有太好的表现,最高72% e.e.,但基于丝氨酸的双恶唑啉配体sBOXs效果最好,如配体4的选择性大幅提高至91% e.e。
图2b. 优化后的反应条件
在对照实验中,溶剂乙腈代替DMF、电解质LiClO4代替TBABF4、电解液乙醇代替醋酸,都没有更好的结果。钴的用量从0.5 mol%提高至2 mol%时,收率下降,同时生产副产物,说明HAT和氰基化反应的平衡很重要,并且需要Cu和Co协同作用。
反应范围和应用
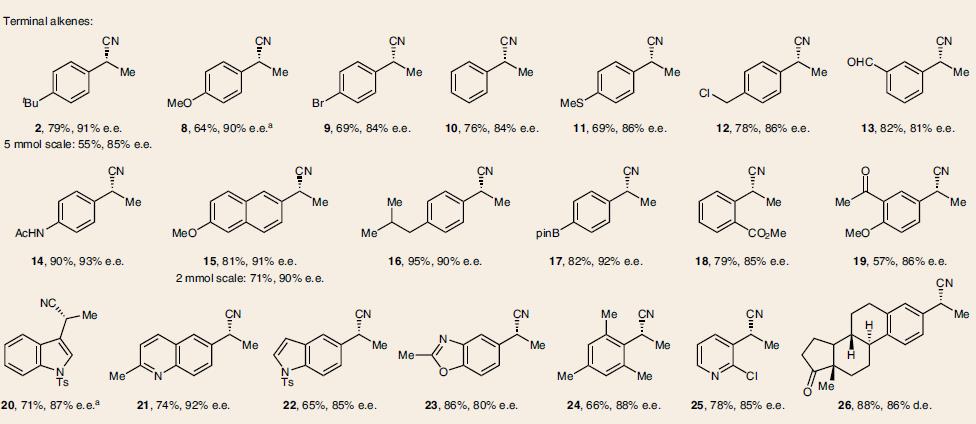
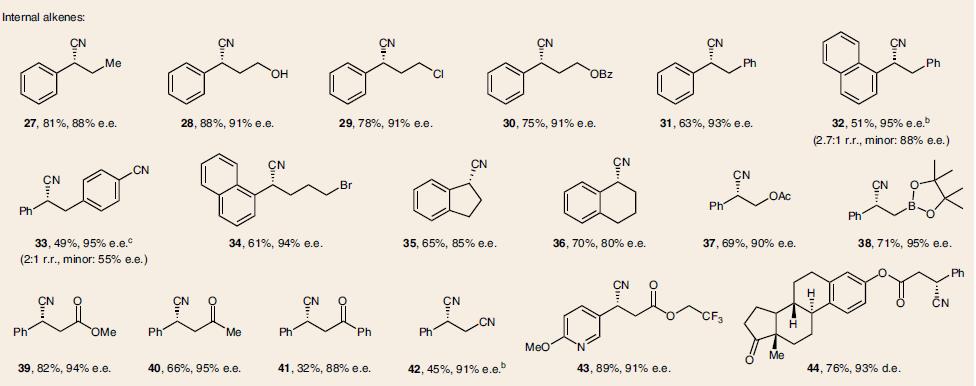
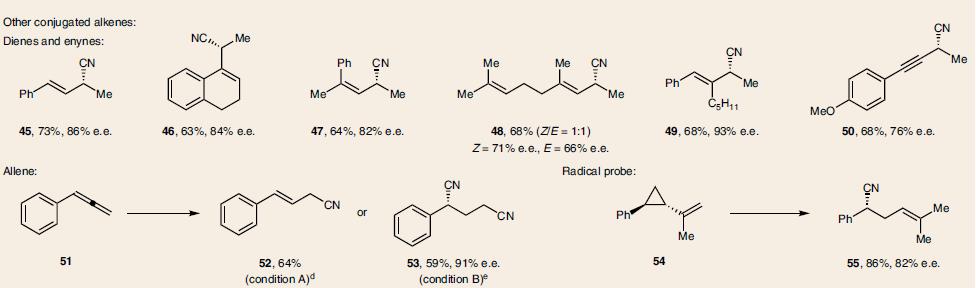
在最优化反应条件下,一系列芳基乙烯类底物都可以进行氢氰化反应,并且具有优秀的立体选择性,兼容多种官能团。如易氧化的基团含电子的烯烃(8)、(15, 20)、硫醚(11),易于偶联的苄氯(12)、芳基卤化物(9, 25)和芳基硼酸酯(17)。以及杂环烯烃(20–23,25)和含氮杂环(43)。因烯烃的E和Z不影响立体选择性,可以用混合物,如富电子的(37),缺电子的(39–44)。此外还有基于肉桂基的(酯39, 43, 44), 酮(40, 41)和腈(42),选择性的在端基双键反应的二烯烃(45–49),以及炔烃(50)、联烯(51)、环丙烷衍生物(54),如表1所示。
表 1. 反应底物的范围
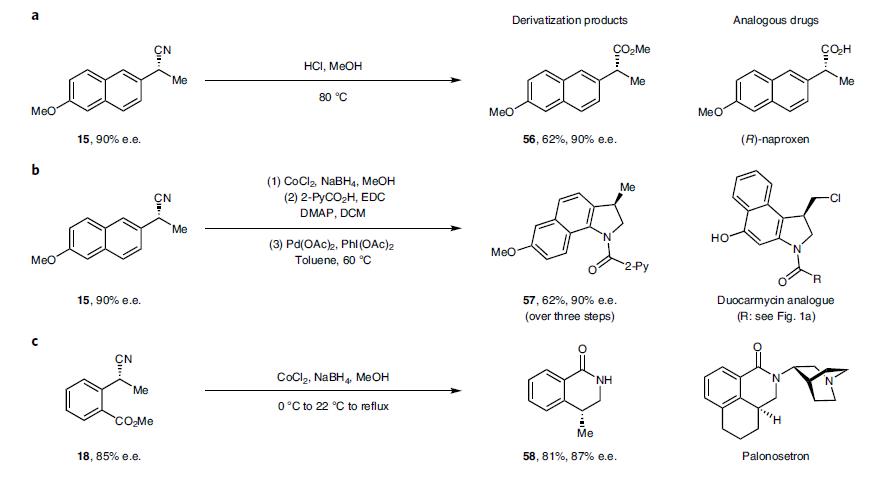
产物腈可以继续衍生为其它官能团,如产物15转化为甲酯56,苯并吲哚啉57,产物18经还原和环合反应生成二氢异喹啉酮58,见图3。
图3. 产物的衍生化反应.
电化学控制反应
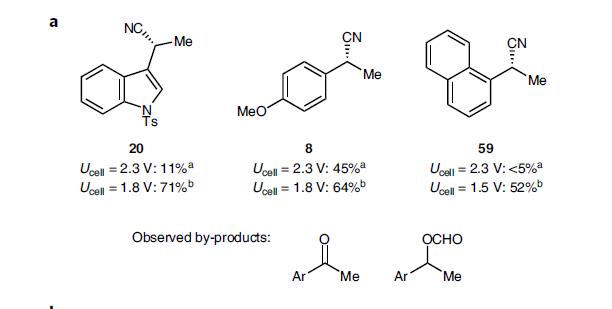
电化学最大的优势可以通过控制输入电压来改变产物,如2.3 V时虽然烯烃的转化率非常高,但产物20很少,降为1.8 V就可以压制副产物,20的收率提高至71%,如4a所示。
图4a. 不同电压下的产物收率.
电化学可以精准控制电压稍满足反应需求,常规氧化剂与电氧化相比,产物2的收率 (9–24%)和选择性(40–68% e.e.)都很差,见图4b。
图4b. 电化学和化学氧化剂的比较
立体选择性控制
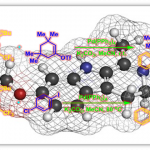
在这个反应中,铜催化剂在sBOX配体的作用下,还原消除生成C-CN键,是立体选择性的关键。在过渡态中,配体上的酯衍生物可能提供了吸引力,如酯上α酸性氢的与底物上的芳香环产生C-H-π键作用,而配体上体积较大的叔丁基产生较大的立体排除力,这种吸引、排斥相互作用决定了立体选择性。密度泛函理论(DFT)计算也证实了这点,如图5所示,TSR中距离更大些。
图5. 立体选择性的计算模型, TSR为优势构象.
总结
作者利用电催化可以精准控制电压进行氧化的优点,将钴催化的氢转移和铜催化的氰基化反应结合起来,实现了烯烃的立体选择性氢氰化反应,不仅底物范围广泛,而且具有优秀的立体选择性,具有很高的实用价值。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.