本次介绍的论文报道了含有硅烷–N–杂环的多环式化合物的新奇构建法。该方法可以在不使用过渡金属催化剂的情况下合成多环化合物,预期其可以用于合成一些复杂生物碱的等价衍生物。
含硅的N-杂环构建方法
在药物和农药相关的化学中,硅交联的杂化合物可以用作生物活性分子中的碳的等价体活用[1]。特别是、N–杂环化合物在药效团与生物碱的骨架中频繁出现,而含硅的N–杂环化合物作为它们的生物等价体受到关注[2]。因此,迄今为止也有很多硅–N–杂环化合物的合成方法被不断开发。
最近的实例包括使用钌催化剂的分子内硅-N-杂环合成法[3]和使用锰催化剂的硅-N-杂环的氧化自由基合成法(图1A)[4]。在这些硅-N-杂环的构建法中,几乎都必须使用过渡金属催化剂。
这次,Chang教授等人开发了一种新方法,可以在不使用过渡金属催化剂的情况下合成含有硅-N-杂环的多环化合物。在该方法中,通过两次脱氢反应连续形成(sp3)C–Si键和(sp2)C–Si键(图1B)。
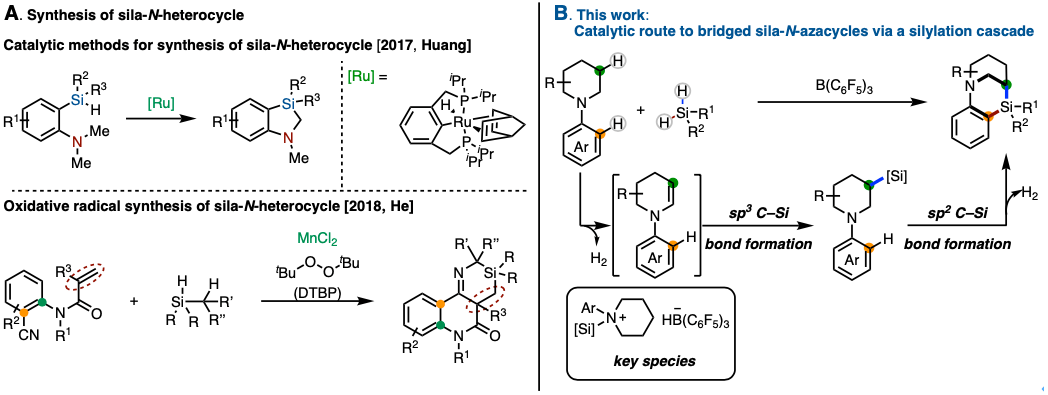
图1. (A) 以往的硅-N-杂环合成法, (B) 多环式硅-N-杂环合成
“Catalytic Access to from Piperidines via Cascade sp3and sp2C–Si Bond Formation”
Zhang, J.; Park, S.; Chang, S. J. Am. Chem. Soc, 2018,140, 13209.
DOI: 10.1021/jacs.8b08733
论文作者介绍

研究者:Sukbok Chang
经历:
1985 B.S.Chemistry, Korea University
1987 M.S. Organic Chemistry, KAIST (Prof. Sunggak Kim)
1996 Ph.D. Organic Chemistry, Harvard University (Prof. Eric. N. Jacobsen)
1996-1998 Posdoc, Caltech (Prof. Robert H. Grubbs)
1998-2002 Assistant Professor, Ewha Womans University
2002-present Professor, KAIST
2008-2011 Chair, Department of Chemistry, KAIST
2012-present Director, Center for Catalytic Hydrocarbon Functionalizations, Institute for Basic Science (IBS)
2018-present Appointed as a Distinguished Professor at KAIST
研究内容:C–H活化、甲烷的直接官能化、催化位置选择性脱官能团化

研究者:Sehoon Park
经历:
2008 Ph.D. Tokyo Institute of Technology (Prof. Kohtaro Osakada & Prof. Daisuke Takeuci)
2012 Posdoc, University of North Carolina at Chapel Hill
2016-present Adjunct Professor, University of Science and Technology
研究内容:使用硼催化剂的反应方法学开发
论文概要
本反应以氯苯为溶剂,在氧化钙与B(C6F5)3催化剂存在下、通过N-芳基哌啶1、与甲基苯基硅烷作用、高产率得到了硅–N–杂环2。B(C6F5)3催化剂分两次添加,发现可以显著提高收率。该反应对芳基部分和哌啶部分上的取代基的兼容性很好(图2A)。
当芳基部位含有非对称的取代基(1b)的情况时、两个异构体产物2b与2b’基本产率相同。非对映选择性尽管取决于底物,但是选择性中等。
作者试图通过讨论反应时间,温度和氘标记实验来阐明反应机理。推定的机理为:(1)先产生N-甲硅烷基哌啶硼氢化物A (2)通过可逆反应形成亚胺盐B (3)烯胺中间体C的形成 (4)通过C的β-选择性氢化硅烷化合成哌啶E (5)通过Wheland复合物形成分子内(sp2)C–Si键转变成硅-N–杂环F(图2B)。
虽然最近也报道了使用B(C6F5)3催化剂催化的杂芳环的氢化硅烷化反应[5]和吲哚的直接甲硅烷化反应[6]。但是,这次用将该催化剂应用在完全不同的硅-N-杂多环化合物的合成中,非常有趣。
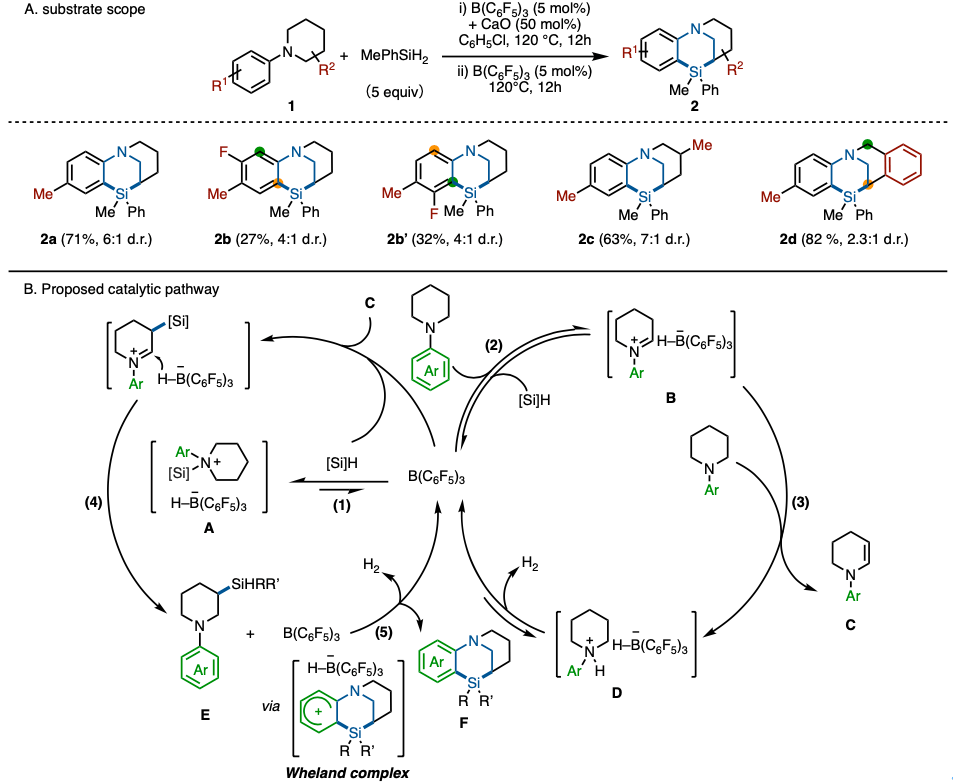
图2. (A) 底物适用范围 (B) 推定的反应机理
参考文献
- (a) Franz, A. K.; Wilson, S. O. J. Med. Chem. 2013, 56,388. DOI: 10.1021/jacs.8b08733(b) Sieburth, S. M.; Nittoli, T.; Mutahi, A. M.; Guo, L. Angew. Chem., Int. Ed. 1998, 37, 812. DOI: 10.1002/(SICI)1521-3773(19980403)37:6<812::AID-ANIE812>3.0.CO;2-I
- (a)Johansson, T.; Weidolf, L.; Popp, F.; Tacke, R.; Jurva, U. Drug Metab. Dispos. 2010, 38, 73. DOI: 1124/dmd.109.028449(b)Wang, J.; Ma, C.; Wu, Y.; Lamb, R. A.; Pinto, L. H.; DeGrado, W. F.J. Am. Chem. Soc. 2011, 133, 13844.DOI: 10.1021/ja2050666
- Fang, H.; Hou, W; Liu, G.; Huang, Z, J. Am. Chem. Soc.2017, 139, 11601. DOI: 10.1021/jacs.7b06798
- Wu, L.; Yang, Y.; Song, R.; Yu, J.; Li, J.; He, D. Chem Commun. 2018, 54, 1367.DOI: 10.1039/c7cc08996a
- (a) Gandhamsetty, N.; Joung, S.; Park, S.-W.; Park, S.; Chang, S. J, Am. Chem. Soc. 2014, 136, 16780.DOI: 10.1021/ja510674u (b)Gandhamsetty, N.; Park, S.; Chang, S. J. Am. Chem. Soc. 2015, 137, 15176. DOI: 10.1021/jacs.5b09209
- Han, Y.; Zhang, S.; He, J.; Zhang, Y. J. Am. Chem. Soc.2017, 139, 7399. DOI: 10.1021/jacs.7b03534
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.