本文作者:杉杉
导读
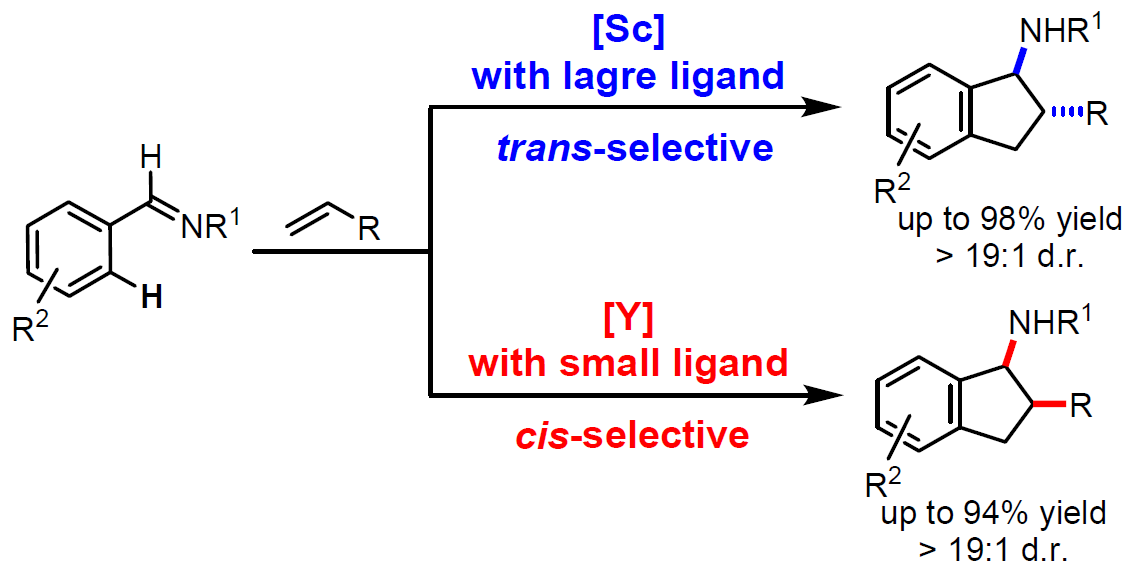
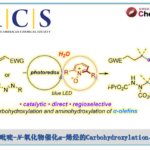
立体发散催化(Stereodivergent catalysis)在不对称合成中具有重要的作用,由于它可以有效地实现产物中所有立体异构体的可能性。近日,日本理化所侯召民团队在美国化学学会杂志(J. Am. Chem. Soc.)发表论文,报告了通过单茂稀土催化剂经C-H活化实现芳基亚胺与烯烃的第一个非对映[3+2]环化反应。该方案为从同一组醛亚胺和烯烃中选择性合成多取代的1-氨基茚衍生物(反式和顺式非对映异构体),作为一种高效且通用的途径,具有100%的原子经济性、出色的非对映选择性、广泛的底物范围、良好的官能团耐受性等优点。
Diastereodivergent [3+2] Annulation of Aromatic Aldimines with Alkenes via C-H Activation by Half-Sandwich Rare-Earth Catalysts
Xuefeng Cong, Gu Zhan, Zhenbo Mo, Masayoshi Nishiura, ZhaominHou
J. Am. Chem. Soc. ASAP DOI: 10.1021/jacs.0c01171
正文
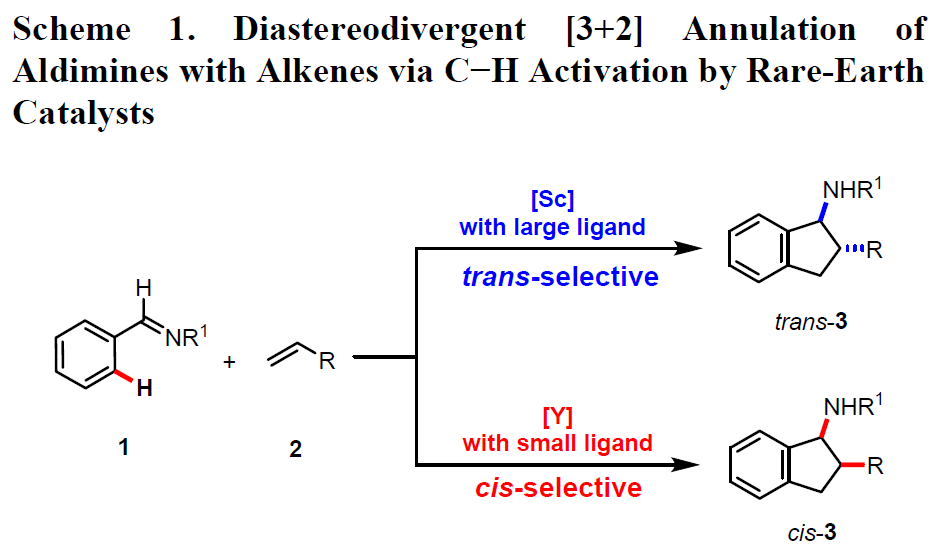
氨基茚满衍生物(Aminoindanes)在生化和药理研究方面具有重要的作用,尤其是含有连续立体中心的多取代1-氨基茚满衍生物,作为许多生物活性分子和药物中的重要成分,同时绝对和相对构型对于表达生物活性至关重要。因此,开发一种高效且具有选择性,能够获得1-氨基茚满化合物的所有可能的非对映异构体的方法至关重要。芳香亚胺与烯烃的催化串联[3+2]环化反应是合成多取代的1-氨基茚满最为有效的途径之一,涉及将烯烃插入到亚胺底物中芳族取代基的邻位C-H键中,然后在亚胺基上进行分子内加成(环化)。显然,该策略作为从同一组亚胺和烯烃原料中有效合成非对体的1-氨基茚满产物的理想途径。然而,通过催化剂控制1-氨基茚满化合物非对映体(顺和反式)的合成尚未报道。
本课题组近期发现,单茂稀土烷基络合物可以作为各种化学转化的有效催化剂,如烯烃的C-H加成、极性和非极性烯烃的共聚、环丙烯与氨基烯烃的不对称碳氨化/环化等。受这些文献的启发,作者开始探索通过稀土催化剂实现芳基亚胺与烯烃的环化反应。在此,日本理化所侯召民团队首次提出,通过不同空间位阻的单茂稀土催化剂,可对芳基亚胺与烯烃的进行选择性的非对映 [3+2]环化反应,从而获得顺/反两种构型的氨基茚满衍生物(Scheme 1)。当使用带有C5Me4SiMe3配体的单茂钪催化剂时,可选择性地生成1-氨基茚满的反式-非对映异构体,而使用带有较小C5Me4H配体的单茂钇催化剂时,可获得顺式-非对映异构体。该方案从同一组醛亚胺和烯烃起始原料中,选择性合成1-氨基茚满衍生物的反式和顺式非对映异构体,作为一种高效的途径。
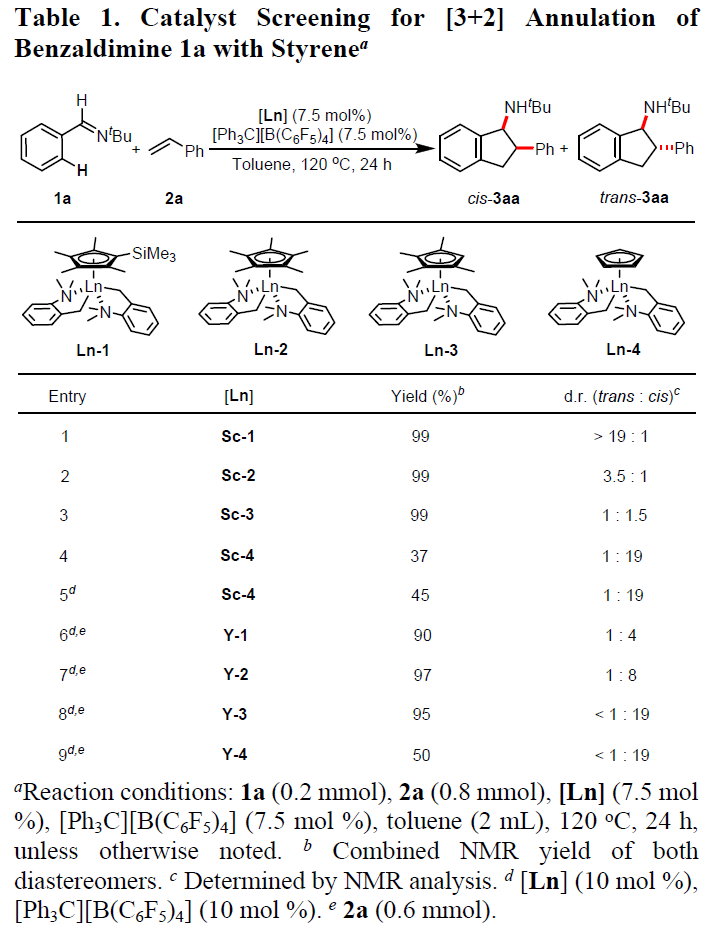
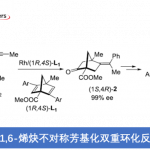
首先,作者以N-叔丁基苯甲二胺1a与苯乙烯2a作为模型底物,筛选了一系列带有不同Cp配体的单茂钪和单茂钇催化剂(Table 1)。当以[Ph3C] [B(C6F5)4]作为助催化剂的情况下,使用含有C5Me4SiMe3的单茂钪络合物Sc-1时,在120℃下表现出高活性和立体选择性,从而获得[3+2]环化产物3aa(d.r. > 19:1)(entry 1)。当使用空间要求较低的C5Me5连接的单茂钪络合物Sc-2时,非对映选择性显着降低,得到trans-3aa和cis-3aa的混合物(d.r. = 3.5:1)(entry 2)。有趣的是,使用另一种较小的C5Me4H连接的络合物Sc-3可以逆转非对映选择性,尽管选择性低(trans-3aa/cis-3aa = 1:1.5),却得到了富含顺式的非对映异构体混合物(entry 3)。因此,作者使用最小的C5H5连接的络合物Sc-4时,尽管收率相对较低(37-45%),但顺式选择性却大大提高至trans–3aa/cis–3aa = 1:19(entries 4-5)。此外, C5Me4SiMe3连接的钇络合物Y-1可获得cis–3aa作为主要产物(d.r = 1:4),与Sc-1形成trans-3aa完全形成鲜明对比(entry 6)。与上面观察到的趋势一致,位阻较小的C5Me5连接的钇络合物Y-2显示出较高的顺式-非对映选择性(d.r. = 1:8)(entry 7)。值得注意的是,更小的C5Me4H连接的络合物Y-3以95%的收率获得cis-3aa(d.r. < 1:19)(entry 8)。与C5H5连接的钇络合物Y-4还产生具有高非对映选择性的cis-3aa,但产率较低(entry 9)。
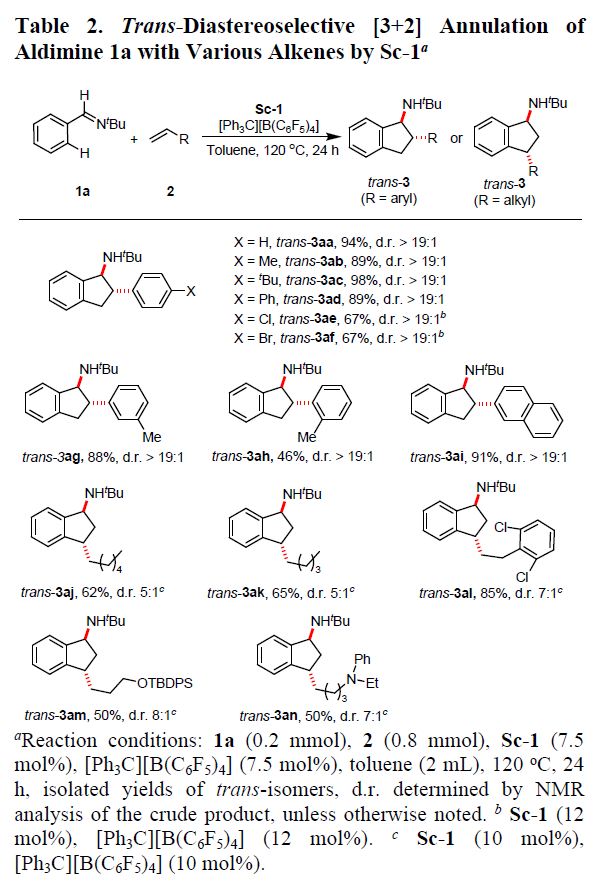
在获得上述最佳反应条件后,首先使用Sc-1作为催化剂,固定芳基亚胺底物1,对烯烃2进行了相关的扩展(Table 2)。反应结果表明,苯乙烯对位含有烷基或芳基取代基时,均可与1a以高收率(89%-98%)和优异的非对映选择性(d.r. > 19:1),获得反式取代茚满衍生物trans–3ab–3ad,同时,对位含有氯和溴取代基时,也可获得相应的产物trans–3ae和trans–3af。苯乙烯的间位和邻位含有甲基取代时,同样具有良好的非对映选择性(d.r. > 19:1),获得产物trans–3ag和trans–3ah,但邻位取代由于空间位阻的影响,导致收率偏低。使用2-乙烯基萘也同样以高产率(91%)和高非对映选择性(d.r. > 19:1)获得产物trans–3ai。此外,当使用脂族烯烃与1a反应时,也可获得相应的茚满衍生物trans–3aj–3an,但非对映选择性有所降低(d.r. = 5:1→8:1.16)。值得注意的是,OTBDPS和NPhEt官能团能够在反应中保持完成,为进一步修饰提供了多种可能。
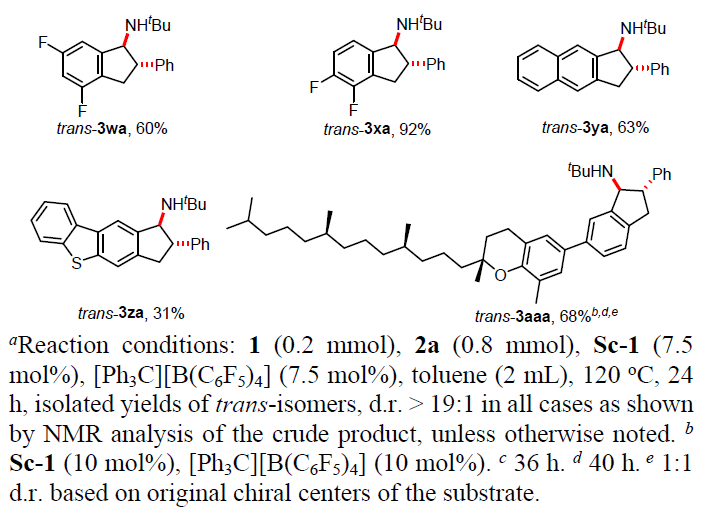
随后,使用Sc-1作为催化剂,固定苯乙烯底物2,对芳基亚胺底物1进行了相关的扩展(Table 3)。芳基环上含有烷基(3ba、3ca、3ia、3ua)和芳基(3da、3ja、3oa、3ta)取代的芳基亚胺底物均可与苯乙烯进行反式环化反应,获得较高收率(58%-95%)和高非对映选择性(d.r. > 19:1)的相应产物。同时,该反应具有良好的官能团耐受性,如卤化物、SiMe3、NMe2、SMe、OMe、乙烯基、萘基、杂芳基等均可获得相应的茚满衍生物trans–3ba–3za,并为进一步修饰提供了多种可能。当使用硫代芴基醛亚胺与苯乙烯的反应时,仅获得31%收率的trans–3za(d.r. > 19:1),这可能是trans–3za脱氨基时形成大量未纯化的无氨基茚副产物。值得注意的是,(+)-δ-生育酚醛化的亚胺也可与苯乙烯的反应,获得68%的收率的环化产物trans–3aaa(d.r. > 19:1),进一步证明了该方法在合成氨基茚满衍生物的实用性。
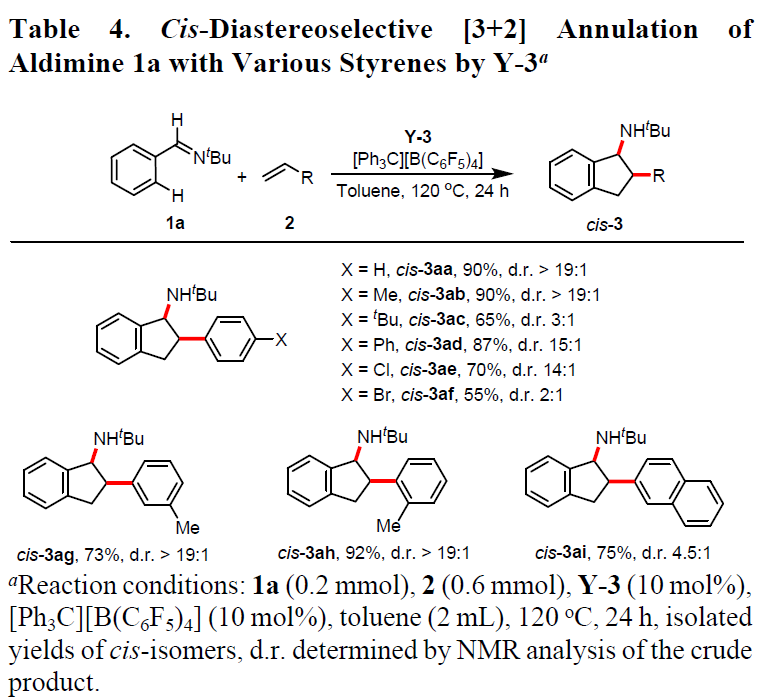
紧接着,作者使用Y-3作为催化剂,固定芳基亚胺底物1a,对烯烃2进行了相关的扩展(Table 4)。当苯乙烯的芳基对位含有甲基、苯基和氯时,反应具有高的顺式选择性(14:1至> 19:1),获得70-90%收率的cis–3ab,cis–3ad和cis–3ae,但苯乙烯的芳基对位含有tBu和Br时,由于空间影响,导致选择性较低。此外,苯乙烯的芳基间/邻位含有甲基时,分别获得高非对映选择性(d.r. > 19:1)的环化产物cis–3ag和cis–3ah。当使用2-乙烯基萘与1a反应时,虽然可以获得75%收率的cis–3ai,但d.r.仅为4.5:1。
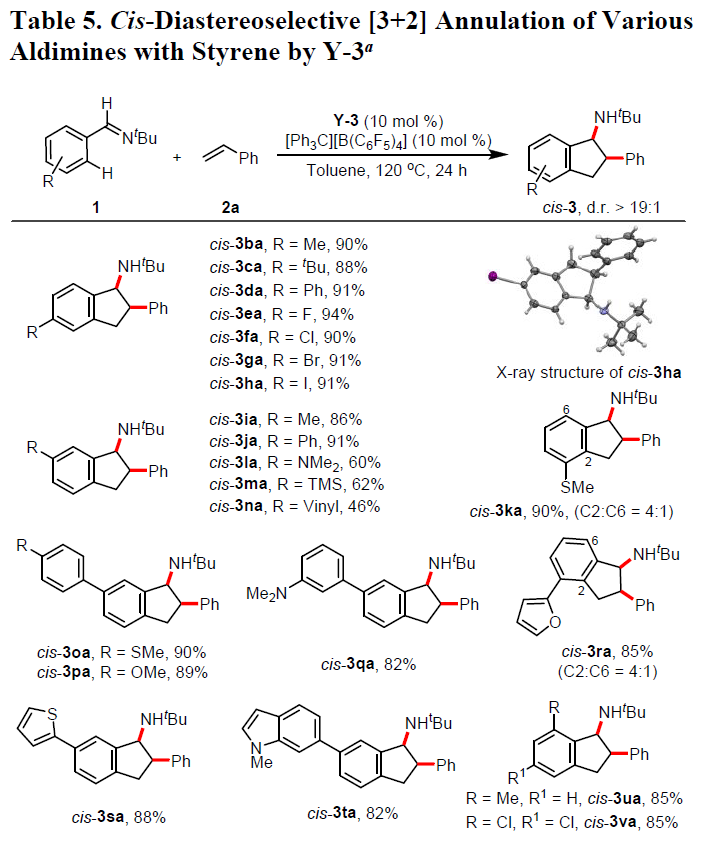
最后,作者使用Y-3作为催化剂,固定苯乙烯底物2a,对芳基亚胺底物1进行了相关的扩展(Table 5)。反应结果与上述类似,当芳基亚胺底物的芳基上含有烷基、芳基、乙烯基、甲硅烷基、卤素、杂原子等时,均可以高收率和高非对映选择性(d.r. = 16:1→>19:1)获得相应的环化产物cis–3ba-3za。当使用含有3-硫甲基和3-呋喃基取代的芳基亚胺时,由于C-H活化可同时发生在C2和C6位,从而获得具有区域异构体的C2:C6 = 4:1的产物cis–3ka和cis–3ra,C-H活化在C2位置的比例较大可能是由于亚胺中的硫代甲基/呋喃基与Y-3中的钇原子相互作用所致。在Sc-1的情况下,未观察到这种C2-H活化(trans–3ka和trans–3ra,Table 3),可能是由于C5Me4SiMe3配体的空间位阻影响。
在底物扩展之后,作者开始对其实用性进行了相关的研究(Scheme 2)。作者选择了上述反应中两个代表性的例子,进行相关克级放大实验。当使用Sc-1作为催化剂时,可获得高收率(90%)和高非对映选择性(d.r. > 19:1)的trans–3ga。而使用Y-3作为催化剂时,同样可获得高收率(91%)和高非对映选择性(d.r. > 19:1)的cis–3ha。
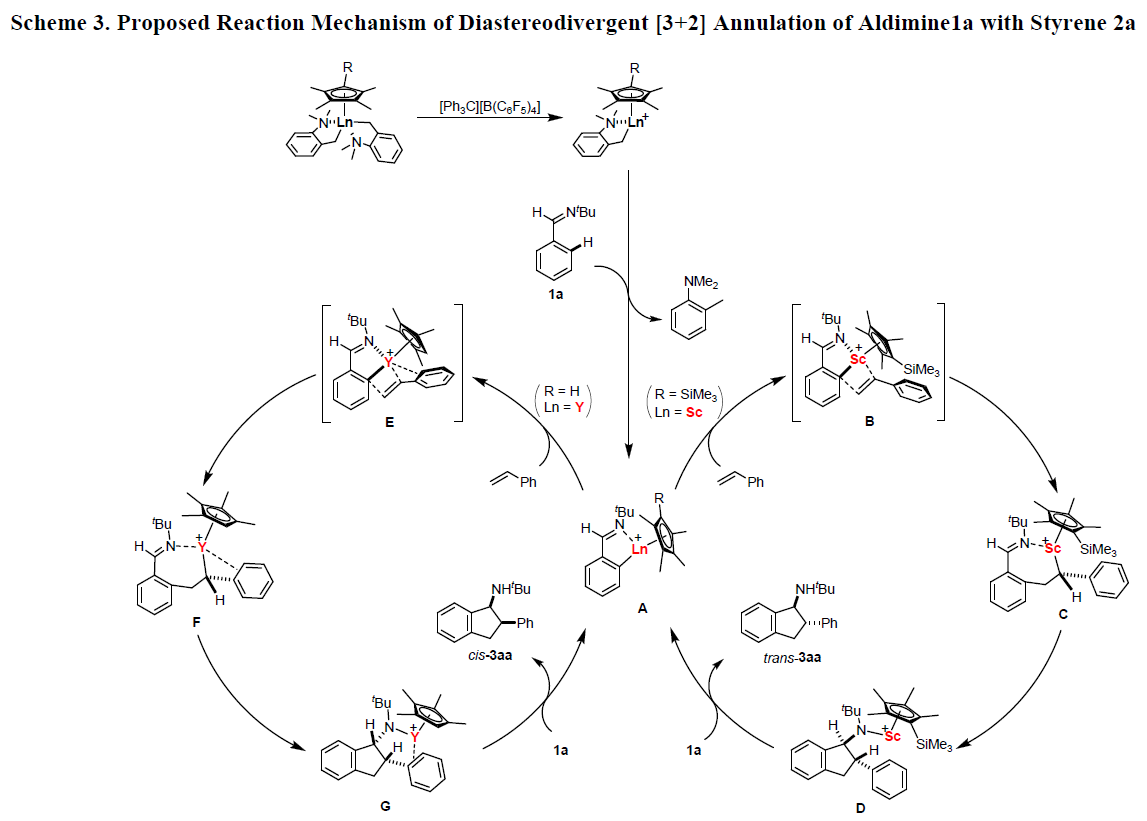
根据相关文献的查阅,作者提出了一种可能的反应机理(Scheme 3)。首先,1a中的氮原子与阳离子烷基络合物中的金属原子(由Sc-1或Y-3与[Ph3C][B(C6F5)4]反应生成)配位,然后金属烷基络合物对1a中的苯基进行邻-C-H活化(去质子化),得到五元金属环中间体A。随后,分别进行Sc-1与Y-3的催化循环。当使用Sc-1作为催化剂时,苯乙烯通过类似B的过渡态,在A的Sc-芳基键进行2,1-插入,得到中间体C。其中,由于C5Me4SiMe3和NtBu基团的空间排斥作用,Sc原子与苯乙烯中的苯基之间的相互作用变难,从而导致分子内亲核加成的Sc-C键与C中的C=N键进行环化,形成中间体D(十分有利的反式构型)。最后,D中Sc-N键断裂,获得trans–3aa并再生催化剂物种A。当使用Y-3作为催化剂时,Y原子与苯乙烯中的苯基的相互作用产生类似E的过渡态,因为Y的金属尺寸大于Sc的金属,并且E中的C5Me4H配体比B中的C5Me4SiMe3配体小得多。Y-苯基相互作用可能保留在苯乙烯插入产物F中,由于氨基-苯基与Y原子的螯合,环化后应生成顺式产物G。最后,G和1a之间的酸碱反应获得cis-3aa,并再生出催化剂物种A。
总结
日本理化所侯召民团队报道了,通过单茂稀土催化剂经C-H活化实现芳基亚胺与烯烃的第一个非对映[3+2]环化反应,获得多种氨基茚衍生物,同时,当使用Sc-1催化剂时,获得反式环化产物,而使用Y-3催化剂时,则获得相反的顺式环化产物。此外,该反应具有100%的原子经济性、出色的非对映选择性(d.r. > 19:1)、广泛的底物范围、良好的官能团耐受性等优点。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.