本文来自Chem-Station日文版 第一手はこれだ!:古典的反応から最新反応まで2 |第7回「有機合成実験テクニック」(リケラボコラボレーション) webmaster
翻译投稿 炸鸡 校对 HaoHu
这次和理学系实验室网站合作,我们会陆续推出十篇的“有机合成实验技巧”特集。
从第六篇开始将持续为期三篇的“合成化学的第一步!:找遍古典反应到最新反应”,手把手教你选择实用型的合成反应条件。我们在上一回中学习了如何选择合适的氧化反应。今天给大家带来的是有机合成中经常会用到的保护基和缩合反应。
保护基的选择:在什么反应条件下用什么保护哪些基团?
保护基,顾名思义,就是“保护我们不想参与反应的部分”的取代基。如果把反应分子比作一个人的话,这个人现在正在遭受各种各样的攻击,而保护基就相当于保护用具,我们需要考虑保护用具应该放在身体的哪个部位呢,该使用哪些保护用具呢,怎么穿上保护用具呢,。。。。等等一系列的问题。
那么让我们一起愉快地进入正题吧!想了解更多关于保护基的同学们可以参考本网站的文章“谈谈那些年深爱过的保护基”。
因为需要保护的基团种类和保护基团的种类过于庞大,所以我们这里不做讨论。先说说我们首要考虑的:首选的反应条件(即怎么穿上保护用具呢)。因为比起导入保护基脱下保护基更重要,所以在讲完反应条件后我们会谈谈如何选择合适的反应条件脱下保护基(即脱下保护用具)。
烷基硅类保护基的导入•脱除方法
烷基硅类保护基在保护醇方面一直是备受广大实验工作者的喜爱。我们网站的醇的硅醚保护反应 Silyl Protective Group这一篇文章每年都是点击率最高的文章之一。理由很简单:烷基硅类保护基引入和脱下都很简单。
烷基硅类保护基根据保护基体积大小的不同有很多种类,其中最常用的是TBS(叔丁基二甲基硅基)。首选的反应条件为TBSCl,咪唑和DMF。这个反应条件成本最低,反应时只需要将TBSCl固体投入进反应溶液即可,而且TBS基团几乎能保护所有类型的醇。如果你不想使用DMF作为溶剂或者需要比较温和一点的反应条件(或者需要保护的醇体积太大),反应条件可以变更为TBSCl,NEt3 (DMAP),CH2Cl2。如果在这样的反应条件里,TBSCl和醇的反应太慢或是保护效果不明显,可以改用TBSOTf,2,6-二甲基砒啶和CH2Cl2。TBSOTf比TBSCl稍微昂贵一点,但是因为TBSOTf与醇的反应活性更高,所以它也能保护一些体积较大的醇。比如我们需要对叔醇t-BuOH进行保护,如果用TBSCl,咪唑和DMF的话,即使反应了3天,反应收率连一半也达不到,但是如果用TBSOTf,2,6-二甲基砒啶和CH2Cl2的话,10分钟就能反应完得到定量的反应产物。这些规则不仅适用于TBS保护基还适用于所有的烷基硅类保护基。
有“穿上”就有“脱下”。烷基硅类保护基的脱除方法首选TBAF,THF或是HCl (or AcOH),THF/H2O。根据化合物酸碱性的强弱选择不同的脱除方法。比如化合物酸性很强,就要用盐酸来脱除保护基。如果反应进行不下去可以加热反应体系来帮助反应进行。
如果化合物不耐酸,就要使用TBAF和THF。这种方法利用了硅元素和氟元素之间的亲和性来有效去保护基。但是这种方法有一个缺点,就是在去保护基的过程中,会生成醇盐,如果原化合物的耐碱性不是很强的话会导致原化合物被分解。这时候,就要请出特别嘉宾:醋酸(AcOH)。添加等量的醋酸,体系内生成的醇盐就会立刻被醋酸质子化,就能防止碱性环境下化合物被分解。
温和的烷基硅类类保护基的导入•脱除方法
在此之前我们介绍的都是一些基本的条件。但是这一小节中我们将介绍一些反应条件比较苛刻的方法供土豪们和感兴趣的同学们选择。我个人非常喜欢R3Si–CN。因为你只需要“一锅炖”就可以了,其他的也不需要管了,甚至不需要溶剂。但上TMS保护基的时候要注意将醇和适量的TMSCN混合在一起,多余的TMSCN要用减压蒸馏除去。但是要注意如果有HCN生成或者反应体系中有反应活性很高的酮,就会发生烷基硅氰基化反应。
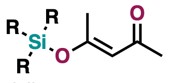
另外,如果需要的反应条件较强,需要反应体系PH值呈中性的话,我推荐你使用关西学院大学的田边课题组开发的Si-BEZA。仅限于TMS、TES基等比TBS基反应活性弱的保护基的话,又想让整个反应体系呈中性,我个人强烈推荐4-三烷基硅氧烷-3-戊烯-2-酮。反应要用反应活性较高的醇否则反应不会发生,加入4-三烷基硅氧烷-3-戊烯-2-酮后整个反应体系呈中性。
4-三烷基硅氧烷-3-戊烯-2-酮
关于去保护基的方法,如果是1级TBS基的话,像TES基之类的推荐使用LiBF4和CH3CN溶液。LiBF4固体价格低廉所以就放心大胆的加吧~虽然没有用DMF做溶剂但是CH3CN作溶剂能溶解一些极性非常高的化合物。还有一个我虽然没怎么用但还是情有独钟的方法——过量的NH4F和MeOH。HF和吡啶虽然可以在接近中性的条件下脱除保护基,但是如果反应规模较大的话,反应会很麻烦而且后处理繁琐。NH4F作为一种便宜且性质稳定的盐即使大量加入也不会有问题。还有一种方法就是用硅酸盐——TASF,这种方法也曾流行一时,但最近好像不怎么看到了,可能是成本太贵了吧。
再讲讲如何选择烷基硅类保护基。如果你需要长时间的保护建议你使用强大的保护基(TIPS基和TBDPS基)。TBS基容易脱落而且脱除比较麻烦所以不是很推荐啦。我还是学生的时候因为听说TBDPSCl很贵所以一直不敢用,所以保护伯醇我用TBS基,保护仲醇我用TES基,结果都不能完美地分离,不得不重做了。。。。
不知不觉我已经讲了这么多了,光讲烷基硅类保护基已经写了这么多了。想了解经常使用的苯基类和酰类,还有保护氮的,羧基类保护基等的基本反应条件的可以在本网站里搜索相关文章。
脱水缩合反应的首选:首先从最基本的反应条件试起吧
这一小节里我给大家带来缩合反应的首选。狭义上的缩合反应一般指羧酸和醇或胺反应生成酯和酰胺的一类反应。理想情况下反应会生成副产物——水,所以为了高效率地,温和反应条件下去除生成的水,一系列各种各样缩合反应和缩合剂被开发出来。
首先我们要考虑的是“化合物对酸和碱稳定吗”。
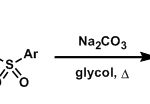
比如简单结构的羧酸和醇反应的话,最廉价的,最优的反应条件就是教科书上告诉我们的:把羧酸,醇,酸催化剂(HCl)以及甲苯溶液共沸,用Dean-Stark之类的玻璃仪器来不断移除反应中生成的水。如果羧酸非常不活泼的话,可以用氯化亚砜或乙二酰氯和羧酸反应使羧酸转变为酰基氯,再加入仲胺缩合,这是一种既便宜又反应性高的方法。当然,使用昂贵的缩合剂也不是什么坏事,但首先试试这个便宜的方法,如果不行的话再用昂贵的缩合剂也不迟。
如果羧酸比较不活泼,可以和无水酸酐反应和或者2,4,6-三氯苯甲酰氯反应活化羧酸。如果这样还是不行的话,建议亲用缩合剂吧
不稳定化合物的缩合反应
这里的不稳定化合物是指遇酸和碱就会分解的化合物。“氨基酸缩合”是我们熟悉的一种生成酰胺键的缩合反应。氨基酸缩合的时候,不对称中心经常发生消旋化。大多数情况都是由于反应能量过大导致消旋,一般都是发生在反应的某一步中间体上。
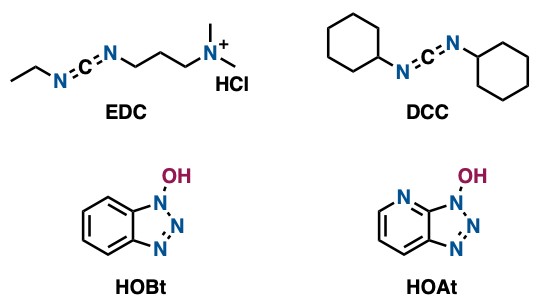
先不讨论消旋化了。让我们来想想什么缩合剂能促进不稳定化合物的缩合呢?第一选择当然是EDC(1-乙基-(3-二甲基氨基丙基)碳酰二亚胺)。可以使用大学课上讲过的DCC(N,N’-二环己基碳二亚胺),但DCC通常像石头一样硬,因此在反应前很难进行精确的称量(估计只有过来人才能理解其中的辛酸吧),而且除去反应副产物二环己基脲也极其麻烦。而使用EDC就没有这样的烦恼了,因为实际和副产物存在于水相中,所以只需分液即可得到产物。如果担心发生消旋化的话可以加入等量的HOBt或者HOAt。HOBt和HOAt起着所谓的“媒介作用”,在不影响羧酸和胺的前提下,促进缩合反应进行。
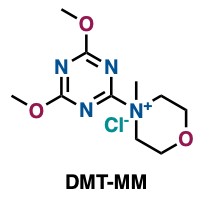
还有一种缩合剂——DMT-MM,它能溶于水和乙醇。即使在水或者甲醇作为溶剂的反应体系中也能顺利推进酰胺化反应的进行。
限于篇幅,弱碱性缩合剂只能暂且不讲了。
使用高性能缩合剂提高反应效率的缩合反应
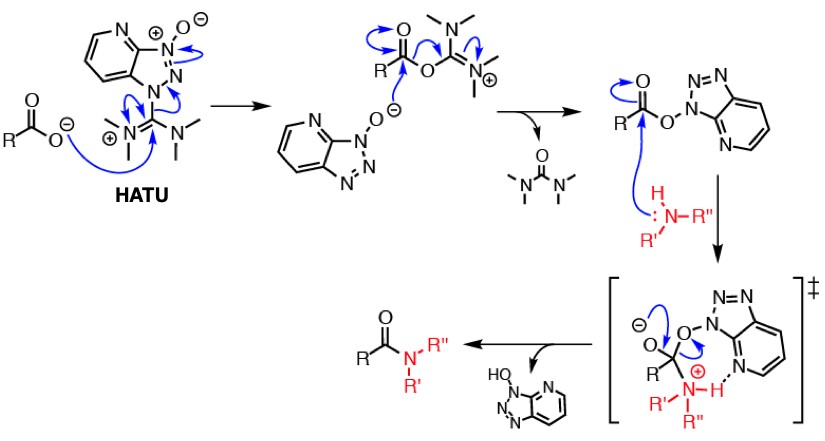
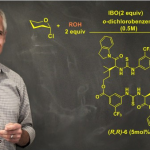
如果你不计金钱也要得到目标化合物的话,请试试最新的高能缩合剂吧。强烈推荐HATU(2-(7-氮杂苯并三氮唑)-N,N,N’,N’-四甲基脲六氟磷酸酯)。很多缩合反应都用这种缩合剂提高缩合效率。因为反应体系中会生成HOAt,所以我们不必担心会发生消旋化。另外,对于有些体积庞大且反应活性极差的羧酸和胺,用BOP-Cl反应剂可以促进反应的发生,但是由于其致癌性目前已经停产了。因为最近我没怎么做有难度的酰胺缩合反应,所以对这一块了解并不是很多,抱歉。
使用了HATU的缩合反应(出处:Wikipedia[HATU]を改変)
注:虽然我上文说了HATU价格比较昂贵,但25g的HATU价格约在23,00到30,000(rmb约在1380~1800之间)日元之间。25g的EDC约为20,000日元(rmb1200),其实也差不太多。如果考虑到添加HOBt和HOAt来消旋的话,高性能缩合剂似乎更划算。但是不管怎么说,和传统的方法比,成本还是很高的。
介绍了两个应用范围很广的反应
抱着想给大家讲讲合成化学中如何选择反应方法,但很遗憾本系列(合成化学的第一步!:找遍古典反应到最新反应)预订只有3篇,下一篇就是本系列最后一篇了。最后一篇将带大家学习交叉偶联反应的选择。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



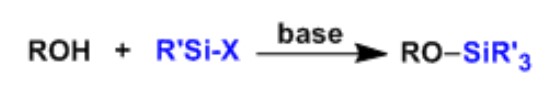



















No comments yet.