作者:叶陈曦博士
导读:
近日,德国马尔堡大学Eric Meggers课题组和美国欧柏林学院Shuming Chen课题组的研究人员合作报道了迄今为止最为高效的手性α-氨基酸合成方法。
“Expedited synthesis of α-amino acids by single-step enantioselective α-amination of carboxylic acids.
Chen-Xi Ye, Drew R. Dansby, Shuming Chen* & Eric Meggers*
Nat. Synth., 2023. DOI: 10.1038/s44160-023-00267-w”
正文:
非天然手性α-氨基酸在生物或化学领域均有诸多应用。例如,非天然α-氨基酸的引入可以调节具有氨基酸结构基元的生理活性分子的理化及代谢性质。在合成化学上,α-氨基酸是许多重要手性化合物的合成砌块或前体,其本身作为手性配体和有机小分子催化剂在不对称催化领域具有非常广泛应用。因此,发展更为高效的手性α-氨基酸合成方法一直以来都是化学领域的研究热点[1]。然而,目前所建立的手性α-氨基酸合成方法大多基于官能团转化反应。这些反应通常受限于使用制备困难的底物、狭窄的适用范围以及使用非通用的N-或O-保护基,其对所得α-氨基酸产物的后续应用造成极大的不便。简单、通用、高效且直接使用原料化学品(feedstock chemical)作为底物的合成方法鲜有报道。
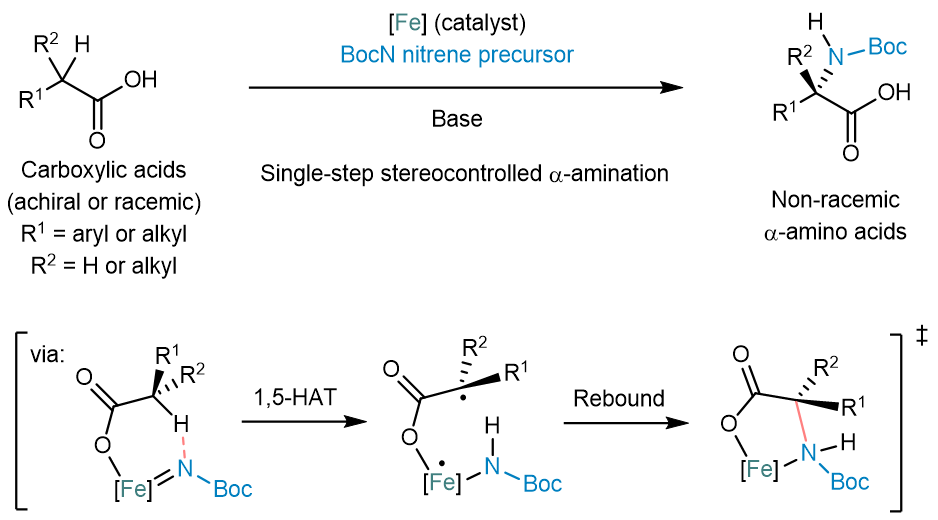
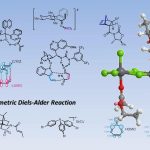
近日,来自德国马尔堡大学Eric Meggers课题组和美国欧柏林学院Shuming Chen课题组的研究人员合作报道了迄今为止最为高效的手性α-氨基酸合成方法。该方法基于对原料化学品羧酸底物进行立体控制的α-氨基化(如图一所示)[2]。该反应使用BocNHOMs作为氨基化试剂,该试剂可方便地由羟胺作为起始原料大量制备。该反应使用的催化剂为具有四齿手性配体的铁配合物(FeBIP)。该反应使用的溶剂为氯代烃,其中,邻二氯苯适用于大多数α-芳基乙酸底物,而其余的底物则使用二氯甲烷作为溶剂。该反应在‒15摄氏度下进行,低温不仅有利于提高反应的立体选择性,并可以抑制BocNHOMs在碱性条件下的自发分解(该反应使用当量的哌啶作为碱)。

图一:立体控制的羧酸α-氨基化反应制备手性α-氨基酸。
对于α-芳基乙酸底物,不论芳环上的取代基为给电子或吸电子,该反应均得到良好的产率及优异的立体选择性。对于α-烷基乙酸底物,该反应可以稍低的产率及立体选择性得到一系列具有烷基侧链的α-氨基酸产物。值得注意的是,对于α-烷基乙酸底物,理论上反应存在区域选择性(即氨基化可能发生于β位或更远的位点),但反应仅观察到α-氨基化产物的生成。令人惊喜的是,该反应亦可用于将外消旋的α,α-双取代羧酸底物通过立体汇聚的α-氨基化转化为具有季碳手性中心的α,α-双取代氨基酸产物。当α,α-双取代羧酸底物的其中一个取代基为芳基,另一个为烷基时,反应可以良好至优异的产率和优异的立体选择性得到目标产物;当α,α-双取代羧酸底物的两个取代基均为烷基时,反应的产率和立体选择性均大幅度降低。最后,为了展示该反应的普适性,作者对一些具有羧酸结构基元的复杂药物分子进行了后期α-氨基化,反应均以满意的产率和立体选择性得到对应的α-氨基酸产物。
作者随后通过一系列实验对反应机理进行了深入探究,这些实验结果均支持自由基中间体的生成。作者提出的催化循环如图二所示。在碱的存在下,氨基化试剂BocNHOMs与铁催化剂通过配位、去质子化及N‒O键断裂生成铁氮宾中间体A。随后,弱配位的甲磺酸负离子与羧酸负离子发生配体交换得到铁氮宾中间体B。紧接着,B通过分子内的1,5-氢抽取生成双自由基中间体C。中间体C具有较长的寿命,使得碳自由基发生差向异构化,并使随后的C–N成键步骤成为该反应的立体选择性决定步骤,并得到中间体D。产物α-氨基酸负离子随后从铁催化剂上解离并完成了催化循环。密度泛函计算进一步为该机理提供了支持。值得注意的是,该反应机理与作者先前报道的立体控制的1,3-氮迁移反应具有一定相关性。在1,3-氮迁移反应中,类似的金属氮宾中间体被提出,所不同的是其由氮杂酯底物在金属催化剂作用下生成[3]。

图二:作者提出的反应机理。
该研究对于氮宾的不对称分子间C‒H 插入反应具有深远的影响[4]。该研究使用的定位基策略为解决氮宾的不对称分子间C‒H 插入反应所面临的极具挑战性的区域及立体选择性问题提供了新的思路。值得期待的是,在未来研究中利用其他配位性官能团或可发展出更多基于原料化学品底物的历经氮宾中间体的不对称分子间C‒H氨基化反应。
结语:相比于已知的手性α-氨基酸合成方法,该研究所提出的立体控制的羧酸α-氨基化反应具有无与伦比的优势:1)该反应直接使用经济易得的原料化学品羧酸作为底物;2)反应仅需一步得到手性N-Boc保护α-氨基酸,作为氨基酸化学中最常用的保护基之一,N-Boc保护α-氨基酸可直接应用于多肽合成等用途而无需繁琐的保护基转化;3)反应具有广泛的底物适用性,并可用于复杂分子的后期不对称α-氨基化;4)反应使用的铁催化剂具有低毒性和可持续性。因此,可以预见该研究将极大地促进α-氨基酸合成化学及相关领域的发展。
(本文由Eric Meggers教授课题组供稿)
参考文献:
- [1] Nájera, C.; Sansano, J. M. Catalytic asymmetric synthesis of α-amino acids. Chem. Rev. 2007, 107, 4584–4671. DOI: 10.1021/cr050580o.
- [2] Ye, C.-X.; Dansby, D. R.; Chen, S.; Meggers, E. Expedited synthesis of α-amino acids by single-step enantioselective α-amination of carboxylic acids. Nat. Synth. 2023, 2, doi: 10.1038/s44160-023-00267-w.
- [3] Ye, C.-X.; Shen, X.; Chen, S.; Meggers, E. Stereocontrolled 1,3-nitrogen migration to access chiral α-amino acids. Nat. Chem. 2022, 14, 566–573.doi: 10.1038/s41557-022-00895-3.
- [4] Ju; M.; Schomaker, J. M. Nitrene transfer catalysts for enantioselective C–N bond formation. Nat. Rev. Chem. 2021, 5, 580–594. doi: 10.1038/s41570-021-00291-4.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载


















No comments yet.