本文作者:杉杉
导读
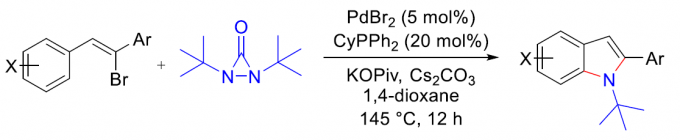
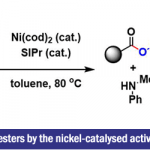
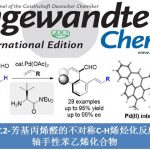
近日,常州大学的史一安课题组在Org. Lett.中发表论文,报道一种全新的通过钯催化剂参与的吲哚合成策略。这一全新的吲哚合成策略中,采用廉价易得的乙烯基溴作为起始原料,进而以良好的反应收率,顺利完成一系列吲哚分子的构建。同时,反应过程中可能涉及芳基C-H键活化以及通过环钯(II)中间体与二氮杂环丙酮 (diaziridinone)进行的双胺化过程。
Pd-Catalyzed Indole Synthesis via C-H Activation and Bisamination Sequence with Diaziridinone
J.Wang, X. Sun, D. Hu, Y. Shi, Org. Lett. ASAP doi: 10.1021/acs.orglett.1c02757.
正文
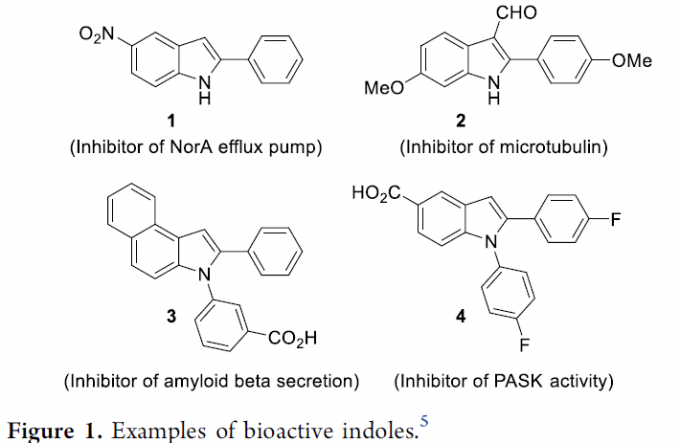
吲哚作为含氮杂环化合物中最为重要的结构单元,广泛存在于一系列生物活性分子、天然产物、药物、农药以及材料分子中 (Figure 1)。因此,设计全新的、更为高效的反应策略,完成各类吲哚分子构建的相关研究,一直以来备受广泛关注[1]。通常,文献报道中,通常采用各类有机含氮砌块参与的环化反应方法学,进而顺利完成一系列吲哚分子的构建。然而,通过C-H键胺化策略实现吲哚分子的制备,则有待进一步研究。
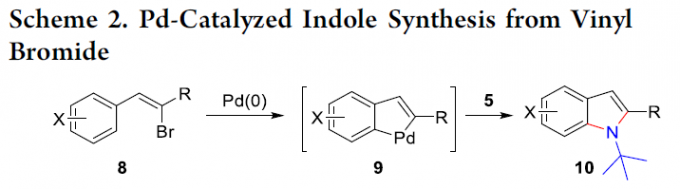
这里,受到本课题组前期对于二氮杂环丙酮与环钯(II)中间体作用,形成含氮杂环分子相关研究 (Scheme 1) [2]–[4]的启发,本文中,作者成功设计出一种通过廉价易得的乙烯基溴作为起始原料,进而以良好的反应收率,顺利完成一系列吲哚分子的构建 (Scheme 2)。
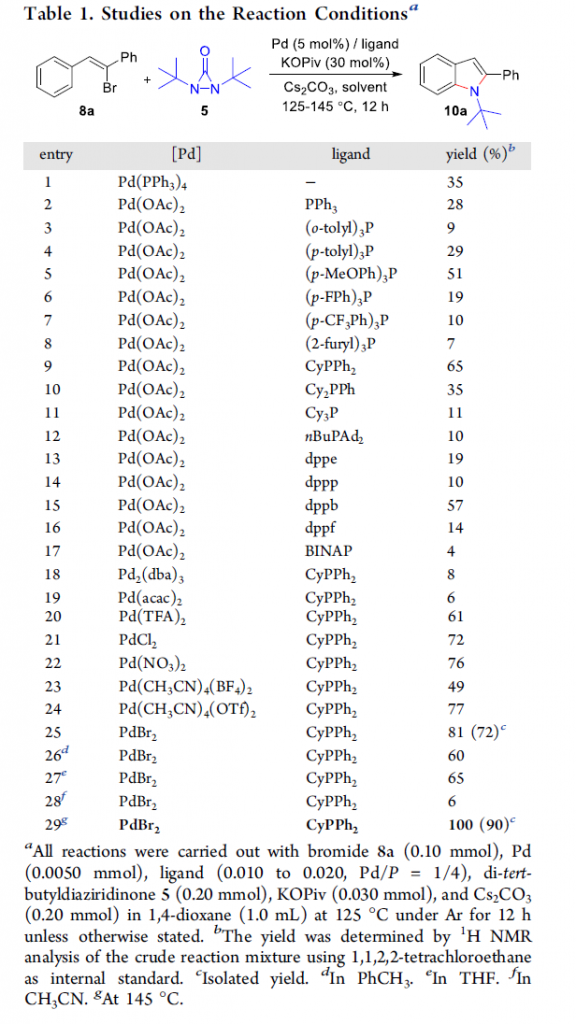
首先,作者采用8a与二叔丁基二氮杂环丙酮5作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用PdBr2作为催化剂,CyPPh2作为配体,Cs2CO3作为碱,同时加入催化量的KOPiv,1,4-二氧六环作为反应溶剂,反应温度为145 oC,最终获得100%收率的产物10a。
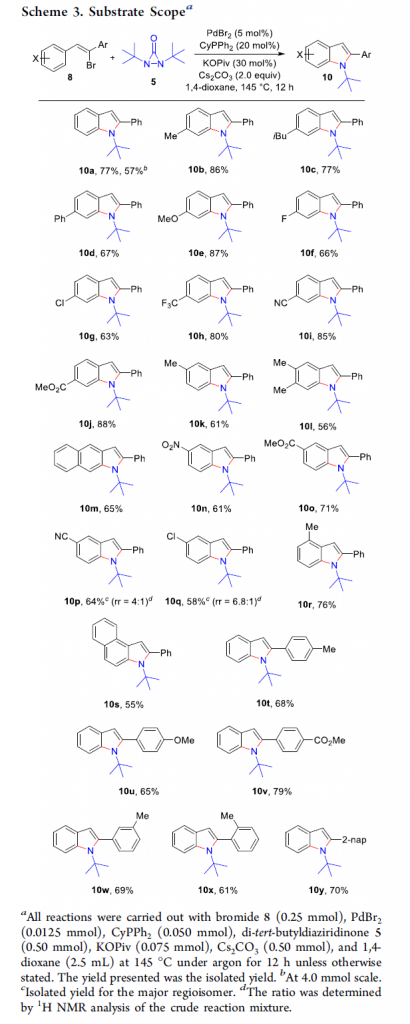
在上述的最佳反应条件下,作者对各类乙烯基溴底物的应用范围进行考察 (Scheme 3)。研究表明,一系列苯环对位具有供电子与吸电子基团取代的苯乙烯基溴底物,均能较好地与上述的标准反应条件兼容,并获得相应的6-取代吲哚产物10a–10j (63-88% 收率)。之后,作者发现,苯环间位具有不同基团取代的苯乙烯基溴底物,同样能够有效地参与上述的合成转化过程,进而能够区域专一性地获得相应5-取代吲哚产物10k–10o (56-71% 收率)。然而,作者进一步发现,在苯环间位具有氰基与氯基团取代时,则获得两种相关的区域异构体,其中,主要产物为10p与10q。同时,研究发现,上述的最佳反应条件对于苯环邻位取代的苯乙烯基溴底物,同样能够良好地兼容,并获得相应的吲哚产物10r与10s。此外,该小组发现,与C-Br键中的碳原子直接相连的苯环中存在不同类型的基团取代时,同样能够顺利完成上述的成环过程,并以良好的反应收率,获得相应的2-芳基取代吲哚产物10t–10y。
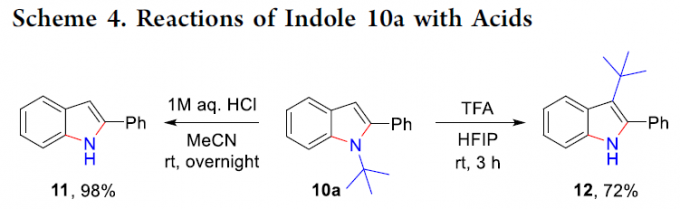
之后,作者发现,通过上述策略获得的N-叔丁基吲哚产物能够通过后续的去除N-叔丁基以及叔丁基的重排过程,进一步转化为其它不同类型的吲哚化合物 (Scheme 4)。
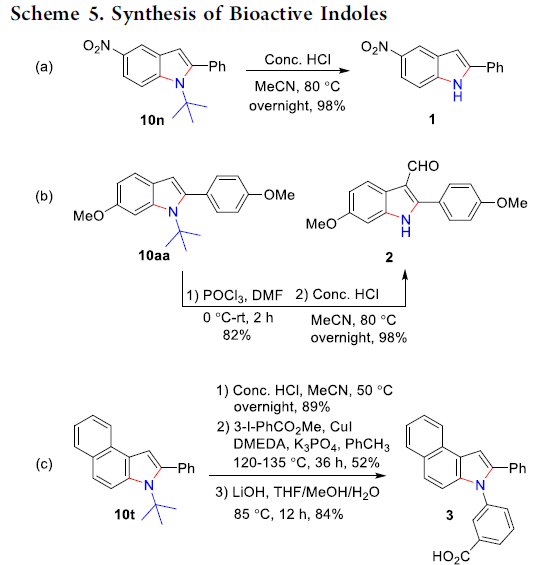
同时,该小组进一步发现,通过上述的C-H键活化与双胺化串联反应策略获得的吲哚砌块,能够成功应用于一系列具有重要生物活性的吲哚分子的构建 (Scheme 5)。
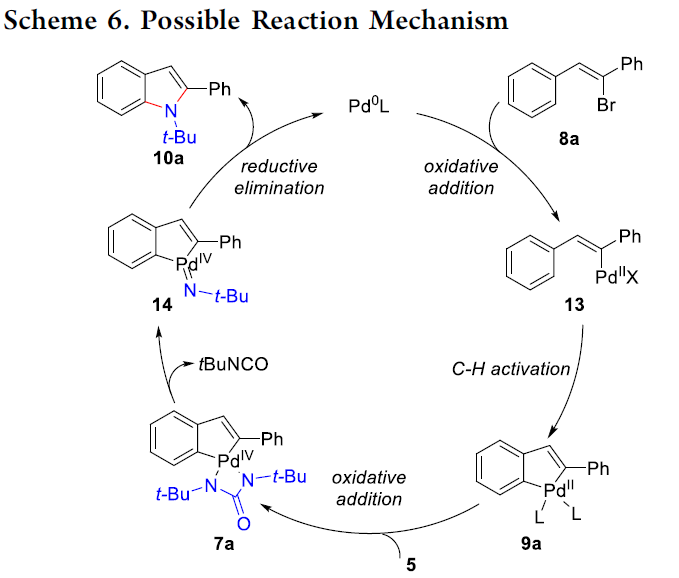
接下来,基于本课题组前期的研究报道[2],作者提出一种合理的反应机理 (Scheme 6)。首先,通过Pd0L催化剂与乙烯基溴8a之间的氧化加成过程,形成乙烯基钯配合物13,之后,乙烯基钯配合物13经历后续的芳基C-H键的活化步骤,形成环钯(II)中间体9a,再通过二叔丁基二氮杂环丙酮5与环钯(II)中间体9a进一步的氧化加成过程,获得环钯(IV)中间体7a。最终,通过中间体7a后续的β-N消除 (产生异氰酸叔丁酯副产物)以及还原消除过程,获得相应的吲哚产物 10a。
总结
常州大学的史一安课题组报道一种通过钯催化C-H键活化与双胺化串联的反应策略,并选择廉价易得的乙烯基溴与二氮杂环丙酮作为起始原料,进而成功完成一系列芳基取代的吲哚衍生物的构建。这一全新的合成转化策略具有良好的反应收率,并且,能够有效地应用于一系列生物活性的吲哚分子及其类似物的制备。
参考文献
[1] (a) S. Cacchi, G. Fabrizi, Chem. Rev. 2005, 105, 2873. doi: 10.1021/cr040639b.(b) G. Zeni, R. C. Larock, Chem. Rev. 2006, 106, 4644. doi: 10.1021/cr0683966.
(c) G. Bartoli, R. Dalpozzo, M. Nardi, Chem. Soc. Rev. 2014, 43, 4728. doi: 10.1039/C4CS00045E.
[2] (a) T. A. Ramirez, Q. Wang, Y. Zhu, H. Zheng, X. Peng, R. G. Cornwall, Y. Shi, Org. Lett. 2013, 15, 4210. doi: 10.1021/ol401935c.(b) H. Zheng, Y. Zhu, Y. Shi, Angew. Chem., Int. Ed. 2014, 53, 11280. doi: 10.1002/anie.201405365.
(c) S. Debnath, L. Liang, M. Lu, Y. Shi, Org. Lett. 2021, 23, 3237. doi: 10.1021/acs.orglett.1c00466.
(d) J. Li, J. Chen, L. Wang, Y. Shi, Org. Lett. 2021, 23, 3646. doi: 10.1021/acs.orglett.1c01043.
[3] (a) C. Shao, B. Zhou, Z. Wu, X. Ji, Y. Zhang, Adv. Synth. Catal. 2018, 360, 887. doi: 10.1002/adsc.201701039.(b) B. Zhou, Z. Wu, D. Ma, X. Ji, Y. Zhang, Org. Lett. 2018, 20, 6440. doi: 10.1021/acs.orglett.8b02750.
(c) X. Sun, Z. Wu, W. Qi, X. Ji, C. Cheng, Y. Zhang, Org. Lett. 2019, 21, 6508. doi: 10.1021/acs.orglett.9b02386.
(d) D. Ma, X. Ji, Z. Wu, C. Cheng, B. Zhou, Y. Zhang, Adv. Synth. Catal. 2019, 361, 739. doi: 10.1002/adsc.201801367.
[4] (a) F. Jafarpour, M.vGhasemi, H. Navid, N. Safaie, S. Rajai-Daryasarei, A. Habibi, R. C. Ferrier, Org. Lett. 2020, 22, 9556. doi: 10.1021/acs.orglett.0c03611.(b) L. Fan, J. Hao, J. Yu, X. Ma, J. Liu, X. Luan, J. Am. Chem. Soc. 2020, 142, 6698. doi: 10.1021/jacs.0c00403.

















No comments yet.