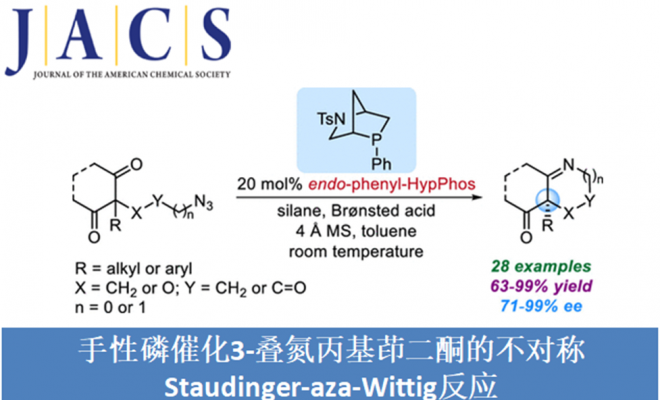
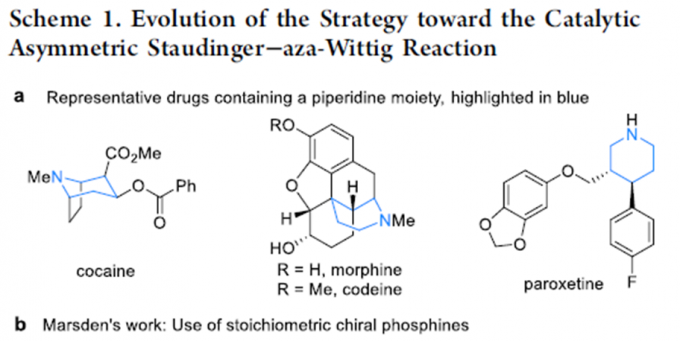
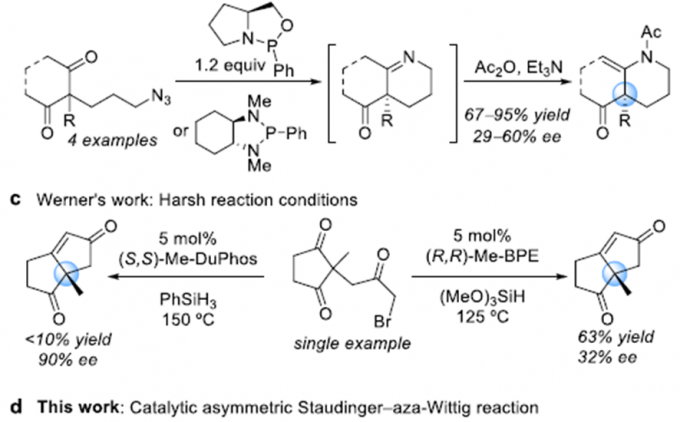
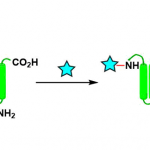
手性杂环胺特别是六元杂环胺广泛存在于天然产物、具有活性的化合物以及美国食品和药物管理局批准的小分子药物中,因此该类化合物的合成受到化学家的广泛关注。但含季碳手性中心得杂环胺的制备条件特别苛刻,因此美国加州大学洛杉矶分校(UCLA)的Ohyun Kwon课题组将目光投向了室温条件就能发生的酮的Staudinger−aza-Wittig反应。2006年,Marsden课题组报道了第一例手性噁唑磷烷或二氮磷烷催化2-(3-叠氮基丙基)-1,3-二酮的不对称Staudinger-aza-Wittig反应,合成六元杂环胺化合物[1]。但该反应需要应用等化学当量的手性催化剂。最近,Werner课题组报道了第一例微波或高温驱动酮的不对称Wittig反应,但只能以中等的收率和对映选择性得到相应产物[2]。在上述背景研究的基础上,Ohyun Kwon课题组报道了L-羟基脯氨酸衍生的手性磷催化剂催化3-叠氮丙基茚二酮的不对称Staudinger-aza-Wittig反应,构建六元杂环胺化合物(Scheme 1)。相关研究成果发表于
Catalytic Asymmetric Staudinger−aza-Wittig Reaction for the Synthesis of Heterocyclic Amines
Cai, L.; Zhang, K.; Chen, S.; Lepage, R. J.; Houk, K. N.; Krenske, E. H.; Kwon, O. * J. Am. Chem. Soc. 2019, 141, 9537-9542
论文作者介绍:
研究者:Ohyun Kwon教授
研究者经历:
- 1991,B.S.,Seoul National University
- 1993,M.S., Seoul National University
- 1998,Ph.D.,Columbia University
- 1998,Howard Hughes Postdoctoral Fellow,Harvard University
- 2001,assistant professor,UCLA
- 2005,member of the Molecular Biology Institute (MBI) and UCLA Jonsson Comprehensive Cancer Center (JCCC)
荣誉奖项
- Amgen Young Investigator’s Award
- Synthesis and Synlett Thieme Journal Award
- UCLA Faculty Career Development Award
- Glenn T. Seaborg Award
- Columbia University KAST Fellowship
研究领域
organic/Chemical Biology/Synthesis
论文概要
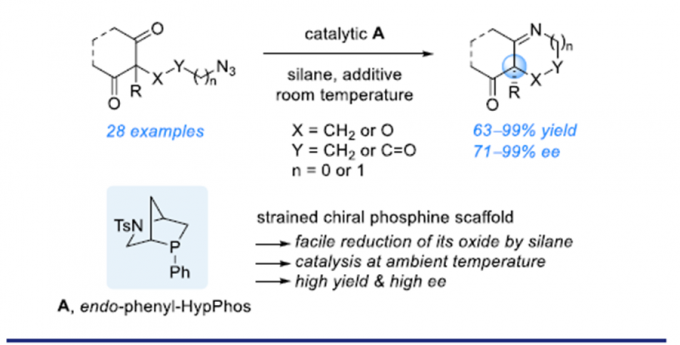
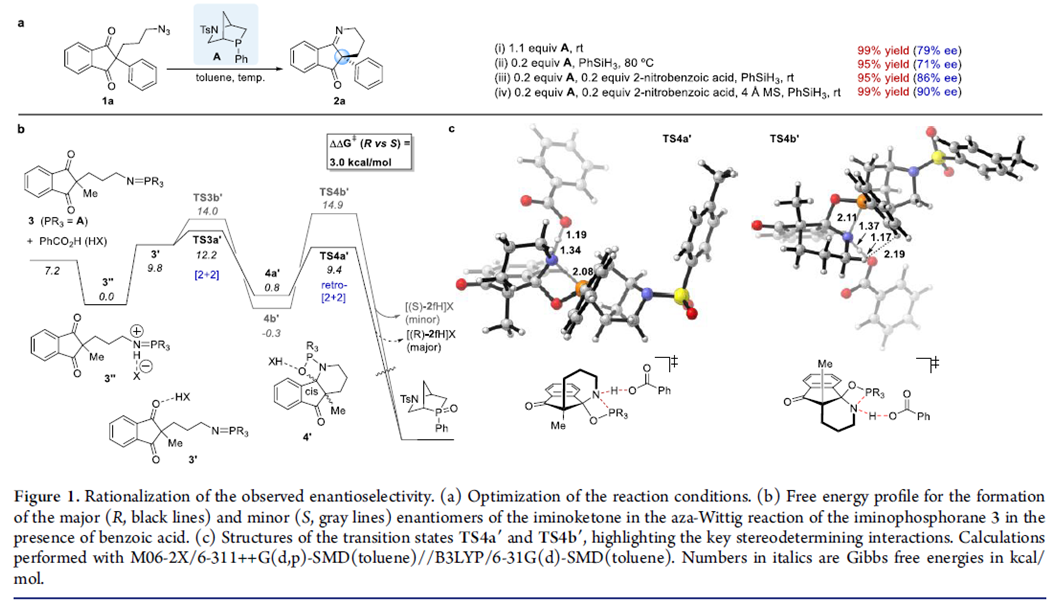
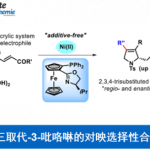
以3-叠氮丙基茚二酮为模板底物,通过反复筛选反应条件,作者筛选出最优反应条件:20 mol%的手性磷催化剂A或B,20 mol% 2-硝基苯甲酸、2 equiv PhSiH3、4Å MS为添加物,甲苯为溶剂,在室温条件下反应48 h,能以99%的收率和90%的对映选择性得到相应产物(Figure 1a)。
为了进一步探索该反应对映选择性的决定因素,作者考察了苯甲酸对手性膦催化剂A和叠氮化物1f发生aza-Wittig反应生成的膦亚胺3的自由能影响曲线。计算结果表明该反应经历中间体4′发生[2+2]/逆-[2+2]环加成反应,其对映选择性由手性催化剂和酸添加物共同决定。同时,作者提出可能的反应机理:膦亚胺3在酸性作用下发生质子化过程生成离子对3″。3″可发生异构化转化为相对不稳定的氢键复合物3′。3′既可活化分子内[2+2]环加成的羰基,又可加快逆-[2+2]环加成的反应速度。但[2+2]环加成(TS3a’)的速度明显高于逆-[2+2]环加成的反应速度(TS4b’),而对映选择性取决于稳定的中间体TS4a’(Figure 1b, c)。
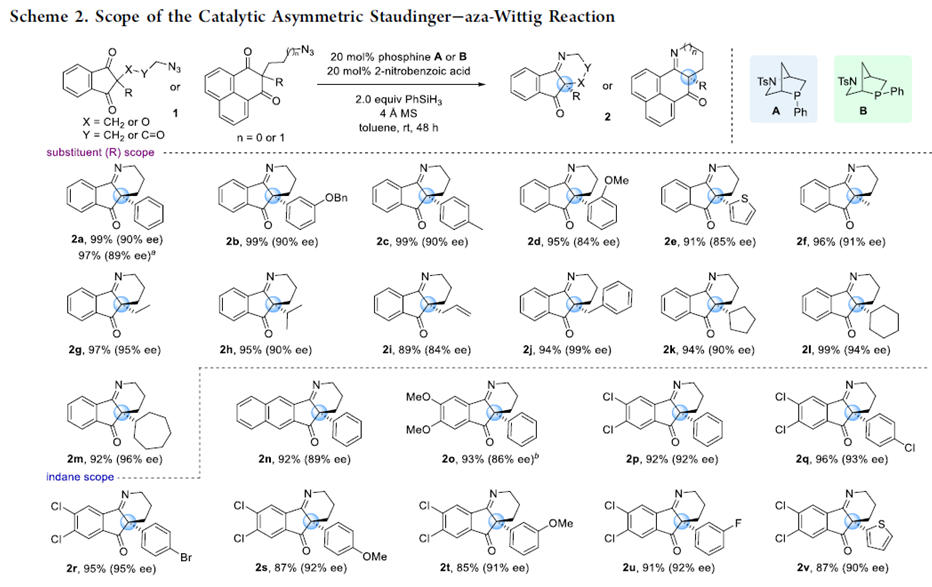
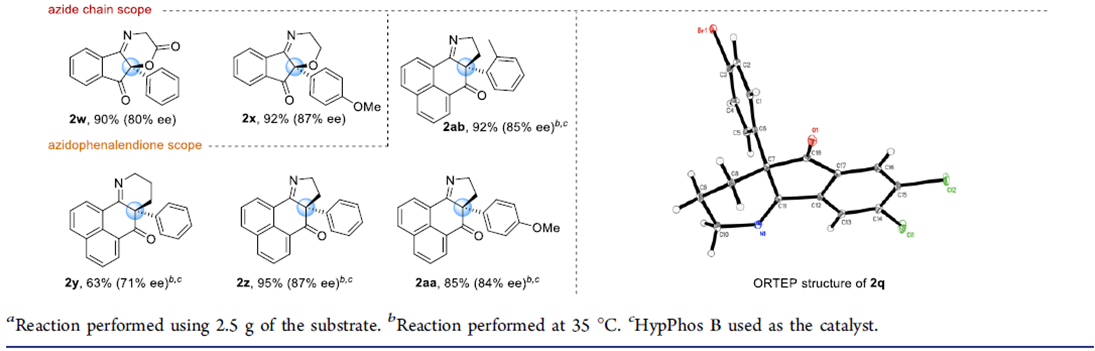
紧接着,在最优反应条件下,作者对该不对称Staudinger-aza-Wittig反应的底物范围进行了考察(Scheme 2)。将3-叠氮丙基茚二酮季碳手性中心的苯基换成各种取代的芳基、杂环以及甲基、乙基、异丙基、烯丙基、苄基、环戊基、环己基、环庚基均能较好的适应反应条件,能以良好至优秀的收率和对映选择性得到相应产物。将茚二酮部分的苯基换成萘基以及吸电子的芳基,这些底物也具有良好的耐受性,能以能以良好的收率和对映选择性得到相应产物。但将茚二酮部分的苯基换成给电子的芳基,则反应的对映选择性有所降低。叠氮链中插入醚和酯基,反应也能较好的进行。此外,通过该反应还可有效地构建四氢吡啶和二氢吡咯骨架的化合物。
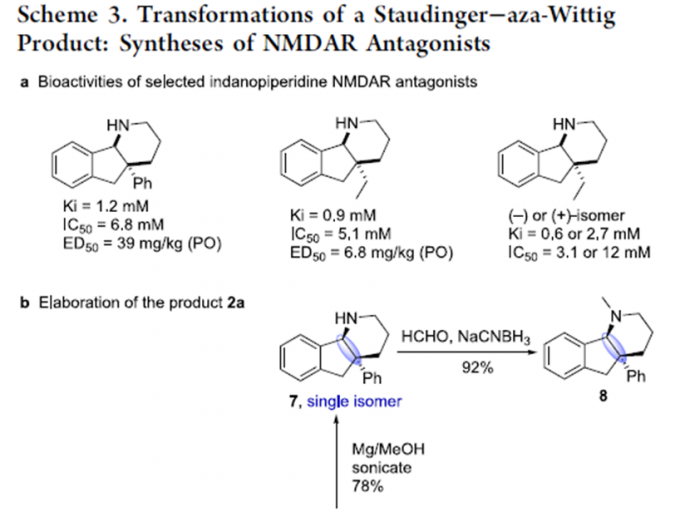
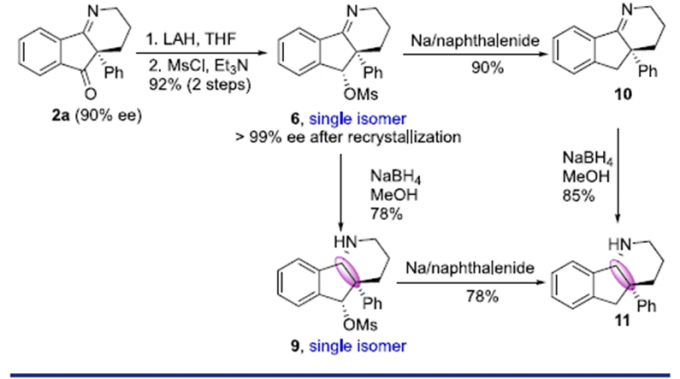
茚[1,2-b]哌啶骨架的化合物可作为N-甲基- D-天冬氨酸受体拮抗剂。因此,通过简单的衍生反应,作者可将2a转化为重要的三级胺8、亚胺10以及反式环连接的化合物11(Scheme 3)。
论文总结评价:
美国加州大学洛杉矶分校(UCLA)的Ohyun Kwon课题组报道了L-羟基脯氨酸衍生的手性磷催化剂催化3-叠氮丙基茚二酮的不对称Staudinger-aza-Wittig反应,构建六元杂环胺化合物。该方法为不对称六元杂环胺化合物的合成提供了一种新的简便的方法。
参考文献:
- Lertpibulpanya, D.; Marsden, S. P. Angew. Chem., Int. Ed. 2006, 45, 5000. DOI: 10.1002/anie.200601366
- Werner, T.; Hoffmann, M.; Deshmukh, S. J. Org. Chem. 2014, 2014, 6630. DOI: 10.1002/ejoc.201402941
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
















No comments yet.