本文作者:杉杉
导读:
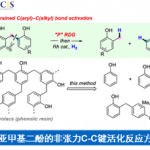
近日,西湖大学的王兆彬课题组在ACS Catalysis 中发表论文,报道一种全新的采用铬催化剂促进的烯基衍生物、烷基碘化合物与醛衍生物之间的对映选择性三组分反应方法学,进而成功完成一系列具有邻近立体中心的手性β-羟基硫醚与β-羟基硒醚分子的构建。
Cr-Catalyzed Diastereo- and Enantioselective Synthesis of β‑Hydroxy Sulfides and Selenides
X. Xia, Z. Wang, ACS Catal. 2022, ASAP. doi:10.1021/acscatal.2c03271.
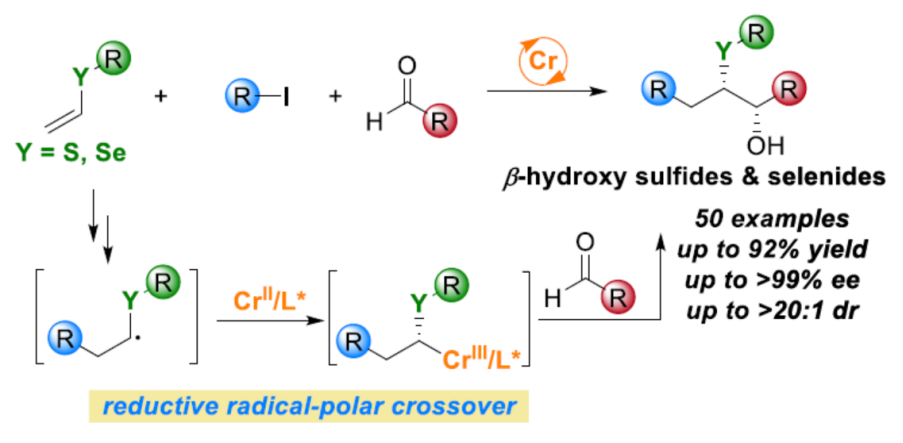
正文:
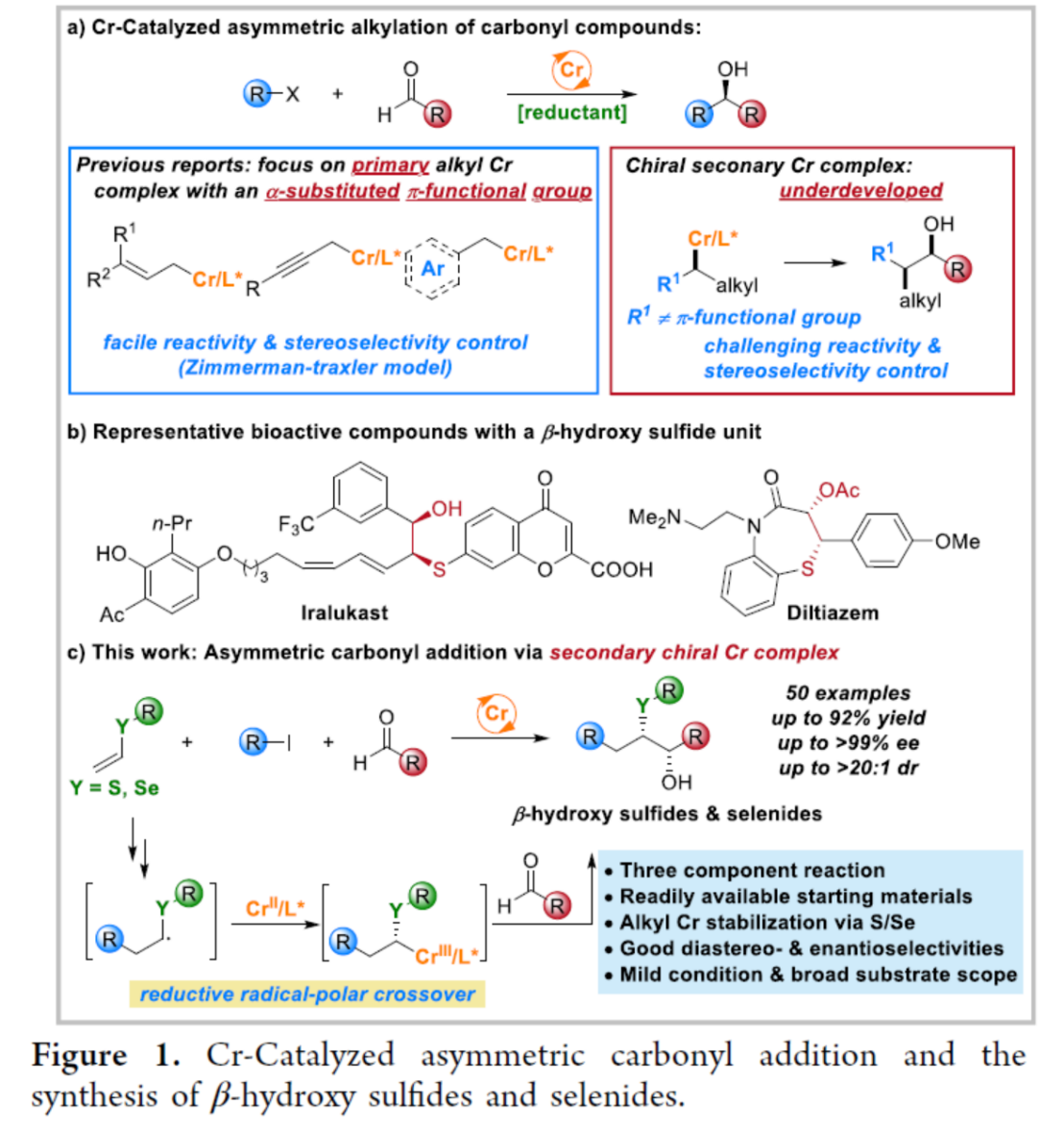
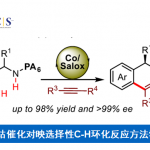
目前,铬催化的不对称羰基加成反应方法学已经成为构建碳-碳键以及各类复杂手性醇分子的重要策略 (Figure 1a)[1]-[8]。同时,作为一系列天然产物与生物活性分子中普遍存在的结构单元 (Figure 1b),手性 β-羟基硫醚[9]–[12]骨架的构建已经逐渐受到诸多研究团队的关注。这里,受到近年来对于手性β-羟基硫醚分子参与的对映选择性合成转化方法学[9]–[12]以及对映选择性羰基加成反应方法学[13]–[14]前期研究报道的启发,西湖大学的王兆彬团队成功设计出一种全新的采用铬催化剂促进的烯基衍生物、烷基碘化合物与醛衍生物之间的对映选择性三组分反应方法学 (Figure 1c)。
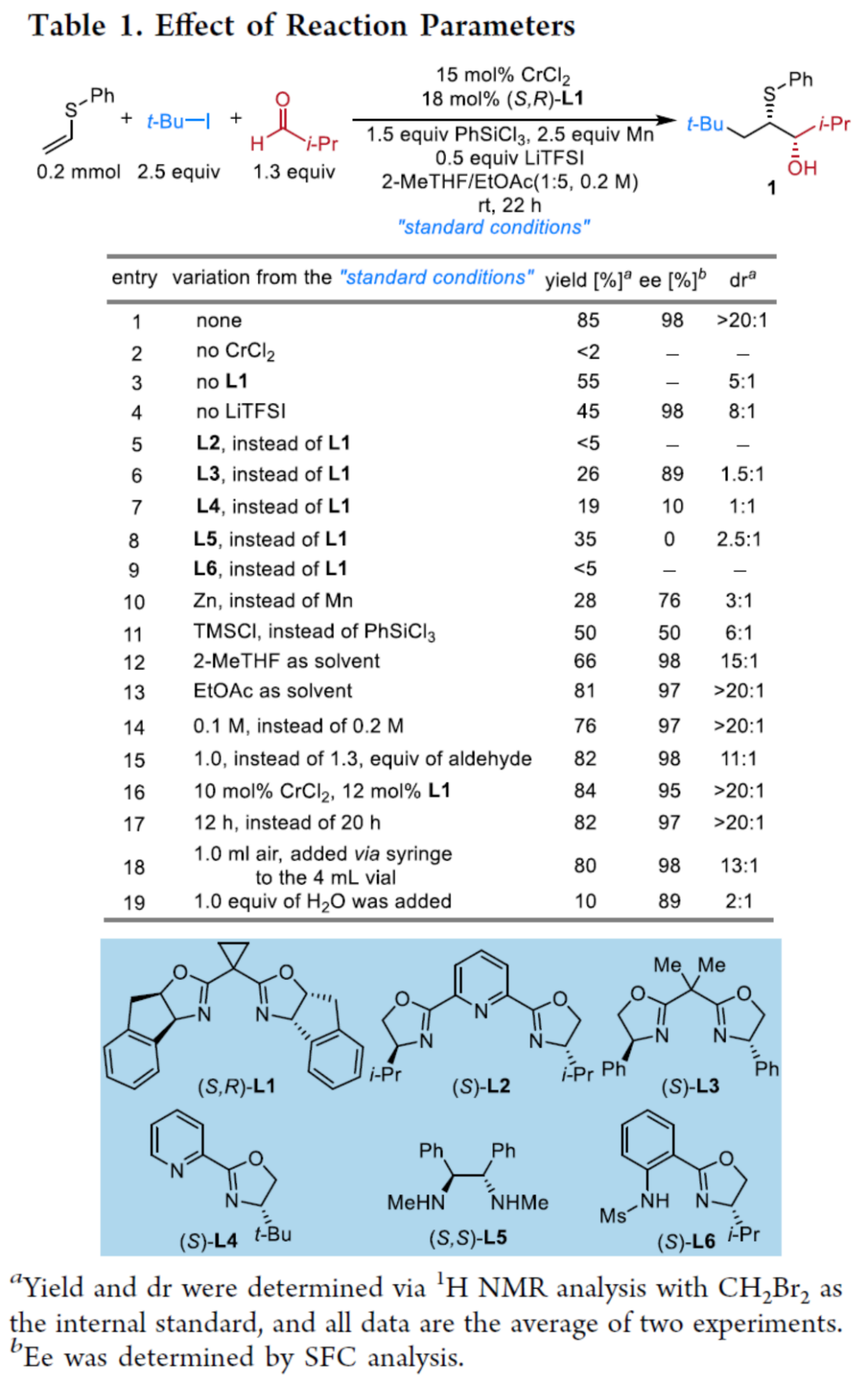
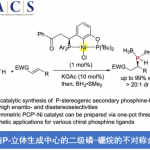
首先,作者采用苯基乙烯基硫醚、叔丁基碘与2-甲基丙醛作为模型底物,进行相关反应条件的优化筛选 (Table 1),进而确定最佳的反应条件为:采用CrCl2作为催化剂,(S,R)–L1作为手性配体,LiTFSI (lithium bis(trifluoromethanesulfonyl)imide)作为添加剂,Mn粉作为还原剂,PhSiCl3作为金属解离试剂 (dissociation reagent),在2-MeTHF/EtOAc (1:5 v/v)混合溶剂中,反应温度为室温,最终获得85%收率的手性产物1 (>20:1 dr以及98% ee)。
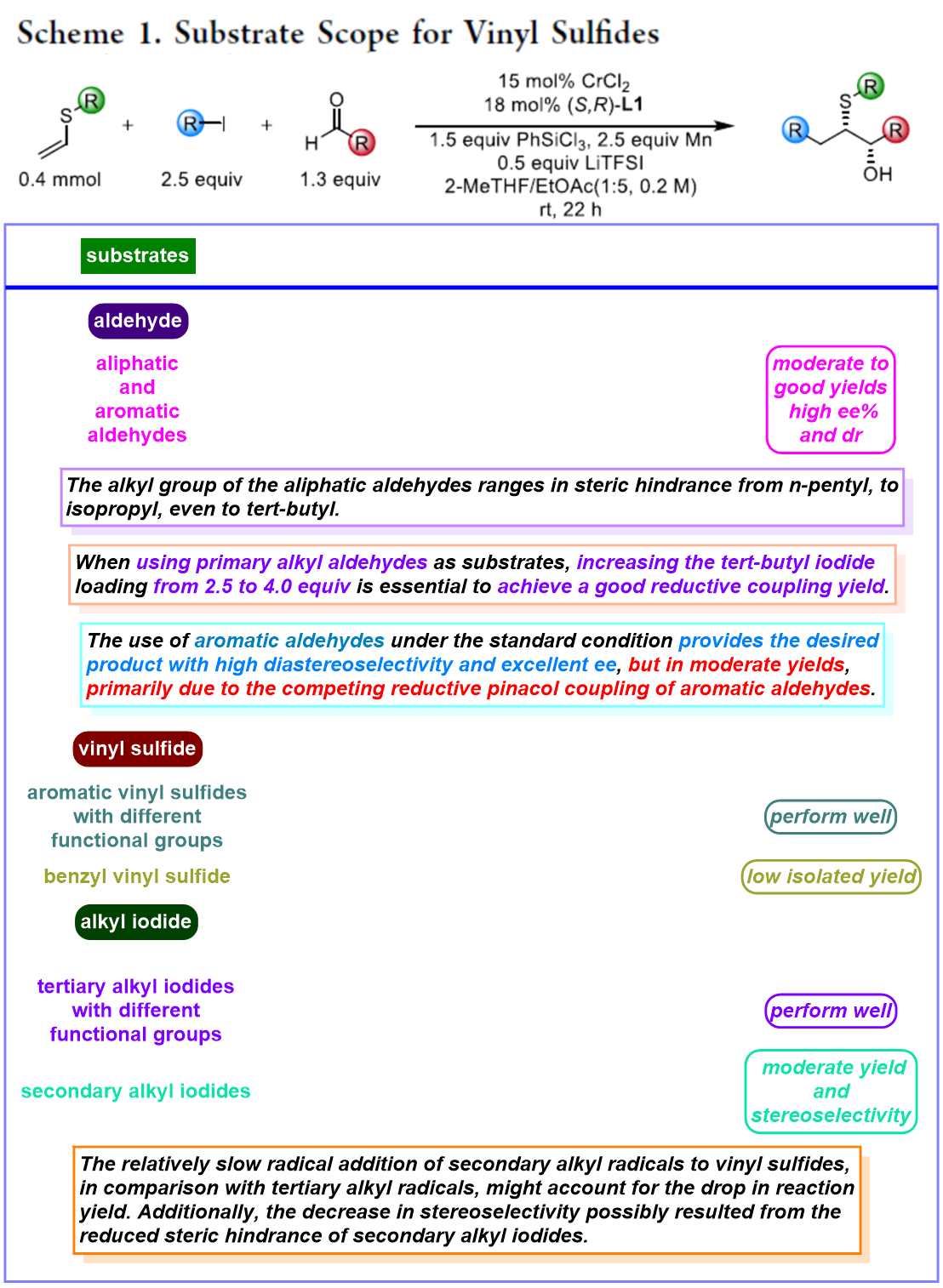
在上述的最佳反应条件下,作者分别对各类醛、烷基碘以及乙烯基硫醚(Scheme 1)的底物的应用范围进行深入研究。
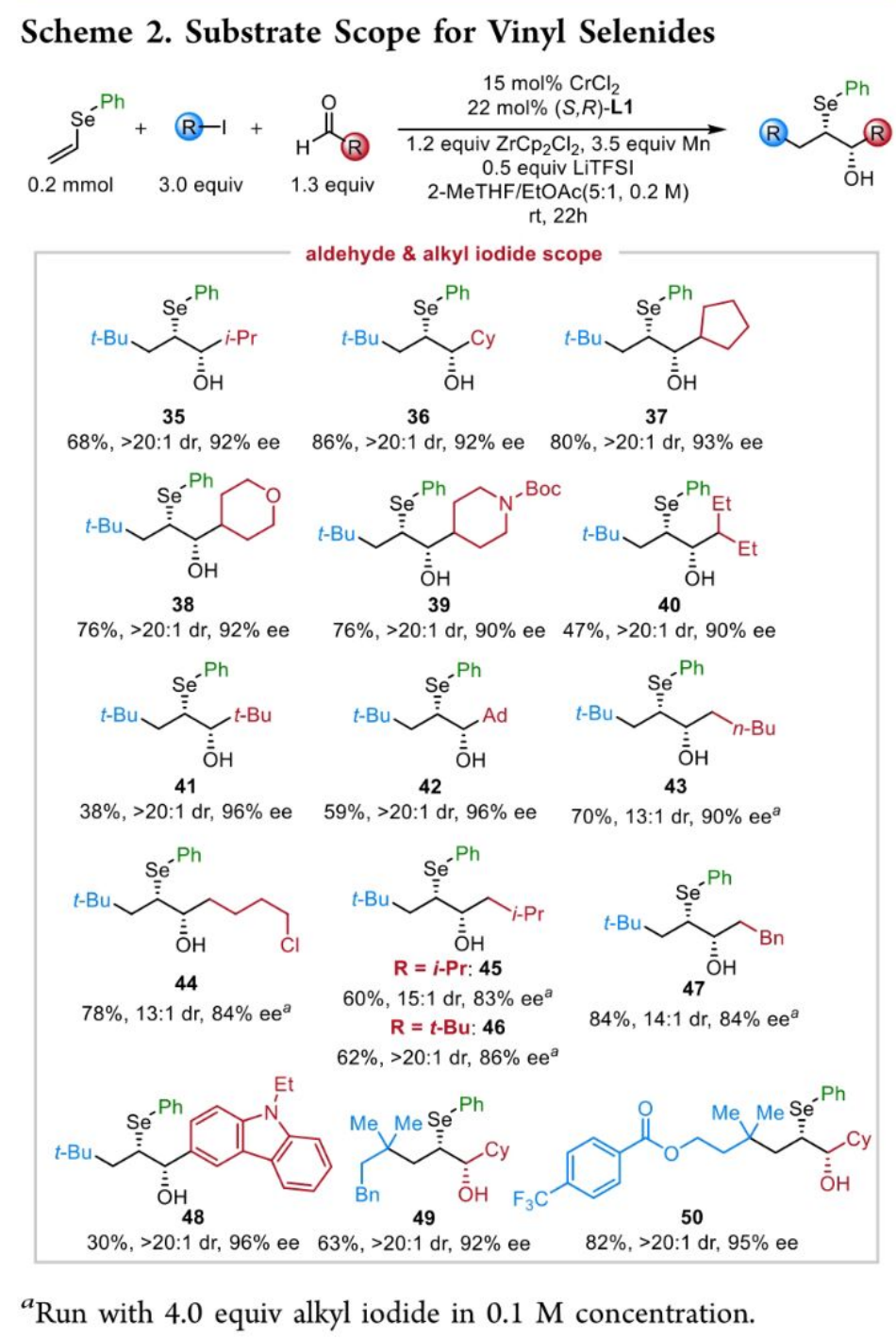
之后,该小组进一步将上述的对映选择性三组分反应策略进一步应用于一系列具有邻近立体中心的手性β-羟基硒醚分子的构建 (Scheme 2)
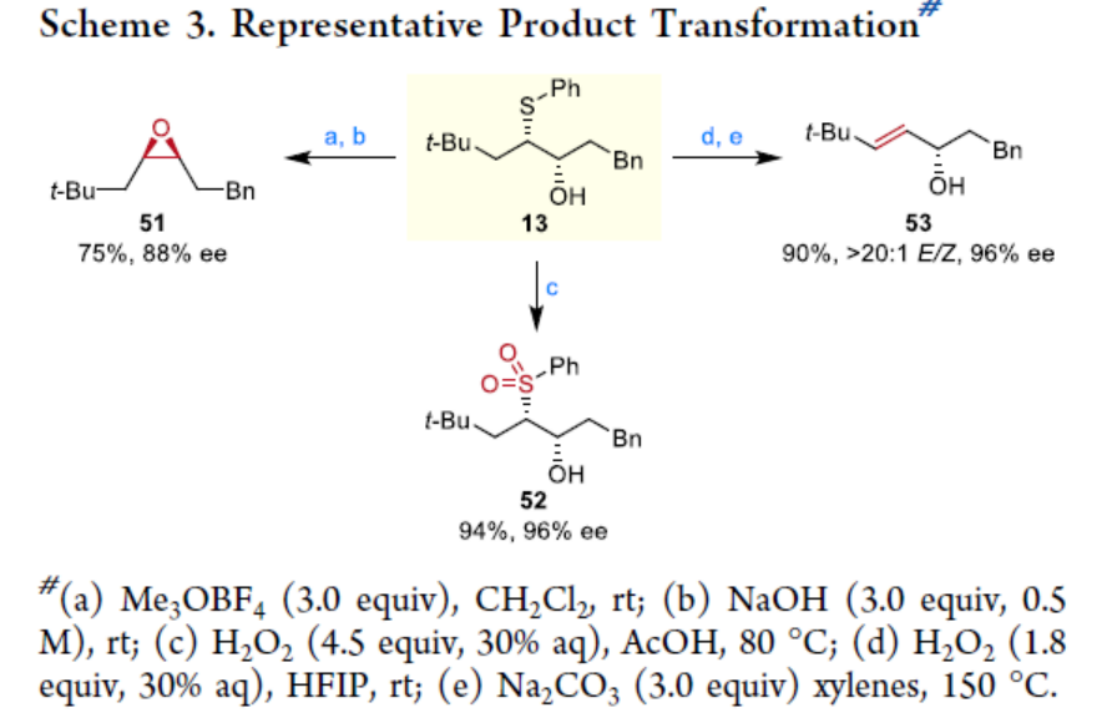
之后,该小组通过如下的一系列研究进一步表明,这一全新的不对称三组分反应策略具有潜在的合成应用价值 (Scheme 3)。
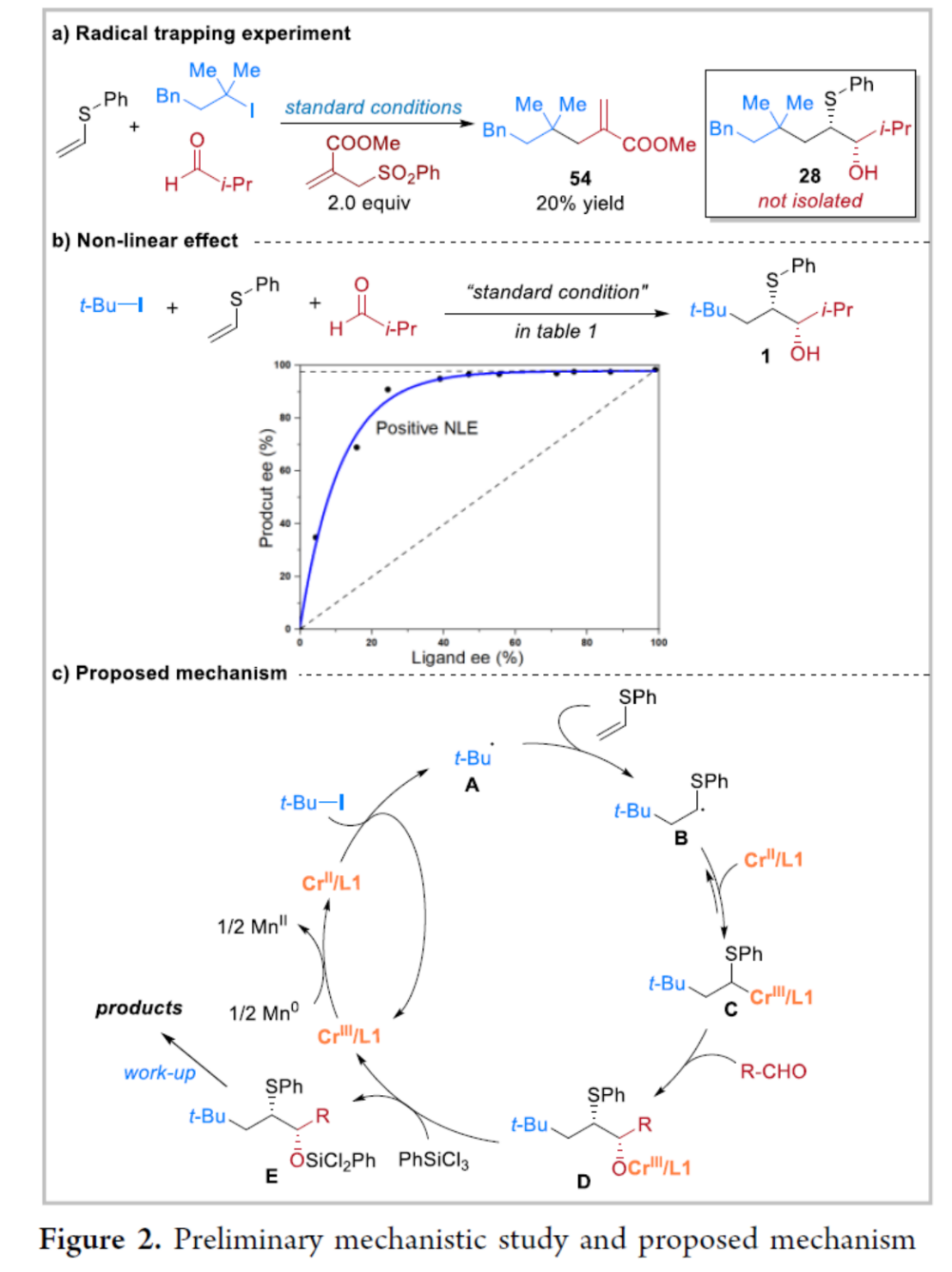
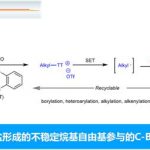
接下来,作者通过自由基捕获实验 (Figure 2a)研究表明,反应过程中可能涉及三级烷基自由基的形成。之后,该小组进一步通过非线性效应 (Figure 2b)的相关研究发现,L1的对映体纯度与相应的手性β-羟基硫醚产物之间存在(+)-NLE,作者由此推测,通过L1的两种对映体,可能会形成反应活性较低的Cr配合物。然而,通过上述研究,仍无法排除在醛的不对称烷基化步骤中涉及多个L1配体参与的可能性。基于上述的实验研究以及前期相关的文献报道[15],作者提出如下合理的反应机理 (Figure 2c)。
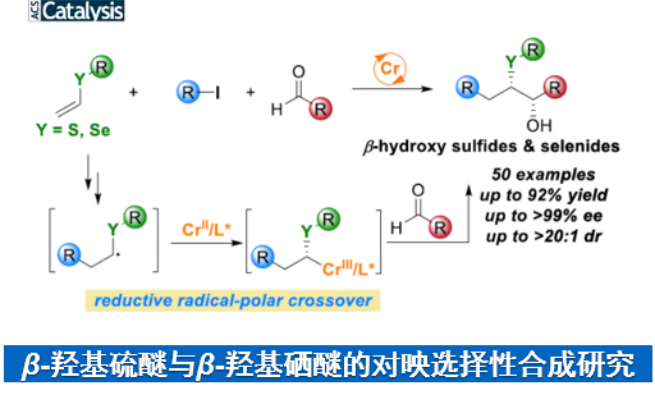
总结:西湖大学的王兆彬团队成功设计出一种全新的采用铬催化剂促进的烯基衍生物、烷基碘化合物与醛衍生物之间的对映选择性三组分反应方法学,进而成功完成一系列具有邻近立体中心的手性β-羟基硫醚与β-羟基硒醚分子的构建。这一全新的对映选择性三组分反应策略具有温和的反应条件、广泛的底物应用范围、优良的官能团兼容性以及优良的非对映与对映选择性等优势。
参考文献:
- [1] H. M. Huang, P. Bellotti, F. Glorius, Acc. Chem. Res. 2022, 55, 1135. doi:10.1021/acs.accounts.1c00799.
- [2] Y. Okude, S. Hirano, T. Hiyama, H. Nozaki, J. Am. Chem. Soc. 1977, 99, 3179. doi:10.1021/ja00451a061.
- [3] X. Liu, X. Li, Y. Chen, Y. Hu, Y. Kishi, J. Am. Chem. Soc. 2012, 134, 6136. doi:10.1021/ja302177z.
- [4] D. L. Usanov, H. Yamamoto, J. Am. Chem. Soc. 2011, 133, 1286. doi:10.1021/ja1102822.
- [5] Y. Xiong, G. Zhang, J. Am. Chem. Soc. 2018, 140, 2735. doi:10.1021/jacs.7b12760.
- [6] D. L. Usanov, H. Yamamoto, Angew. Chem., Int. Ed. 2010, 49, 8169. doi:10.1002/anie.201002751.
- [7] G. Xia, H. Yamamoto, J. Am. Chem. Soc. 2007, 129, 496. doi:10.1021/ja0679578.
- [8] J. L. Schwarz, R. Kleinmans, T. O. Paulisch, F. Glorius, J. Am. Chem. Soc. 2020, 142, 2168. doi:10.1021/jacs.9b12053.
- [9] S. Nakamura, R. Nakagawa, Y. Watanabe, T. Toru, J. Am. Chem. Soc. 2000, 122, 11340. doi:10.1021/ja0025191.
- [10] P. G. Nell, New J. Chem. 1999, 23, 973. doi:10.1039/A906179G.
- [11] M. R. Monaco, S. Prevost, B. List, J. Am. Chem. Soc. 2014, 136, 16982. doi:10.1021/ja510069w.
- [12] Y. Kawamata, T. Oriyama, Chem. Lett. 2010, 39, 382. doi:10.1246/cl.2010.382.
- [13] F. Zhang, X. Guo, X. Zeng, Z. Wang, Angew. Chem., Int. Ed. 2022, 61, e202117114. doi:10.1002/anie.202117114.
- [14] L. Pitzer, J. L. Schwarz, F. Glorius, Chem. Sci. 2019, 10, 8285. doi:10.1039/C9SC03359A.
- [15] S. Tanabe, H. Mitsunuma, M. Kanai, J. Am. Chem. Soc. 2020, 142, 12374. doi:10.1021/jacs.0c04735.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载











No comments yet.