北海道大学的谷野课题组实现了具有独特稠环结构的BrasilicardinA-D的网罗全合成。通过三次分子内共轭加成实现了高立体选择性的三缩环共通中间体是本全合成的关键。
Brasilicardin A-D
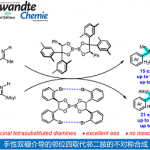
Brasilicardin A-D(1)、是从放射性病原菌Nocardia brasiliensis的培养液中分离、结构已经被确定的二帖类化合物(图1A)[1]。Brasilicardin A(1a)具有很强的免疫抑制作用,由于作用机理与现有的免疫抑制剂不同,因此作为新型免疫抑制剂的lead compound,一直受到高度关注。 但是,跟天然产物一样,从自然中获取的量非常有限,因此导致其药理方面的研究很迟缓。另外,1具有anti-syn-anti稠环全氢菲骨架(ABC环),可以与氨基酸与糖结合,因此不仅仅是生物活性,从化学结构上也是非常unique的。
到目前为止已经报道了几种部分合成的实例[2]、而全合成仅仅只有2017年穴田课题组报道的一个例子[3]。他们将从Wieland-Miescher酮转换的亲双烯通过Diels-Alder反应构建了复杂的ABC环(图1B)。然后,对于在合成终盘的糖基化那步,由于选择性脱保护比较困难、因此C2位的羟基在早期就事先导入,最终实现1a, 1c的全合成。
这次北海道大学的谷野、吉村等人、计划在合成终盘通过对共通中间体2实现氨基酸的位置,实现对1的网罗全合成。本全合成的关键中间体2的ABC环、作者计划以新戊二醇(6)为原料经过10步先合成化合物5,然后经过三次立体选择性的分子内共轭加成反应获得(图1C)。
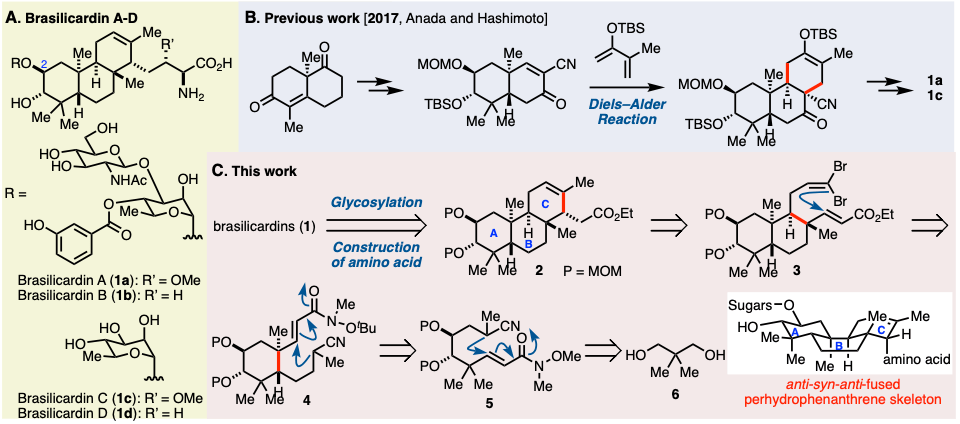
图1. (A)Brasilicardin A-D (B) 穴田合成法 (C) 逆合成分析
“Asymmetric Total Synthesis of Brasilicardins”
Yoshimura, F.; Itoh, R.; Torizuka, M.; Mori, G.; Tanino, K.Angew. Chem., Int. Ed.2018,57, 17161.
论文作者介绍

研究者:谷野圭持
经历:
1987 东京工业大学大学院理工学研究科化学专业硕士学位(桑島功教授)
1989 东京工业大学大学院理工学研究科化学专业博士中退
1989 东京工业大学理学部化学科助手
1994 东京工业大学博士学位(理学)
1998 北海道大学大学院理学院化学专业助手
1999 北海道大学大学院理学研究科化学专业助理教授
2006- 北海道大学大学院理学研究院化学部门教授
研究内容:有机金属或者过渡金属催化的新反应开发、天然产物全合成

研究者:吉村文彦
经历:
2002 东北大学大学院理学研究科博士学位(平間正博教授)
2002 美国斯隆-凯特琳研究所博士后
2004 北海道大学大学院理学研究科助手
2007 北海道大学大学院理学研究院助理教授
2017- 静冈县立大学药学部副教授
研究内容:复杂结构的生物活性天然产物全合成、新反应的开发
论文概要
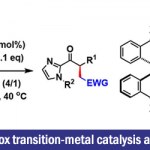
作者等人、计划通过 (1: 构建A, B环) 两次对α,β-不饱和Weinreb酰胺的α-Cyano carbanions的共轭加成、(2: 构建C环) 对α,β-不饱和酯的乙烯基铜的共轭加成,这两个分子内反应来构建ABC稠环(图2)。
对于反应(1)、虽然作者担心过底物的反应性低、但是使用NaHMDS作为碱可以形成稳定的鳌合中间体7,使得反应很高效的进行。此外,在环A的构建中,通过采该螯合作用可以避免产生发生偶极排斥的构象,使得反应得以高立体选择性地进行。另一方面,对于B环的构建,通过使用具有更大位阻取代基取代的Weinreb酰胺来控制生成物的立体选择性。对于C环的构建(2)、作者等人参考了2006年开发的使用有机铜催化剂对1,1-二溴烯烃进行的环化的方法[4]。在饭厅体系中产生乙烯基铜之后、升温进行与α,β-不饱和酯的分子内共轭加成,得到全合成目标产物们的共同中间体2。详细可以具体翻阅论文。通过对共同中间体2,在合成终盘进行氨基酸部位与糖的位置,立体选择性的导入最终实现了Brasilicardin A-D(1)的全合成。
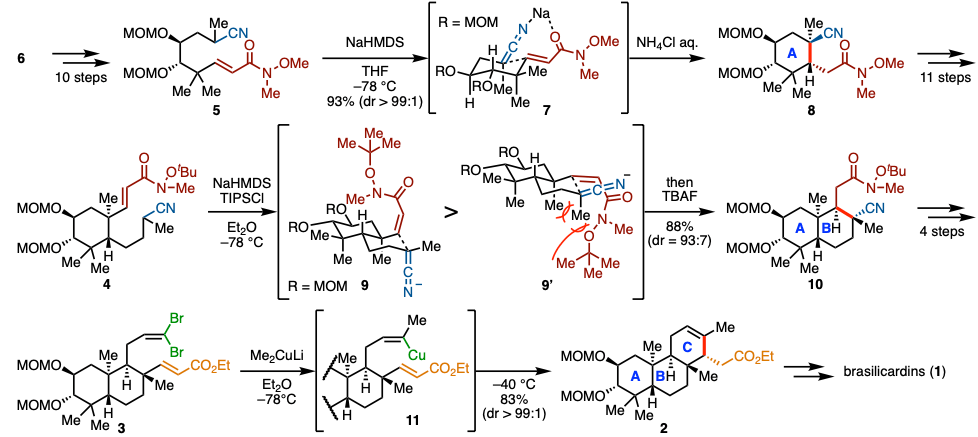
图2. 共同中间体3的合成
综上所述、作者从市售的原料6出发、通过37-42步的反应,实现了Brasilicardin A-D的全合成。很期待,通过这项全合成研究可以加速该类天然产物的药理活性的研究。
参考文献
- (a) Shigemori, H.; Komaki, H.; Yazawa, K.; Mikami, Y.; Nemoto, A.; Tanaka, Y.; Sasaki, T.; In, Y.; Ishida, T.; Kobayashi, J. Org. Chem.1998, 63, 6900. DOI: 10.1021/jo9807114(b) Komatsu, K.; Tsuda, M.; Shiro, M.; Tanaka, Y.; Mikami, Y.; Kobayashi, J. Bioorg. Med. Chem. 2004, 12, 5545. DOI:10.1016/j.bmc.2004.08.007
- (a) Jung, M. E.; Chamberlain, B. T.; Koch, P.; Niazi, K. R. Lett. 2015, 17, 3608–3611. DOI:10.1021/acs.orglett.5b01712(b) Coltart, D. M.; Danishefsky, S. J. Org. Lett. 2003, 5, 1289. DOI: 10.1021/ol034213f(c) Jung, M. E.; Koch, P. Org. Lett. 2011, 13, 3710. DOI: 10.1021/ol2013704(d) Jung, M. E.; Perez, F.; Regan, C. F.; Yi, S. W.; Perron, Q. Angew. Chem., Int. Ed. 2013, 52, 2060. DOI: 10.1002/anie.201208294
- Anada, M.; Hanari, T.; Kakita, K.; Kurosaki, Y.; Katsuse, K.; Sunadoi, Y.; Jinushi, Y.; Takeda, K.; Matsunaga, S.; Hashimoto, S. Lett. 2017, 19, 5581. DOI: 10.1021/acs.orglett.7b02728
- Tanino, K.; Arakawa, K.; Satoh, M.; Iwata, Y.; Miyashita, M. Tetrahedron Lett. 2006, 47, 861. DOI: 1016/j.tetlet.2005.12.002
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.