作者:石油醚
导 读
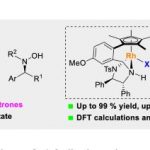
近日,上海师范大学的赵宝国教授课题组基于羰基催化策略,利用发展的手性吡哆醛催化剂,首次实现实现了手性吡哆醛催化剂活化苄胺α位的C-H键,以达到无保护的苄胺对于芳基醛的不对称加成反应,一步得到高非对映选择性和优秀对映选择性的β-氨基醇产物。文章发表于Nature Catalysis上
“Catalytic asymmetric α C(sp3)–H addition of benzylamines to aldehydes.
Chengkang Hou, Bingfei Peng, Shen Ye , Zeyang Yin, Jing Cao, Xiao Xiao & Baoguo Zhao*
Nat. Catal., 2022, 5, 1061-1068, doi: 10.1038/s41929-022-00875-3”
正文:
手性胺是一类非常重要的化合物,在医药、天然产物、精细化学品、材料、催化等领域都有广泛应用,发展手性胺的高效构建新策略有重要意义。简单伯胺,如苄胺,是一类易得的化工原料,其a C–H键的直接官能团化是合成手性胺的高效新策略。但该反应面临两个巨大挑战:伯胺的NH2基团反应活性高,严重干扰转化;苄胺的a C–H键酸度极低(pKa ~ 42.7),难以活化。羰基催化能促进伯胺α C–H键的直接不对称转化,是一种受生物过程启发的新型催化模式,已被成功地应用于甘氨酸酯的不对称仿生Mannich反应、仿生Aldol反应、α-C Michael加成反应和α-C烯丙基化等反应。然而,到目前为止,该策略主要局限于含有强吸电子基团的活化伯胺,例如α-氨基酸酯(pKa~24)、(2-吡啶基)甲胺等。对于惰性伯胺如苄胺的a C-H键的转化还未发展。
近日,上海师范大学赵宝国教授课题组以仿生的手性吡哆醛为催化剂,运用羰基催化的策略,突破苄胺a C–H键的反应惰性,无需对NH2基团进行保护,在温和条件下实现苄胺a C–H键对醛的不对称加成,高效构建重要化合物手性β-氨基醇。相关成果发表于Nature Catalysis上,第一作者为侯承康博士。
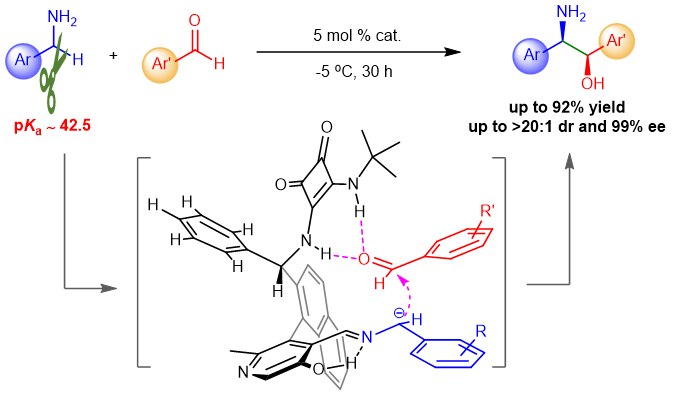
图1. 摘要。图片来源: Nat. Catal.
首先作者合成并筛选了一系列含有不同侧链的手性吡哆醛催化剂,发现方酸侧链在反应中对于非对映选择性的控制起着重要的作用,最后确定含有方酸侧链的催化剂(R,R)-1a为最优催化剂。紧接着对反应条件进行了筛选,发现甲苯与二氯甲烷的混合溶剂对反应的效果最好,其中二氯甲烷的作用是使催化剂能溶解于体系中,便于反应的进行。引入额外的干燥剂如Na2SO4可以大大提高反应效率,可能是因为少量的水可以淬灭活性α-氨基碳负离子中间体,不利于转化。
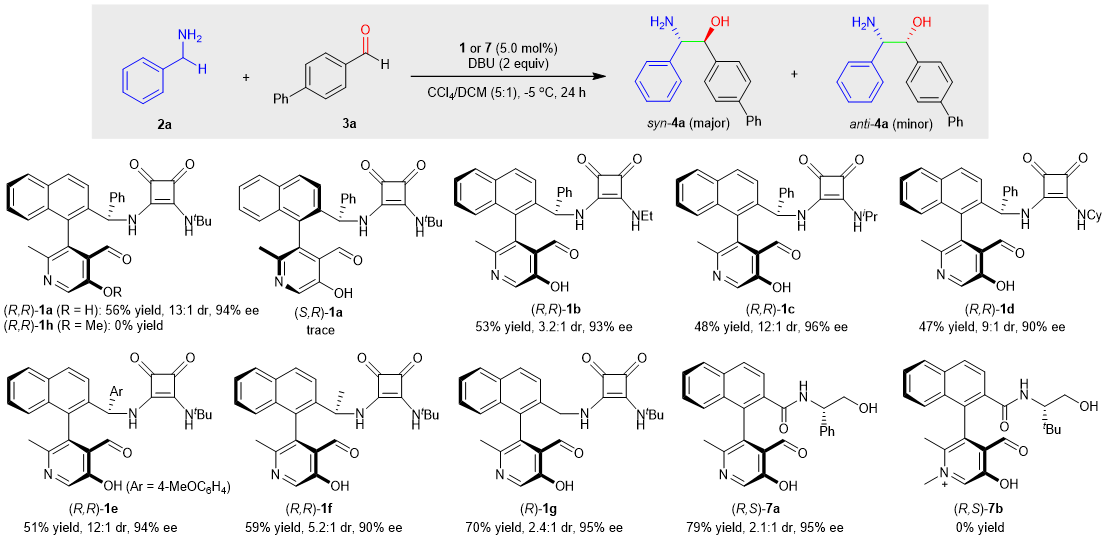
图2. 催化剂筛选。图片来源: Nat. Catal.
在最优条件下,作者对底物范围进行了考察,结果显示无论是含有吸电子基团,供电子基团,卤素,杂环,还是稠环和多取代基团的苄胺类和芳基醛类底物均能很好的适应该反应,以较好的收率和优秀的非对映选择性和对映选择性获得一系列手性β-氨基醇产物(42-92% 收率,最高>20:1 dr和88-99% ee)。其中通过分析β-氨基醇产物4ae的单晶衍射实验数据,作者确定了产物的绝对构型为(R,R)。通过核磁判定,在大多数反应体系中,苄胺2与芳基醛3都在缓慢的形成亚胺,该亚胺底物在标准反应条件下是无活性的,当反应体系中的游离醛消失时,反应即终止。
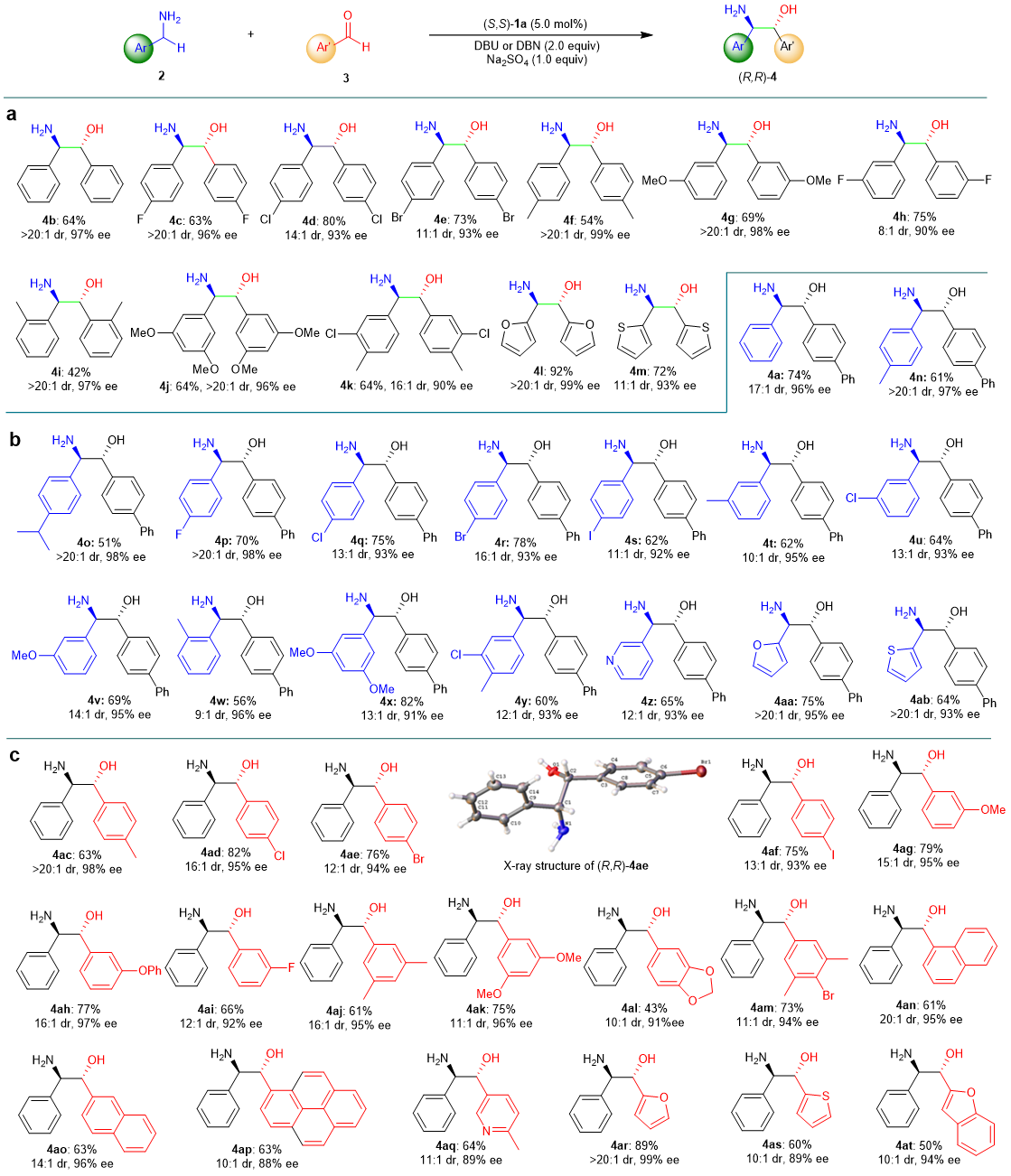
图3. 底物拓展。图片来源: Nat. Catal.
接下来,作者对反应的合成应用也进行了研究。首先可以通过该反应有效的实现克级规模β-氨基醇的制备。然后该反应也可以快速有效的构建结构复杂的生物活性小分子,例如AM-8735,一种吗啉酮抑制剂,或者拮抗剂MGluR5 PAM。
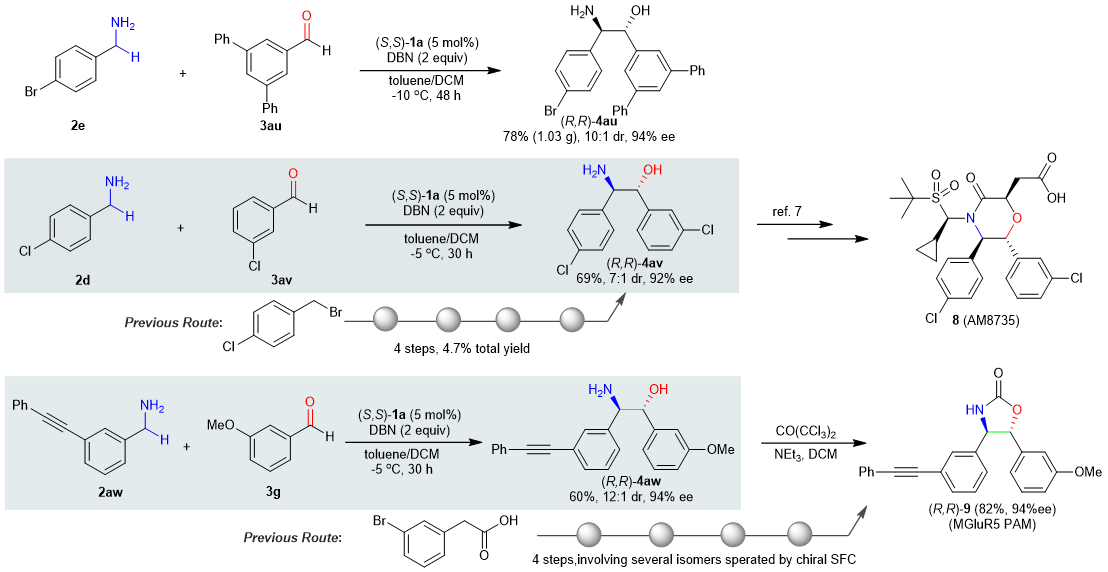
图4. 合成应用。图片来源: Nat. Catal.
最后,作者对于该反应的机理进行了深入的研究,认为该反应是经历了羰基催化的过程。首先催化剂1a通过与芳基甲胺缩合形成亚胺10,活化芳基甲胺α C-H键,使得苄位C-H键酸性显著增强(计算化学研究表明该 C–H键的pKa值由42.7提高到24.4,酸性提高了10的18次方倍)。然后亚胺10的苄位C-H键在DBU碱的作用下去质子化,生成稳定的α-氨基碳负离子中间体11,与芳基醛3进行不对称加成反应并随后水解生成β-氨基醇4,释放出催化剂1a,以完成整个催化反应循环。在该反应过程中,吡哆醛上的酚OH倾向于与亚胺形成分子内氢键,以促进催化剂1a与芳基甲胺2的结合,对酚OH进行甲基化后,催化剂1h完全无催化反应活性验证了该结论。同时分子内的氢键有利于限制α-氨基碳负离子中间体11亚胺部分的旋转,有利于增强对非对映选择性的控制。作者通过研究动力学实验,发现该反应出现了明显的同位素效应(KIE=7.4),判定出在DBU碱的作用下,亚胺10去质子化的步骤为该反应的决速步,同时芳基甲胺与芳基醛的Hammett曲线斜率也证明了该结论的可靠性。随后作者发现催化剂侧链方酸NH基团的部分或者全部甲基化对反应的收率,非对映选择性和对映选择性具有较大的影响,推测出侧链NH基团是通过双氢键作用对芳基醛进行活化和并定向。
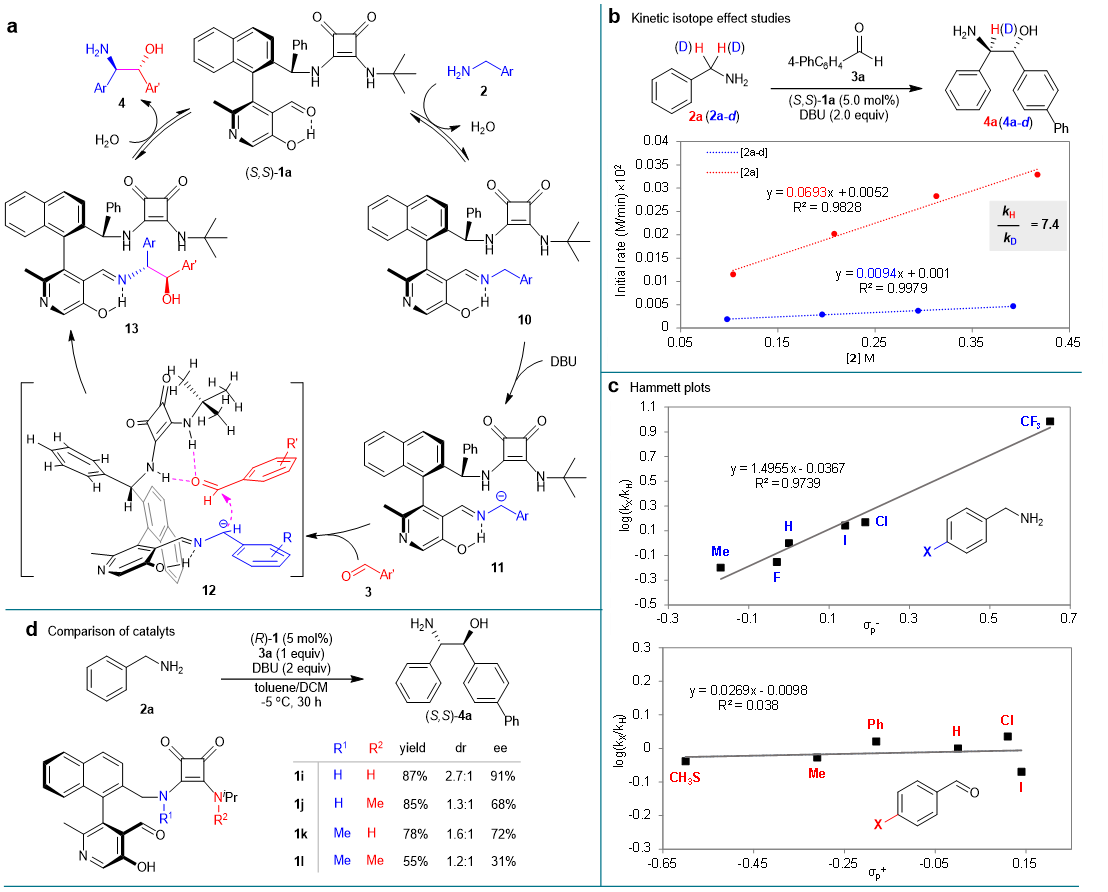
图5. 机理研究。图片来源: Nat. Catal.
综上,该研究工作不仅提供了重要化合物β-氨基醇的高效构建新方法,进一步发展了羰基催化化学,还拓展了维生素B6核心骨架在仿生不对称催化中的应用。
该工作得到了教育部、国家自然科学基金委、上海市教科委、上海师范大学、上海市仿生催化前沿科学研究基地等的资金支持。
论文链接:https://doi.org/10.1038/s41929-022-00875-3
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载
















No comments yet.