作者:石油醚
导读:
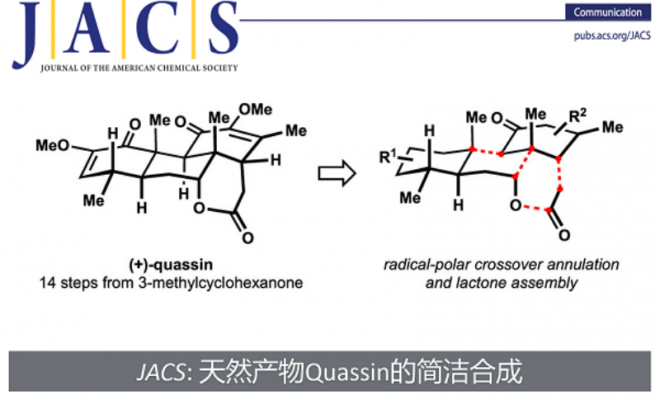
近日,美国University of California-Irvine的Sergey V. Pronin团队在J. Am. Chem. Soc上,以 “Concise Enantioselective Approach to Quassinoids” 为题,报道了通过14步完成了(+)-quassin(1)简洁全合成路线设计。其中关键步骤涉及经氢原子转移(HAT)介导的串联环化反应构建三碳环核心骨架。
A Concise Enantioselective Approach to Quassinoids
P. Thomas, S, V. Pronin,J. Am. Chem. Soc.2022,144,118. doi: 10.1021/jacs.1c12283.
正文:
天然产物Quassinoids是从一类从苦木科(Simaroubaceae)植物中分离出来的萜类天然产物 (Figure 1)[1],并且其表现出对不同癌细胞系的细胞毒性以及对恶性疟原虫耐药菌株的抗疟活性[2-4]。近日,美国University of California-Irvine的Sergey V. Pronin教授报道了通过14步完成了(+)-quassin(1)简洁全合成路线设计。其中关键步骤涉及经氢原子转移(HAT)介导的串联环化反应构建三碳环核心骨架。
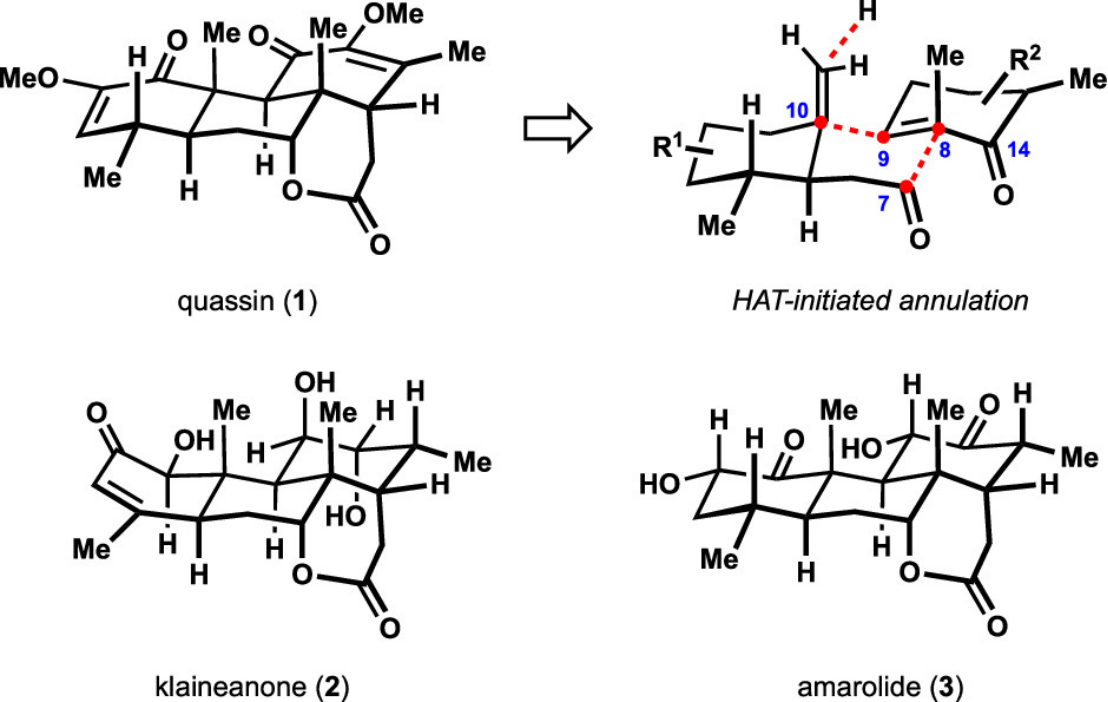
Figure 1. Representative quassinoids and our approach to the common polycyclic motif.
(图片来源于J. Am. Chem. Soc)
首先,作者进行了γ,δ-不饱和醛(4)构建,如图Figure 2所示。
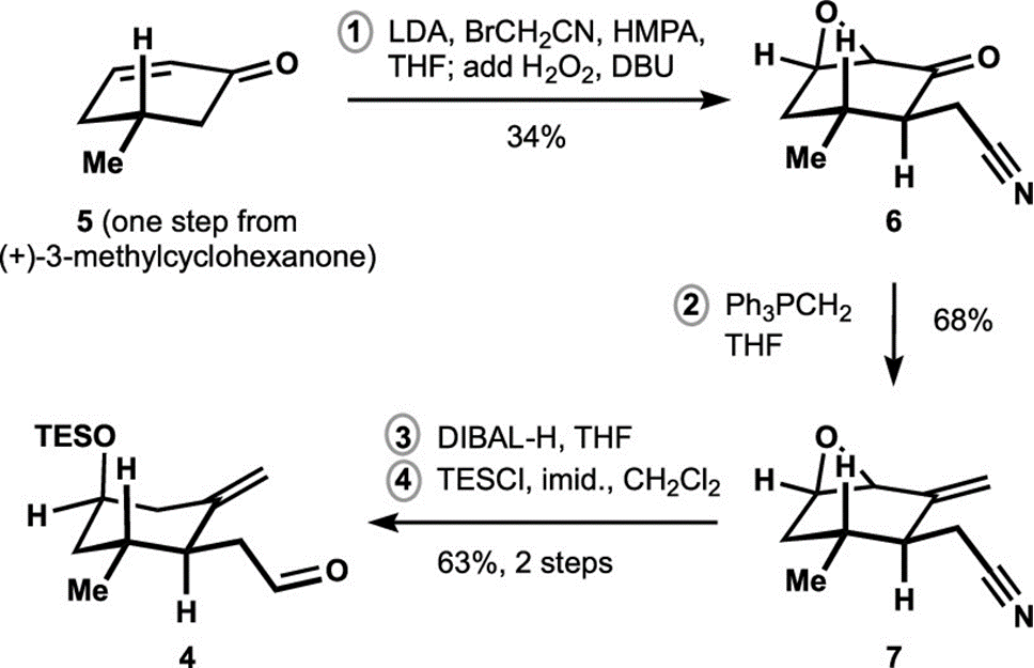
Figure 2. Synthesis of γ,δ-Unsaturated Aldehyde 4
(图片来源于J. Am. Chem. Soc)

其次,作者进行了不饱和酮(8)的构建,如图Figure 3所示。
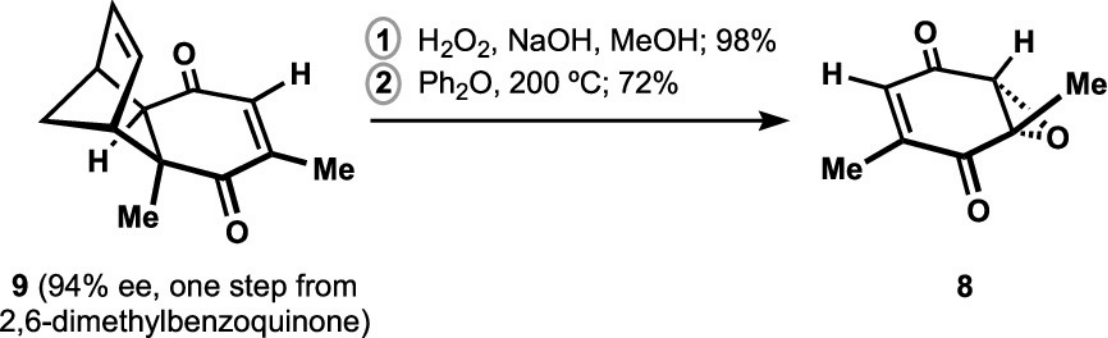

Figure 3. Synthesis of Epoxyquinone 8
(图片来源于J. Am. Chem. Soc)
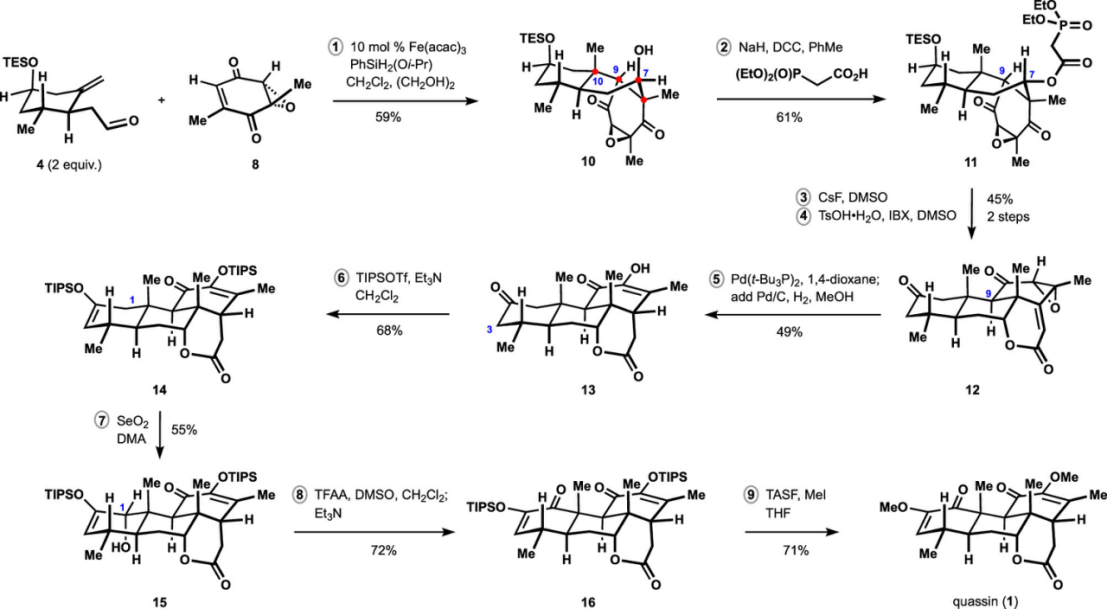
Figure 4. Synthesis of (+)-Quassin (1)

总结,Sergey V. Pronin团队在J. Am. Chem. Soc上,以 “Concise Enantioselective Approach to Quassinoids” 为题,报道了通过14步完成了(+)-quassin(1)简洁全合成路线设计。其中关键步骤涉及经氢原子转移(HAT)介导的串联环化反应构建三碳环核心骨架。
参考文献:
- [1] (a) Z. Guo, S. Vangapandu, R. W. Sindelar, L. A. Walker, R. D. Sindelar, Curr. Med. Chem. 2005, 12, 173. doi: 10.2174/0929867053363351. (b) G. Fiaschetti, M. A. Grotzer, T. Shalaby, D. Castelletti, A. Arcaro, Curr. Med. Chem. 2011, 18, 316. doi: 10.2174/092986711794839205.
- [2] S. M. Kupchan, R. W. Britton, J. A. Lacadie, M. F. Ziegler, C. W. Sigel, J. Org. Chem. 1975, 40, 648. doi: 10.1021/jo00893a023.
- [3] E. Mata-Greenwood, M. Cuendet, D. Sher, D. Gustin, W. Stock, J. M. Pezzuto, Leukemia 2002, 16, 2275. doi: 10.1038/sj.leu.2402696.
- [4] M. Cuendet, J. J. Gills, J. M. Pezzuto, Cancer Lett. 2004, 206, 43. doi: 10.1016/j.canlet.2003.11.011.
- [5] D. Liu, E. Canales, E. J. Corey, J. Am. Chem. Soc. 2007, 129, 1498. doi: 10.1021/ja068637r.
- [6] K. Alder, F. H. Flock, H. Beumling, Chem. Ber. 1960, 93, 1896. doi: 10.1002/cber.19600930830.
- [7] C. Obradors, R. M. Martinez, R. A. Shenvi, J. Am. Chem. Soc. 2016, 138, 4962. doi: 10.1021/jacs.6b02032.
- [8] M. Suzuki, Y. Oda, R. Noyori, J. Am. Chem. Soc. 1979, 101, 1623. doi: 10.1021/ja00500a058.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载


























No comments yet.