导读:
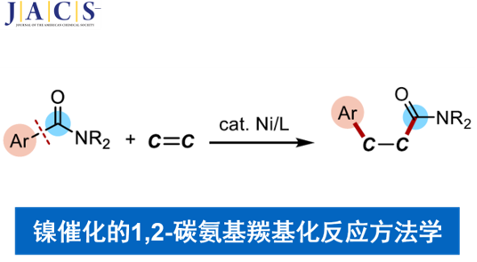
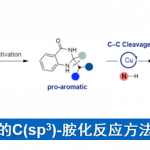
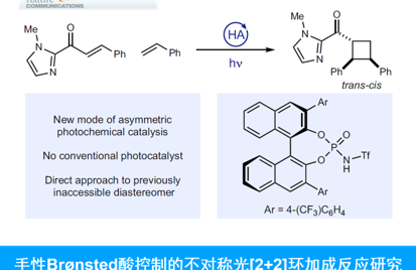
近日,日本Osaka大学的Tobisu Mamoru (鳶巣 守 )课题组在J. Am. Chem. Soc.中发表论文,报道一种全新的镍催化N-芳酰基吲哚分子中C-C键与张力烯基化合物之间的1,2-碳氨基羰基化反应 (1,2-carboaminocarbonylation)反应方法学,进而以100%的原子经济性成功实现一系列张力烯基化合物的双重碳官能团化(dicarbofunctionalization)。
Nickel-Catalyzed Addition of C−C Bonds of Amides to Strained Alkenes : The 1,2-Carboaminocarbonylation Reaction
Y. Ito, S. Nakatani, R. Shiraki, T. Kodama, M. Tobisu, J. Am. Chem. Soc. 2022, ASAP. Doi:10.1021/jacs.1c09265.
正文
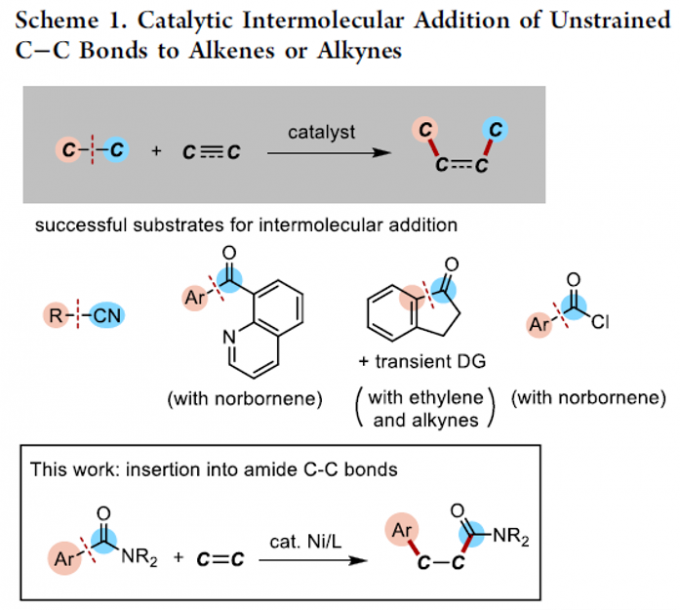
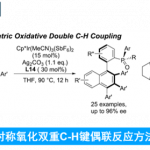
碳-碳键广泛存在于一系列不同类型的有机分子中。尽管C-C键断裂反应方法学的相关研究已经取得诸多进展[1],然而,对于C-C键与烯基或炔基化合物之间的催化加成反应方法学的研究,则极少有相关的文献报道(Scheme 1) [2]-[5]。这里,M. Tobisu课题组报道一种全新的采用镍催化剂参与的N-芳酰基吲哚分子中C(aryl)-C(=O)键与烯基化合物之间的1,2-碳氨基羰基化反应方法学。
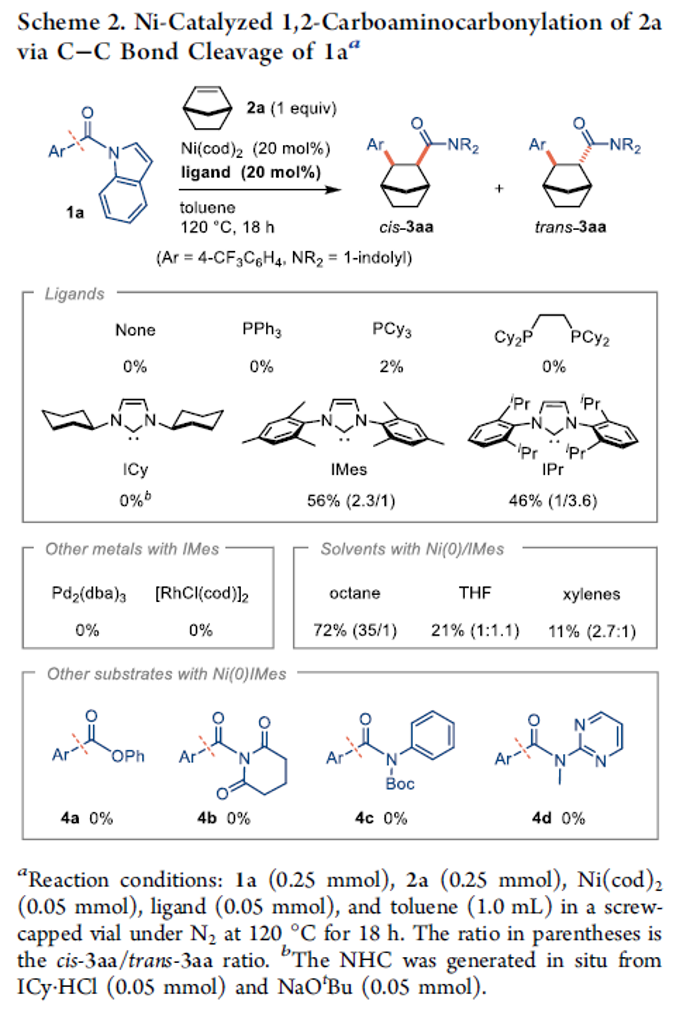
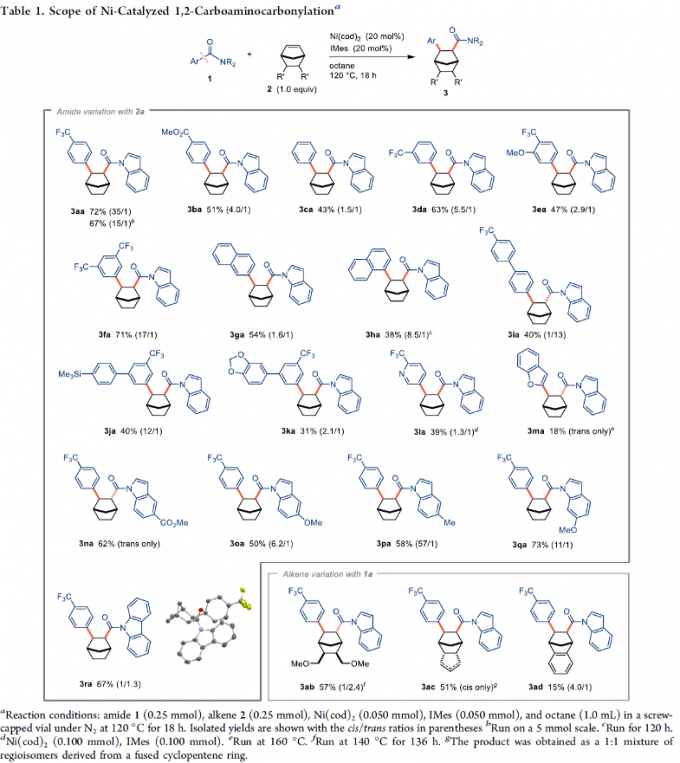
首先,作者采用N-芳酰基吲哚1a与降冰片烯2a作为模型底物,进行相关反应条件的优化筛选 (Scheme 2)。进而确定最佳的反应条件为:采用Ni(cod)2作为催化剂,IMes作为NHC配体,正辛烷作为反应溶剂,反应温度为120oC,并以优良的cis-选择性 (cis/trans = 35/1)与良好的反应收率,获得相应的1,2-碳氨基羰基化产物3aa。
在上述的最佳反应条件下,作者首先对各类N-芳酰基吲哚底物应用范围进行考察 (Table 1)。研究发现,苯环中不同位置具有吸电子基团取代的酰胺底物,均能够获得较高收率的1,2-碳氨基羰基化产物3aa-3fa。同时,该小组发现,上述的标准反应条件对于苯环中具有甲硅烷基(3ja)、乙缩醛基团 (3ka)以及杂环芳基 (3la与3ma)基取代的酰胺底物,能够有效地兼容。之后,该小组发现,上述的标准反应体系对于吲哚环中存在的一系列不同类型的官能团,同样能够良好地兼容,并获得相应的目标产物3na–3qa。之后,作者发现,向吲哚环中引入烷氧羰基,能够显著改变上述1,2-碳氨基羰基化反应过程的立体选择性,进而立体专一性地获得相应的trans-异构体 (3na)。
同时,该小组进一步通过相关的DFT计算以及通过立体化学纯产物cis-3ga 以及trans-3ga异构化实验的相关研究表明,trans-异构体具有更高的稳定性。同时,cis-异构体为动力学有利的反应产物,之后,通过Lewis碱 (例如IMes)促进的异构化过程,形成更加稳定的trans-异构体。
之后,作者进一步对一系列烯基底物的应用范围进行考察。研究表明,上述的标准反应体系仅能够应用于具有显著张力的烯基化合物,并获得相应的1,2-碳氨基羰基化产物3ab–3ad。同时,该小组进一步发现,这一全新的1,2-碳氨基羰基化策略,同样能够有效地进行相应的克级规模转化,并获得良好反应收率的目标分子 (1.28 g3aa,67%反应收率)。
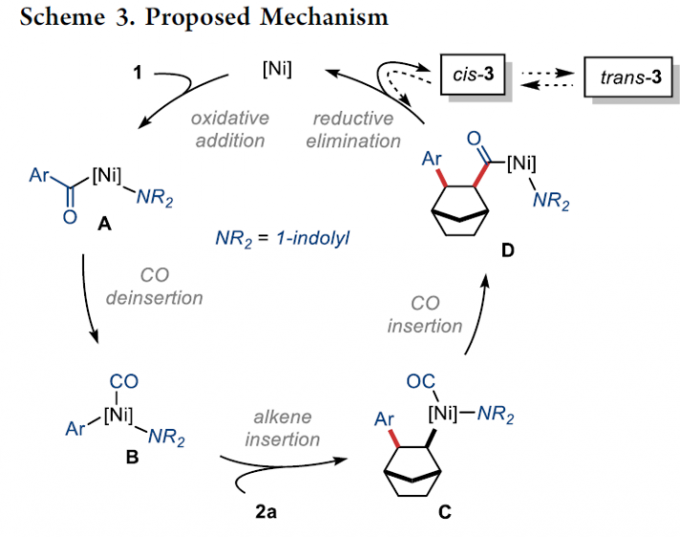
接下来,作者提出如下合理的反应机理路径 (Scheme 3)。
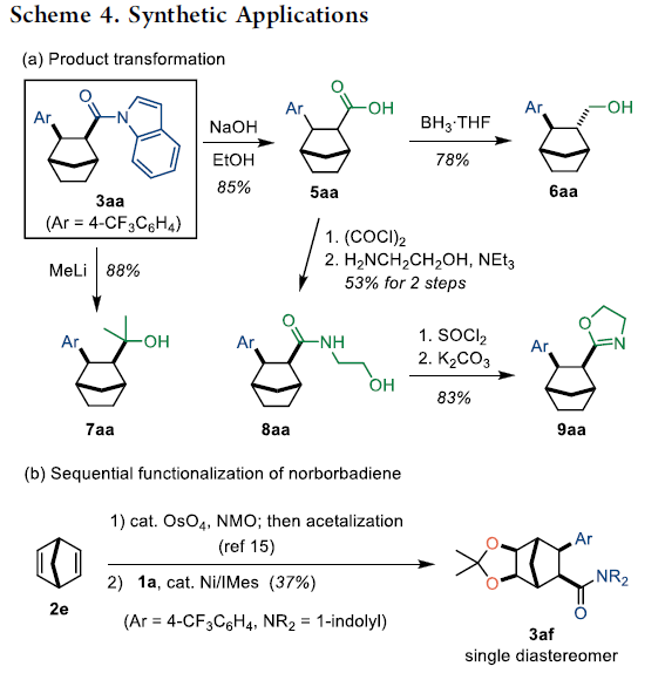
同时,该小组进一步对相应的1,2-碳氨基羰基化产物进行一系列后续的合成转化研究 (Scheme 4),进而表明这一全新的1,2-碳氨基羰基化策略具有良好的合成应用价值。
总结
M. Tobisu课题组成功设计出一种全新的镍催化N-芳酰基吲哚分子中C-C键与张力烯基化合物之间的1,2-碳氨基羰基化反应 (1,2-carboaminocarbonylation)方法学,进而顺利实现一系列张力烯基化合物的双重碳官能团化。这一全新的碳氨基羰基化策略无需选择相应的导向基团,同时具有高度的原子经济性、优良的立体选择性以及良好的官能团兼容性等优势。
参考文献
[1] (a) Y. Xia, G. Dong, Nature Rev. Chem. 2020, 4, 600. doi: 10.1038/s41570-020-0218-8.(b) F. Song, T. Gou, B. Wang, Z. Shi, Chem. Soc. Rev. 2018, 47, 7078. doi: 10.1039/C8CS00253C.
(c) P. Chen, B. A. Billett, T. Tsukamoto, G. Dong, ACS Catal. 2017, 7, 1340. doi: 10.1021/acscatal.6b03210.
(d) D.-S. Kim, W.-J. Park, C.-H. Jun, Chem. Rev. 2017, 117, 8977. doi: 10.1021/acs.chemrev.6b00554.
(e) M. Murakami, N. Ishida, J. Am. Chem. Soc. 2016, 138, 13759. doi: 10.1021/jacs.6b01656.
[2] Y. Nakao, Chem. Rev. 2021, 121, 327. doi:10.1021/acs.chemrev.0c00301. [3] M. T. Wentzel, V. J. Reddy, T. K. Hyster, C. J. Douglas, Angew. Chem. Int. Ed. 2009, 48, 6121. doi: 10.1002/anie.200902215. [4] R. Zhang, Y. Xia, G. Dong, Angew. Chem. Int. Ed. 2021, 60, 20476. doi: 10.1002/anie.202106007. [5] E. H. Denton, Y. H. Lee, S. Roediger, P. Boehm, M. Fellert, B. Morandi, Angew. Chem. Int. Ed. 2021, 60, 23435. doi: 10.1002/anie.202108818.本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载

















No comments yet.