本文作者:Duece
导读
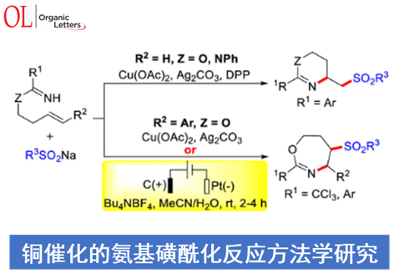
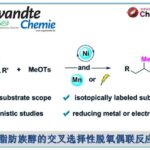
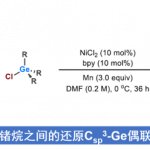
近日,遵义医科大学的陈永正小组在Org. Lett.中发表论文,报道一种全新的采用铜催化剂促进的一系列O-homoallyl benzimidate或N-alkenyl amidine与亚磺酸钠 (sodium sulfinate)之间的氨基磺酰化 (aminosulfonylation)反应方法学,进而成功完成一系列有机杂环分子的构建。
Complementary Copper-Catalyzed and Electrochemical Aminosulfonylation of O‑Homoallyl Benzimidates and N‑Alkenyl Amidines with Sodium Sulfinates.
Mou, L. Ren, M. Zhang, M. Wang, Y. Jin, Q. Guan, A. Cai, S. Zhang, H. Ren, Y. Zhang, Y. Chen, Org. Lett. 2022, 24, 1405. doi: 10.1021/acs.orglett.2c00287.
正文
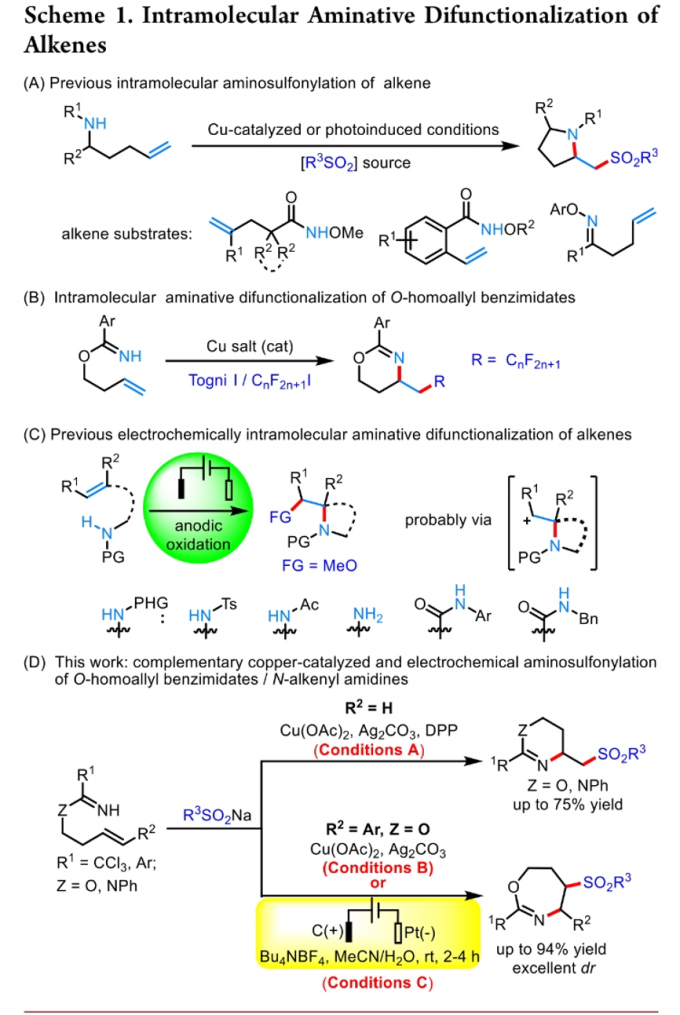
目前,对于高度官能团化的N-杂环分子合成转化策略的相关研究一直以来备受有机合成化学家的广泛关注[1]-[5] (Scheme 1)。这里,受到Chen与He研究团队对于全氟烷基自由基促进的分子内氨基化环化 (intramolecular aminative cyclization)反应方法学[6]、本课题组前期对于绿色化学与生物活性含氮杂环分子 (bioactive azaheterocycles)的合成方法学[7]以及通过烯基化合物进行的分子内氨基化双重官能团化反应方法学[8]相关研究报道的启发,遵义医科大学的朱永正团队成功设计出一种全新的通过铜催化剂以及电化学条件促进的O-homoallyl benzimidate以及N-alkenyl amidine与亚磺酸钠之间的氨基磺酰化反应方法学。
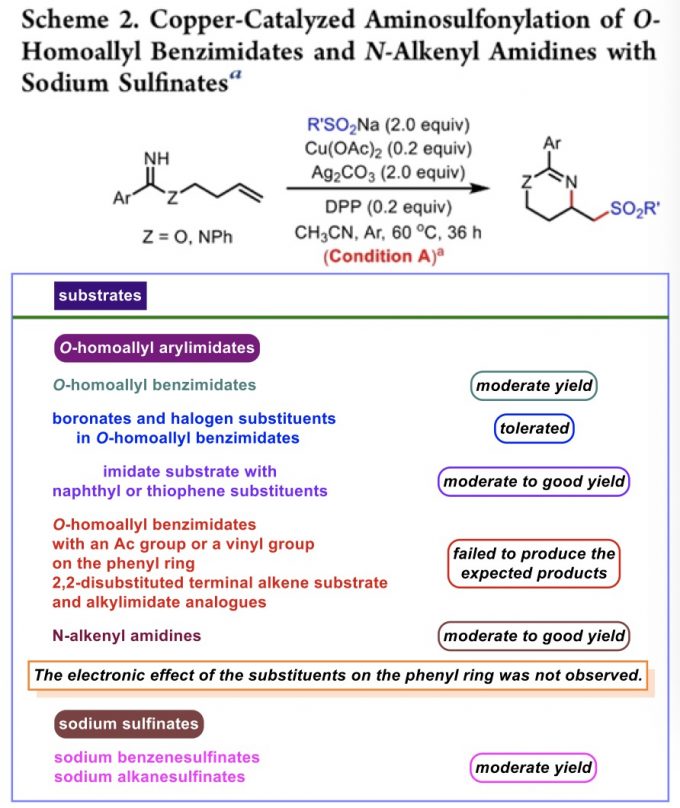
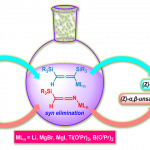
首先,作者采用O-homoallyl benzimidate或N-alkenyl amidine与芳基亚磺酸钠为模板底物,进行相关反应条件的优化筛选,进而确定最佳的反应条件为:(1) Condition A:在氩气气氛下,采用Cu(OAc)2作为催化剂,DPP (diphenyl hydrogen phosphate)作为配体,Ag2CO3作为氧化剂,MeCN作为反应溶剂,反应温度为60 °C;(2) Condition B:在氩气气氛下,采用Cu(OAc)2作为催化剂,Ag2CO3作为氧化剂,MeCN作为反应溶剂,反应温度为60 °C;(3) Condition C:在氩气气氛下,采用四氟硼酸四丁基铵作为支持电解质,石墨棒 (graphite rod)作为阳极,铂板作为阴极 (platinum plate),恒定电流为4 mA,MeCN/H2O (12:1 v/v)作为反应溶剂,进而以良好的分离收率获得相应的环化产物。
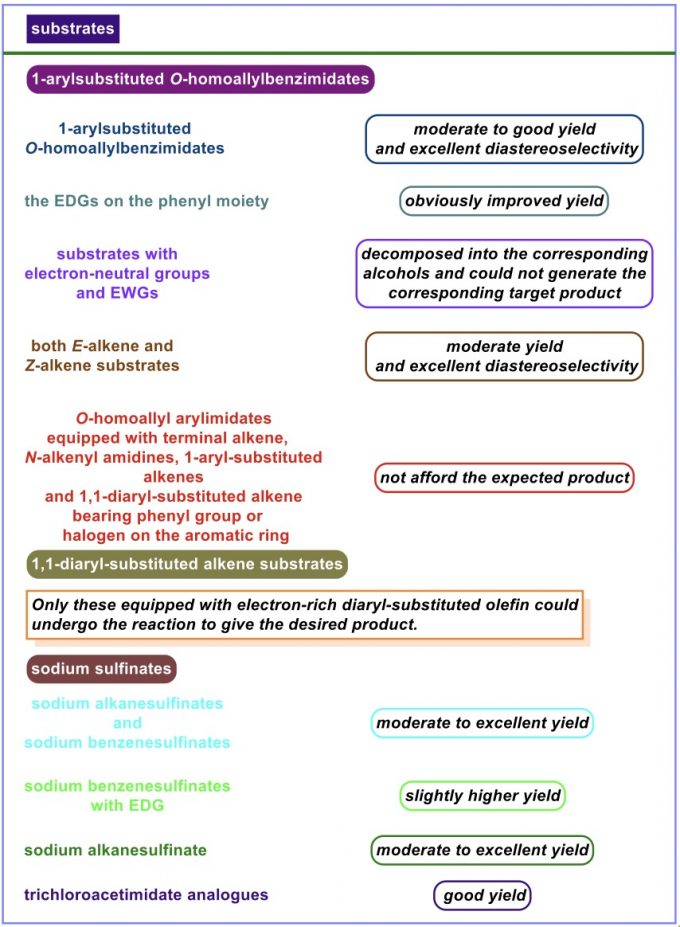
在上述的最佳反应条件 (Condition A)下,作者进一步对一系列O-homoallyl benzimidate底物的应用范围进行如下研究 (Scheme 2)。
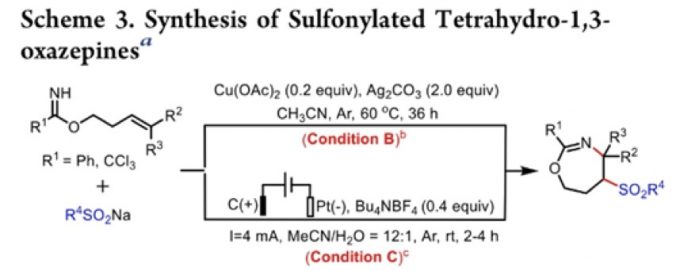
同时,作者进一步对其他的最佳反应条件 (Condition B-C)下,相关O-homoallyl benzimidate底物的应用范围进行深入研究 (Scheme 3)。
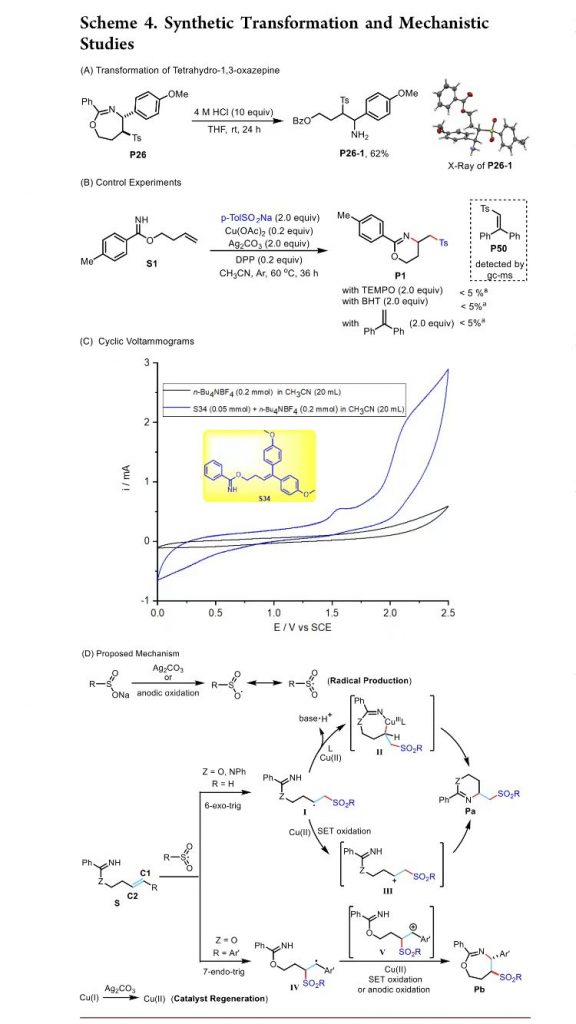
同时,作者对相应杂环产物的合成转化过程进行进一步考察 (Scheme 4A)。之后,作者通过一系列控制实验的相关研究表明,反应过程中可能涉及自由基中间体 (Scheme 4B)。同时,该小组通过CV (cyclic voltammetry)研究进一步表明,亚磺酸盐在反应过程中优先参与相关的氧化过程,进而形成相应的自由基中间体 (Scheme 4C)。基于上述的实验研究以及前期相关的研究报道[2], [6], [8],作者提出如下合理的反应机理 (Scheme 4D)。
总结
遵义医科大学的陈永正小组成功设计出一种全新的采用铜催化剂促进的一系列O-homoallyl benzimidate或N-alkenyl amidine分子与亚磺酸钠之间的氨基磺酰化反应方法学,进而有效地实现一系列有机杂环分子的构建。这一全新的氨基磺酰化策略具有良好的底物兼容性、较高的反应收率以及良好的合成应用价值等优势。
参考文献
- [1] D. Brown, J. Boström, J. Med. Chem. 2016, 59, 4443.
- doi: 10.1021/acs.jmedchem.5b01409.
- [2] Z. Li, G. Fang, Q, Gu, X. Liu, Chem. Soc. Rev. 2020, 49, 32.
- doi: 10.1039/C9CS00681H.
- [3] R. Mao, Z. Yuan, Y. Li, J. Wu, Chem. – Eur. J. 2017, 23, 8176.
- doi: 10.1002/chem.201702040.
- [4] S. Ye, X. Li, W. Xie, J. Wu. Eur. J. Org. Chem. 2020, 2020, 1274.
- doi: 10.1002/ejoc.201900396.
- [5] X. Xu, K. D. Moeller, J. Am. Chem. Soc. 2008, 130, 13542.
- doi: 10.1021/ja806259z.
- [6] X. Mou, F. Rong, H. Zhang, G. Chen, G. He. Org. Lett. 2019, 21, 4657.
- doi: 10.1021/acs.orglett.9b01552.
- [7] (a) H. Cui, L. Xie, N. Wan, Q. He, Z. Li, Y. Chen, Green Chem. 2019, 21, 4324. doi: 10.1039/C9GC01802F.
- (b) S. Yang, W. Han, C. He, B. Cui, N. Wan, Y. Chen, Org. Lett. 2019, 21, 8857.
- doi: 10.1021/acs.orglett.9b03565.
- (c) F. Zhang, N. Wan, J. Ma, B. Cui, W. Han, Y. Chen, ACS Catal. 2021, 11, 9066.
- doi: 10.1021/acscatal.1c02345.
- [8] (a) H. Xu, K. D. Moeller, J. Am. Chem. Soc. 2008, 130, 13542.
- doi: 10.1021/ja806259z.
- (b) P. Xiong, H. Xu, H. Xu, J. Am. Chem. Soc. 2017, 139, 2956.
- doi: 10.1021/jacs.7b01016.
- (c) Y. Jiang, K. Xu, C. Zeng, Chem. Rev. 2018, 118, 4485.
- doi: 10.1021/acs.chemrev.7b00271.
- [8] (a) R. Zhu, S. L. Buchwald, J. Am. Chem. Soc. 2015, 137, 8069.
- doi: 10.1021/jacs.5b04821.
- (b) W. Rao, L. Jiang, X. Liu, M. Chen, F. Chen, X. Jiang, J. Zhao, G. Zou, Y. Zhou, L. Tang, Org. Lett. 2019, 21, 2890. doi: 10.1021/acs.orglett.9b00907.
- (c) M. Yan, Y. Kawamata, P. S. Baran, Chem. Rev. 2017, 117, 13230.
- doi: 10.1021/acs.chemrev.7b00397.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载















No comments yet.