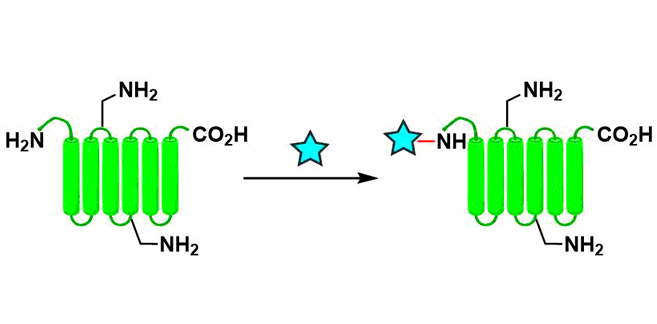
N末端在蛋白质的一条链中只有一处,因此以此为靶点的修饰反应必然的可以实现高位置・化学选择性,并且能够得到均质的修饰体。这样的修饰对高次结构的影响也比较小。另外大概有80%的蛋白质,其N末端都是裸露在蛋白质表面的,因此,该修饰法的活用就显得更加现实了。
但是,该方法也有很多限制,比如说,在很多场合,可以应用的氨基酸种类有限制,另外修饰后不稳定等问题常有发生。根据应用目的选择适当的修饰方法是很重要的。
基本文献
<Review>
- Yuan, Y.; Liang, G. Org. Biomol. Chem. 2014, 12, 865. doi:10.1039/C3OB41241E
- Spears, R. J.; Fascione, M. A. Org. Biomol. Chem. 2016, 14, 7622. doi:10.1039/C6OB00778C
- Rosen, C. B.; Francis, M. B. Nat. Chem. Biol. 2017, 13, 697. doi:10.1038/nchembio.2416
<Chemist’s Guide>
- Stephanopoulos, N.; Francis, M. B. Nat. Chem. Biol. 2011, 7, 876. doi:10.1038/nchembio.720de
- Gruyter, J. N.; Malihns, L. R.; Baran, P. S. Biochemistry 2017, 56, 3863. DOI: 10.1021/acs.biochem.7b00536
反应实例
大致分类如下
1)通过控制pH的手法
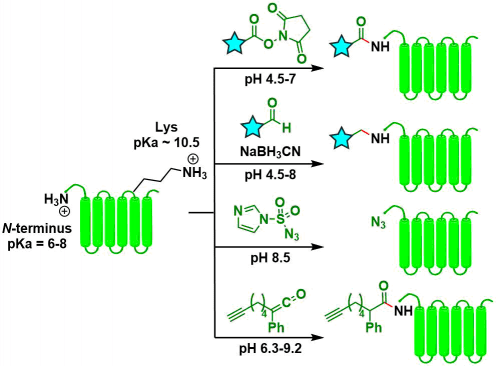
N-末端氨基和赖氨酸侧链氨基在生理条件下均可以被质子化,但由于羰基诱导效应,其pKa值不同[1]。因此,可以通过将溶剂调制在适当的pH进行反应来区分这两个氨基,从而实现N末端选择性修饰。对于使用这种思路的N末端选择性修饰法,已经报道的有酰化,还原胺化[2],叠氮重排[3],烯酮加成[4]等。该方法最大的优点是无需选择末端氨基酸类型就可以实现。
2)氨基酸侧链参与的手法
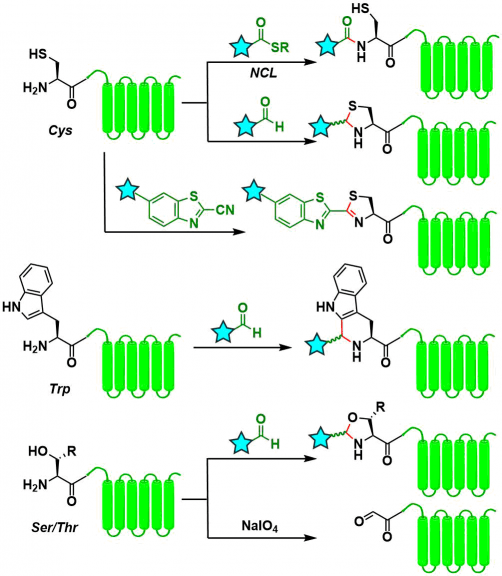
N末端的氨基酸为Cys, Ser, Thr, Trp的时候,可以活用这些氨基酸的所带有的特殊侧链,进行比如说环化反应,或者结构特异性的反应。但是有一点需要注意的是,由于N-端Cys几乎不存在,所以需要通过基因工程技术来引入。
Cys: 关于Native Chemical Ligation,请点链接,本网站已经有具体词条介绍。用醛形成噻唑烷的方法[5]需要酸性pH与过量的试剂,而且会产生成键的可逆性问题。而从这点来看,可以通过o-B(OH)2-benzaldehyde的使用来解决[6]。与2-氰基苯并噻唑(CBT)的反应也由于与普通的Cys侧链的结合是可逆的,所以可以在N末端选择性的进行反应[7]。
Trp: 以Pictet-Spengler环化形式也能进行末端选择性反应[8]。
Ser/Thr:尽管恶唑烷型改性可以以与Cys类似的形式进行,但存在耐水解性低的问题。由于改原因,可以先通过NaIO4氧化等使醛基露出,成为氧化反应的一个立足点在进行后续反应[9]。但是,需要注意的是,强氧化的NaIO4可能对于其他残基造成损伤。
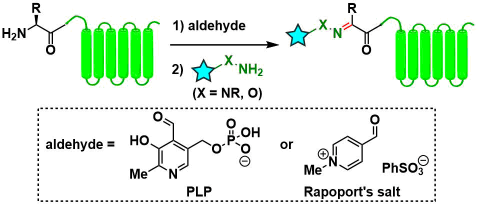
3)N末端氧化后致使羰基露出→肟/腙ligation
使用在N末端露出羰基的手法的对象不仅仅限于Ser/Thr、利用醛试剂的转氨反应也是一个有效地途径。其中,吡哆醛5′-磷酸(PLP)[10]与Rapoport Salt[11]常常用于醛的转氨反应、该方法比上述提到的NaIO4氧化要温和许多。但是,该方法有时候适用对象需要是具有特定氨基酸序列(AKT序列)的时候,才能达到很好的产率。有必要留意的是,肟/腙各自对水解具有不同的稳定性[12]。
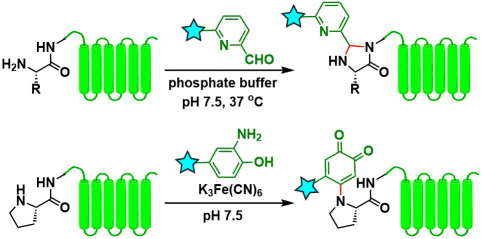
4)其他的化学手法
形成咪唑烷酮法[13]、还有靶向Pro [14]的氧化修饰方法。前者是可逆性的。后者反应同样可以发生在unpaired Cys,因此必须先通过形成二硫键保护起来。
5) 酶催化法
在温和的生物相容性条件下可以实现是该方法最大的特征。
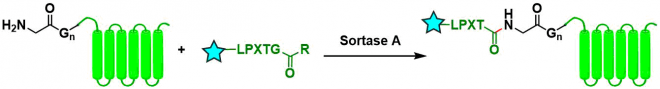
Sortase A(SrtA)法[15]:最常用的方法之一。通过识别LPXTG序列、再与寡聚甘氨酸序列进行肽交换的酶促反应。反应可逆,转化效率根据酶的可获得性变化。
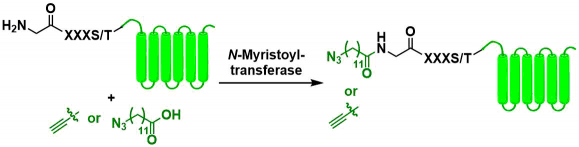
N-肉豆蔻酰基转移酶(NMT)法[16]在N端识别带有GXXXS / T(K)序列的肽、利用酶促反应添加肉豆蔻酸的方法。为了实际应用于生物偶联反应,常使用末端具有叠氮或炔的羧酸进行缩合反应达到修饰的目的。
Subtiligase法[17]:通过Subtiligase的使用可以实现N末端选择性修饰。
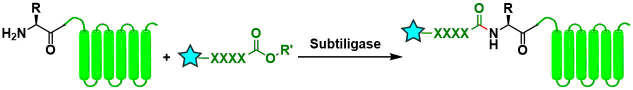
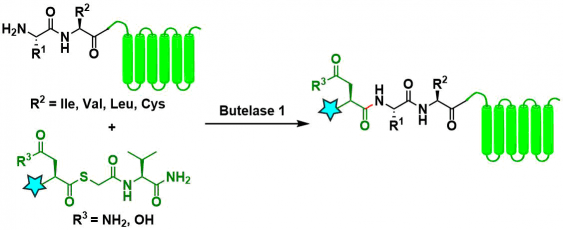
Butelase 1 法[18]:与SrtA一样,是可逆的,虽然反应试剂需要过量,但已有研究表明可以通过使用硫代酯底物解决该问题。
参考文献
- Sereda, T. J.; Mant, C. T.; Quinn, A. M.; Hodges, R. S. J. Chromatogr. 1993, 646, 17. doi:10.1016/S0021-9673(99)87003-4
- Chen, D.; Disotuar, M. M.; Xiong, X.; Wang, Y.; Chou, D. H.-C. Chem. Sci. 2017, 8, 2717. doi:10.1039/C6SC04744K
- Schoffelen, S.; van Eldijk, M. B.; Rooijakkers, B.; Raijmakers, R.; Heck, J. R.; van Hest, J. C. M. Chem. Sci. 2011, 2, 701. doi:10.1039/C0SC00562B
- Chan, A. O.-Y.; Ho, C.-M.; Chong, H.-C.; Leung, Y.-C.; Huang, J.-S.; Wong, M.-K.; Che, C.-M. J. Am. Chem. Soc. 2012, 134, 2589. DOI: 10.1021/ja208009r
- Zhang, L.; Tam, J. P. Anal. Biochem. 1996, 233, 87. DOI: 10.1006/abio.1996.0011
- (a) Bandyopadhyay, A.; Cambray, S.; Gao, J. Chem. Sci. 2016, 7, 4589. doi:10.1039/C6SC00172F (b) Faustino, H.; Silva, M. J. S. A.; Veiros, L. F.; Bernardes, G. J. L.; Gois, P. M. P. Chem. Sci. 2016, 7, 5052. doi:10.1039/C6SC01520D
- Ren, H.; Xiao, F.; Zhan, K.; Kim, Y.-P.; Xie, H.; Xia, Z.; Rao, J. Angew. Chem. Int. Ed. Engl. 2009, 48, 9658. DOI: 10.1002/anie.200903627
- Li, X.; Zhang, L.; Hall, S. E.; Tam, J. P. Tetrahedron Lett. 2000, 41, 4069. doi:10.1016/S0040-4039(00)00592-X
- (a) Geoghegan, K. F.; Stroh, J. G. Bioconjugate Chem. 1992, 3, 138. DOI: 10.1021/bc00014a008 (b) Chen, J. K.; Lane, W. S.; Brauer, A. W.; Tanaka, A.; Schreiber, S. L. J. Am. Chem. Soc. 1993, 115, 12591. DOI: 10.1021/ja00079a051
- (a) Snell, E. E. J. Am. Chem. Soc. 1945, 67, 194. DOI: 10.1021/ja01218a013 (b) Dixon, H. B. F.; Fields, R. Methods Enzymol. 1972, 25, 409. doi: 10.1016/S0076-6879(72)25036-4 (c) Gilmore, J. M.; Scheck, R. A.; Esser-Kahn, A. P.; Joshi, N. S.; Francis, M. B. Angew. Chem. Int. Ed. Engl. 2006, 45, 5307. DOI: 10.1002/anie.200600368 (d) Witus, L. S.; Moore, T.; Thuronyi, B. W.; Esser-Kahn, A. P.; Scheck, R. A.; Iavarone, A. T.; Francis, M. B. J. Am. Chem. Soc. 2010, 132, 16812. DOI: 10.1021/ja105429n
- (a) Witus, L. S.; Netirojjanakul, C.; Palla, K. S.; Muehl, E. M.; Weng, C.-H.; Iavarone, A. T.; Francis, M. B. J. Am. Chem. Soc. 2013, 135, 17223. DOI: 10.1021/ja408868a (b) Palla, K. S.; Witus, L. S.; Mackenzie, K. J.; Netirojjanakul, C.; Francis, M. B. J. Am. Chem. Soc. 2015, 137, 1123. DOI: 10.1021/ja509955n
- Kalia, J.; Raines, R. T. Angew. Chem. Int. Ed. 2008, 47, 7523. DOI: 10.1002/anie.200802651
- MacDonald, J. I.; Munch, H. K.; Moore, T.; Francis, M. B. Nat. Chem. Biol. 2015, 11, 326. doi:10.1038/nchembio.1792
- Obermeyer, A.; Jarman, J. B.; Francis, M. B. J. Am. Chem. Soc. 2014, 136, 9572. DOI: 10.1021/ja500728c
- (a) Antos, J. M.; Chew, G.-L.; Guimaraes, C. P.; Yoder, N. C.; Grotenbreg, G. M.; Popp, M. W.-L.; Ploegh, H. L. J. Am. Chem. Soc. 2009, 131, 10800. DOI: 10.1021/ja902681k (b) Williamson, D. J.; Fascione, M. A.; Webb, M. E.; Turnbull, W. B. Angew. Chem. Int. Ed. Engl. 2012, 51, 9377. DOI: 10.1002/anie.201204538(c) Theile, C. S.; Witte, M. D.; Blom, A. E. M.; Kundrat, L.; Ploegh, H. L.; Guimaraes, C. P. Nat. Protoc. 2013, 8, 1800. doi:10.1038/nprot.2013.102
- (a) Hang, H. C.; Geutjes, E.-J.; Grotenbreg, G.; Pollington, A. M.; Bijlmakers, M. J.; Ploegh, H. L. J. Am. Chem. Soc. 2007, 129, 2744. DOI: 10.1021/ja0685001 (b) Charron, G.; Zhang, M. M.; Yount, J. S.; Wilson, J.; Raghavan, A. S.; Shamir, E.; Hang, H. C. J. Am. Chem. Soc. 2009, 131, 4967. DOI: 10.1021/ja810122f (c) Heal, W. P.; Wright, M. H.; Thinon, E.; Tate, E. W. Nat. Protoc. 2012, 7, 105. doi:10.1038/nprot.2011.425
- Abrahmsen, L.; Tom, J.; Burnier, J.; Butcher, K. A.; Kossiakoff, A.; Wells, J. A.Biochemistry 1991, 30, 4151. DOI: 10.1021/bi00231a007
- (a) Nguyen, G. K. T.; Wang, S.; Qiu, Y.; Hemu, X.; Lian, Y.; Tam, J. P. Nat. Chem. Biol. 2014, 10, 732. doi:10.1038/nchembio.1586 (b) Nguyen, G. K.T .; Cao, Y.; Wang, W.; Liu, C. F.; Tam, J. P. Angew. Chem. Int. Ed. Engl. 2015, 54, 15694. DOI: 10.1002/ange.201506810
关联书籍(日亚价格)
Bioconjugate Techniques, Third Edition
- 著者Greg T. Hermanson
- 参考価格¥ 12,249
価格¥ 12,136(2017/12/01 23:10時点) - 出版日2013/09/02
- 商品ランキング52,007位
- ハードカバー1200ページ
- ISBN-100123822394
- ISBN-139780123822390
- 出版社Academic Press
Bioconjugation Protocols: Strategies and Methods (Methods in Molecular Biology)
- 参考価格¥ 24,479
価格¥ 24,204(2017/12/02 06:52時点) - 出版日2016/08/23
- ペーパーバック624ページ
- ISBN-101493960962
- ISBN-139781493960965
- 出版社Humana Press
外部链接
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.