本文作者:杉杉
导读
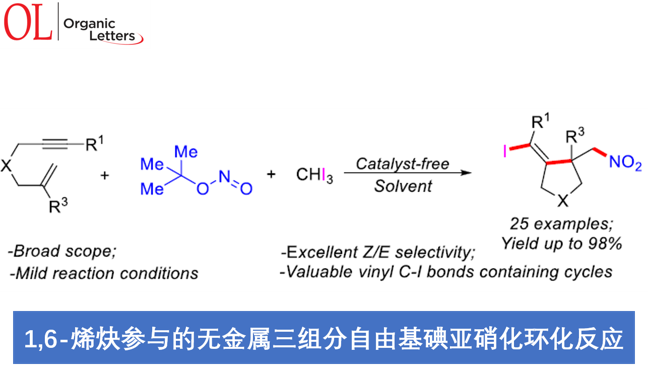
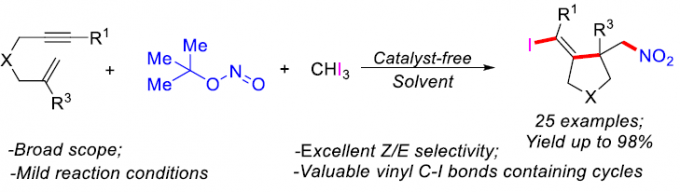
近日,扬州大学的朱绍群教授课题组在Org. Lett.中发表论文,报道一种全新的无金属三组分自由基串联碘亚硝化环化 (iodonitrosylative cyclization)反应方法学。这一策略中,采用亚硝酸叔丁酯,形成相应的亚硝基自由基 (nitroso radical),进而引发后续的自由基加成/环化/碘化/氧化的串联反应过程。并且,这一全新的碘亚硝化环化策略具有良好的底物应用范围,并以中等至优良反应收率,获得一系列同时具有烯基C-I键与硝基的高度官能团化的碳环以及杂环分子。
Three-Component Radical Iodonitrosylative Cyclization of 1,6-Enynes under Metal-Free Conditions
S. Zhu, Q. Cheng, H.Yang, X. Chen, Y. Han, C. Yan, Y. Shi, H. Hou, Org. Lett. 2021, 23, 5044. doi: 10.1021/acs.orglett.1c01576.
正文
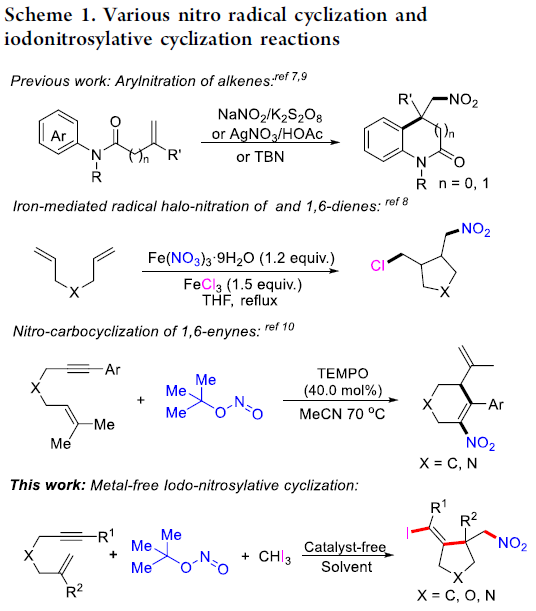
高度官能化的五元环化合物作为重要的结构单元,广泛存在于各类天然产物、药物以及功能有机材料等分子中。因此,有机合成化学家长期致力于设计一种全新的,并具有高度步骤经济性 (step-economical)的反应策略,进而成功实现各类具有多重官能团化的环状有机分子的构建。尽管化学家研究成功开发出一系列相关的自由基环化策略,并顺利实现一系列环状有机分子的构建。然而,在上述策略中,通常需要选择过渡金属催化剂或化学计量的氧化剂[1]-[2]。
同时,通过大量的研究报道已经证实,硝基与卤素基团不仅能够表现出独特的电负性特征,例如电子供体与氢键受体性质,进而发挥重要的生理学效应。并且,具有硝基与卤素基团的有机分子,同样能够作为有机分子设计中的重要合成前体。因此,设计一种能够将硝基与卤素基团同时引入环状分子中的合成转化策略,则极具吸引力。并且,目前已经成功开发出一系列能够应用于自由基环化过程的硝基自由基源 (nitro group radical source)与卤原子源 (halogen atom source) [3]。其中,Yang与Li等[4]报道选择NaNO2与AgNO3作为自由基型芳基硝化反应策略中的硝基自由基源。Ishibashi小组[5]采用Fe(NO3)3·9H2O作为硝基自由基源,同时选择FeCl3作为氯原子源,进而成功开发出一种通过铁媒介促进的1,6-二烯分子的氯硝化反应 (chloro-nitration reaction)方法学。此外,同样有文献报道[6]采用无金属硝基自由基源 (metal-free nitro radical source),例如亚硝酸叔丁酯 (tert-butyl nitrite, TBN)进行的硝化环化反应 (nitrative cyclization reaction)方法学。并且,通过一步反应过程,将硝基与卤素基团同时引入环状分子中的合成转化策略,目前则极少有相关的文献报道[5]。同时,受到本课题组前期对于自由基环化反应以及卤原子转移反应方法学研究的启发,这里,本文将报道一种在无金属试剂条件下进行的三组分自由基碘亚硝化环化串联反应方法学,进而较为高效地完成一系列同时具有硝基与卤乙烯基团的碳环与杂环分子的构建 (Scheme 1)。
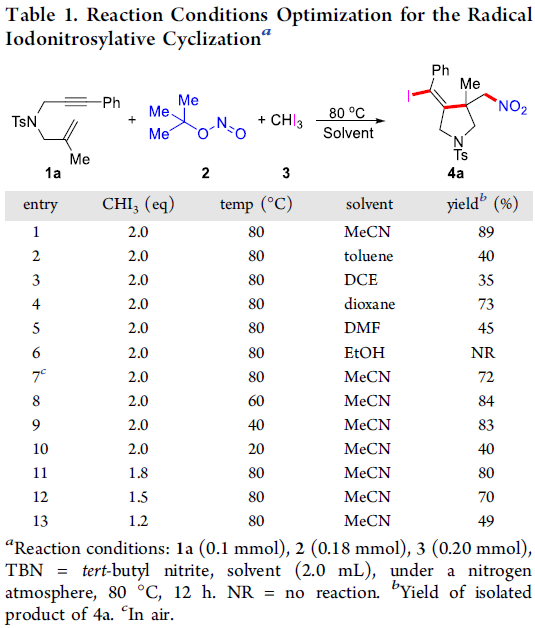
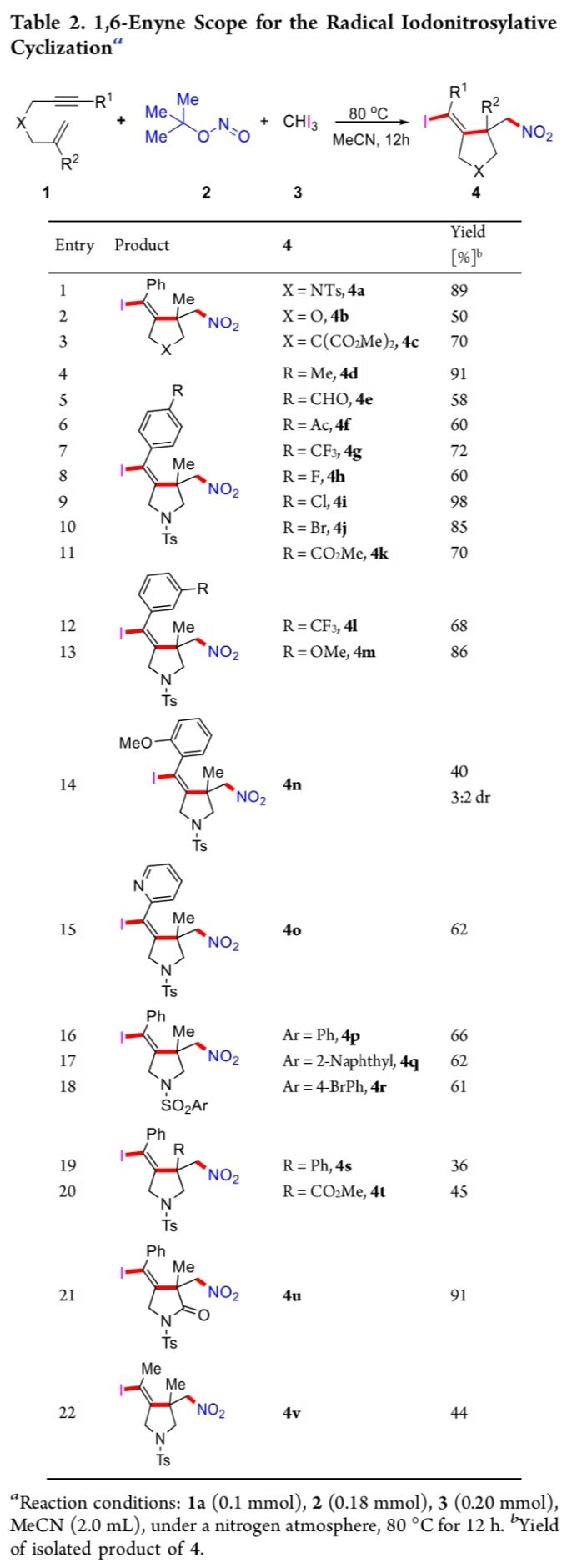
首先,该小组对相关的反应条件进行优化筛选 (Table 1)。进而确定最佳的反应条件为:采用1,6-烯炔(1a)、t–BuONO(2) 作为亚硝基自由基源以及碘仿(3)作为碘源,在乙腈溶剂以及反应温度为80 oC的条件下进行反应,并获得89%收率的环化产物4a。
在获得上述的最佳反应条件之后,作者开始对1,6-烯炔底物1的应用范围进行考察 (Table 2)。研究表明,一系列具有1,1-二取代烯基结构单元的1,6-烯炔底物均能够有效地参与上述的环化过程,并获得中等至优良的反应收率 (4a-4v, 36-98%)。同时,作者发现,1,6-烯炔底物的X取代基为氧原子、C(CO2Me)2或NTs时,同样能够顺利地进行相应的关环过程,并获得相应环化产物4a–4c。之后,该小组发现,1,6-烯炔底物中的R1基团为对位或间位具有不同吸电子与供电子基团取代的芳基时,均能够与上述的标准反应体系良好地兼容,并获得相应的碘亚硝化环化产物4d-4m。而且,作者进一步发现,上述的最佳反应条件对于R1基团为邻甲氧基苯基取代的1,6-烯炔底物,由于立体位阻的存在,进而使目标产物4n的收率出现显著降低 (仅为40%, 3:2 d.r.)。同时,研究发现,1,6-烯炔底物中的R1基团为杂芳基以及烷基时,同样能够较好地参与上述的碘亚硝化环化过程,并获得相应的环化产物4o与4v。之后,该小组进一步观察到,上述的标准反应条件对于具有不同芳基磺酰胺类保护基团存在的1,6-烯炔底物,同样能够获得61-66%收率的目标产物4p–4r。此外,上述的环化策略对于R2基团为苯基与甲氧羰基取代的1,6-烯炔底物,同样能够较好地兼容,并获得中等收率的环化产物4s与4t。值得注意的是,这一全新的碘亚硝化环化策略同样能够良好地应用于γ-内酰胺分子4u的构建。
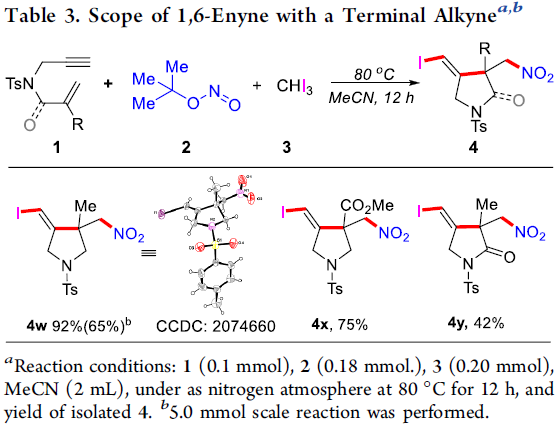
之后,作者进一步发现,上述的标准反应条件对于具有末端炔基结构单元的1,6-烯炔底物,均能够以中等至良好的反应收率与优良的立体选择性,获得具有(Z) -双键的环化产物4w–4y。同时,作者发现,在4w的克级规模合成实验 (1.4 g)中,同样能够获得良好的反应收率。
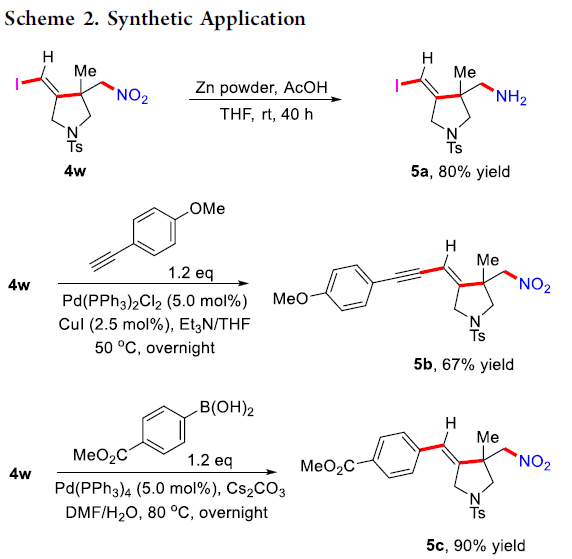
接下来,作者对上述碘亚硝化环化策略的合成实用性进行研究 (Scheme 2)。实验结果表明,将化合物4w中的硝基经历后续的还原过程,能够转化为相应的一级胺产物5a,收率为80%。同时,化合物4w中的碘官能团能够进行相应的Sonogashira以及Suzuki偶联过程,并分别获得相应的偶联产物5b (67% 反应收率)与5c (90% 反应收率)。
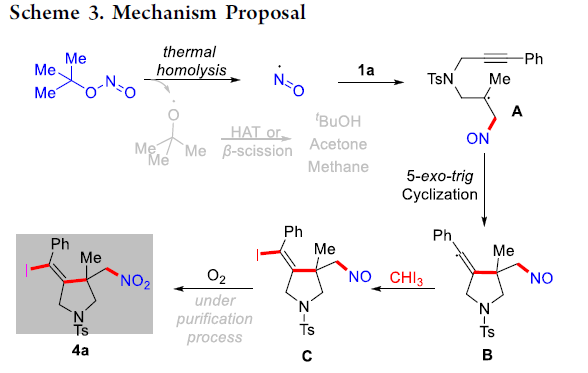
最后,作者提出一种可能的反应机理 (Scheme 3)。首先,通过t–BuONO的热均裂 (thermal homolysis)过程,形成亚硝基自由基中间体,之后,亚硝基自由基与1,6-烯炔底物1a之间经历进一步的自由基加成与环化过程,形成乙烯基自由基中间体B。接下来,通过中间体B与碘仿之间的亲电碘化反应 (electrophilic iodination reaction)步骤,形成碘化中间体C。接下来,在氧气存在的条件下,氧化为最终的目标产物4a。
总结
扬州大学的朱绍群教授课题组报道一种在无金属试剂存在的反应条件下进行的三组分自由基碘亚硝化环化串联反应方法学。其中,采用1,6-烯炔作为反应底物,t–BuONO作为亚硝基自由基源,碘仿作为碘源,进而成功完成一系列同时具有硝基与乙烯基C-I键的五元环分子的构建。这一全新的碘亚硝化环化策略具有底物应用范围广泛、高度的官能团兼容性以及优良的步骤经济性等优势。并且。反应机理研究表明,上述反应过程中涉及亚硝基自由基的产生以及通过亚硝基自由基引发的自由基加成/环化/碘化/氧化的串联过程。
参考文献
[1] (a) P. Gao, X. Yan, T. Tao, F. Yang, T. He, X. Song, X. Liu, Y. Liang, Chem. – Eur. J. 2013, 19, 14420. doi: 10.1002/chem.201303025.(b) Y. Wang, Y. He, L. Zhang, X. Wu, X. Liu, Y. Liang, Org. Lett. 2015, 17, 4280. doi: 10.1021/acs.orglett.5b02068.
(c) G. Deng, Z. Wang, J. Xia, P. Qian, R. Song, M. Hu, L. Gong, J. Li, Angew. Chem. Int. Ed. 2013, 52, 1535. doi: 10.1002/anie.201208380.
[2] S. Engl, O. Reiser, ACS Catal. 2020, 10, 9899. doi: 10.1021/acscatal.0c02984. [3] (a) P. Li, X. Jia, Synthesis 2017, 49, 711. doi: 10.1055/s-0036-1589155.(b) S. Song, Y. Dong, G. Ge, Q. Li, W. Wei, Synthesis 2020, 52, 796. doi: 10.1055/s-0039-1690789.
(c) J. Huang, F. Ding, P. Rojsitthisak, F. He, J. Wu, Org. Chem. Front. 2020, 7, 2873 doi: 10.1039/D0QO00563K.
[4] (a) Y. Li, X. Wei, X. Li, S. Yang, Chem. Commun. 2013, 49, 11701. doi: 10.1039/C3CC47287F.(b) Y. Li, Y. Shen, K. Chang, S. Yang, Tetrahedron Lett. 2014, 55, 2119. doi: 10.1016/j.tetlet.2014.02.043.
[5] T. Taniguchi, H. Ishibashi, Org. Lett. 2010, 12, 124. doi: 10.1021/ol902510p. [6] (a) T. Shen, Y. Yuan, N. Jiao, Chem. Commun. 2014, 50, 554. doi: 10.1039/C3CC47336H.(b) X. Hao, P. Gao, X. Song, Y. Qiu, D. Jin, X. Liu, Y. Liang, Chem. Commun. 2015, 51, 6839. doi: 10.1039/C5CC00872G.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.