导读
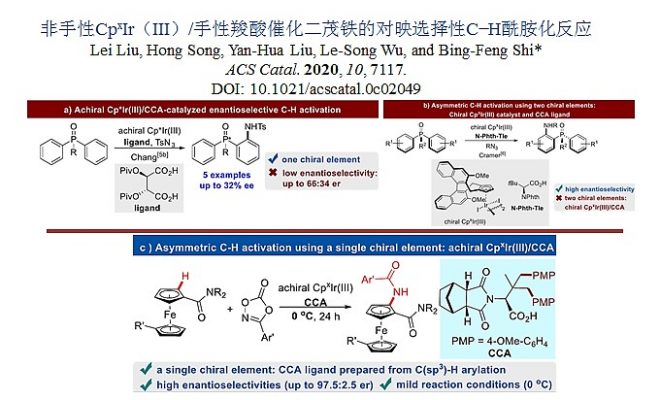
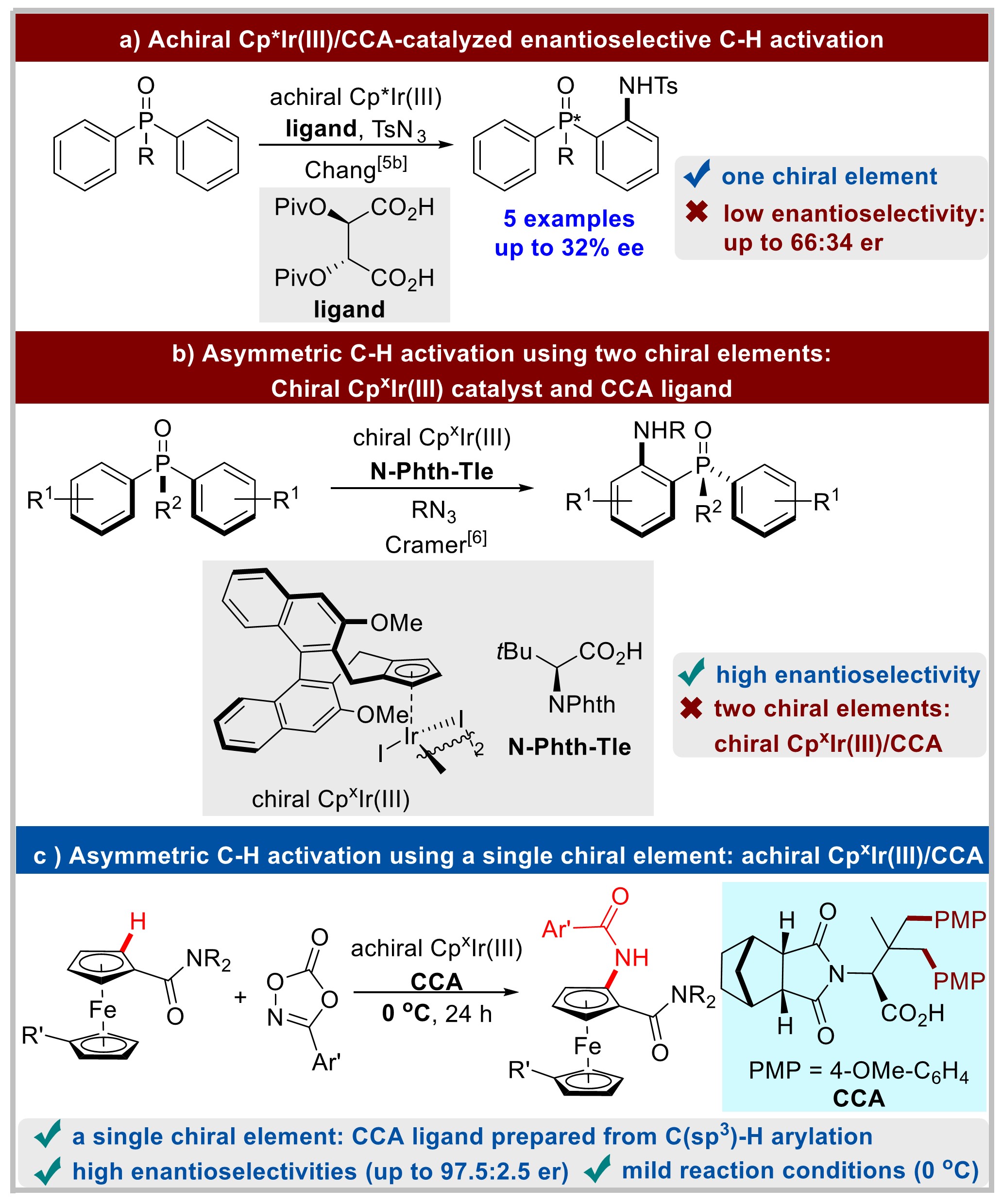
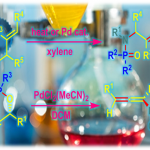
在过去的几十年中,转金属催化不对称C-H官能化策略已经成为合成手性分子的强大工具。[1]在众多的金属催化剂中,由于Cp*M(III) (M = Co, Rh, Ir) 具有独特的配位模式、多样的反应性以及很好的稳定性,使其在不对称C−H活化方面有很大的应用前景。[2]目前手性CpxRh(III)配合物催化的C-H活化已经得到比较完善的研究,相比而言, Ir(III)催化尚处在发展阶段。与Rh(III)相比,Ir(III)往往表现出独特的反应性和选择性,因此,Ir(III)催化可能在不对称C−H活化反应中有更好的发展前景。在之前的工作中,Chang等应用非手性CpxIr(III)和手性羧酸(CCA)实现了氧化膦的C−H酰胺化反应,但其对映选择性不高(66:34 er)。[3]之后,Cramer课题组利用手性CpxIr(III)和CCA,实现了氧化膦的高对映选择性C−H酰胺化反应,然而,该工作中需要经过复杂的过程来制备轴手性环戊二烯基(Cpx)与Ir(III)的配合物。[4]因此,利用非手性Ir(III)配合物与外部手性配体来实现高对映选择性合成手性化合物是非常吸引人的。与此同时,由于二茂铁在不对称催化、药物化学以及材料化学上的广泛应用,其发展受到了广泛关注。[5]基于之前化学工作者对转金属催化的对映选择性合成面手性分子的研究以及课题组对C−H活化的研究兴趣,浙江大学史炳锋课题组报道了一例非手性CpxIr(III)催化二茂铁的不对称C−H酰胺化反应。相关研究成果发表于
“Achiral CpxIr(III)/Chiral Carboxylic Acid Catalyzed Enantioselective C−H Amidation of Ferrocenes under Mild Conditions”
Lei Liu, Hong Song, Yan-Hua Liu, Le-Song Wu, and Bing-Feng Shi* ACS Catal. 2020, 10, 7117. DOI: 10.1021/acscatal.0c02049
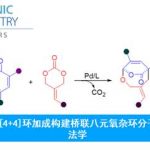
图1 Ir(III)催化C-H活化制备手性化合物
论文概要
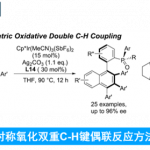
作者首先以N,N-二甲基二茂铁甲酰胺(1a)与3-苯基-1,4,2-二恶唑-5-酮(2a)为模板底物,以N-Phth-Tle(L1)为配体,在2.5 mol%[Cp*IrCl2]2(Cat-1)的催化下进行反应,能够得到目标产物3a(44:56 er)(表1, entry1)。之后,作者对不同的N-邻苯二甲酰保护Tle-OH,实验结果表明(S)-H2-BHTL(L4)具有较好的催化效果(entry 4, 70:30 er)。作者发现,空间效应可以显著影响该反应的立体化学,立体诱导随着保护基体积的增加而发生逆转(L4, 70:30 vs L1, 44:56 er)。因此作者认为侧链的空间位阻可能会对立体控制具有直接的影响。随后,作者测试了具有更大位阻的氨基酸L5和L6,其中L6能够显著的提高反应的对映选择性(entey 6, 87:13 er)。为了进一步提高反应的收率和对映选择性,作者进一步对不同金属催化剂、溶剂、反应温度等条件进行筛选,最终确定以2.5 mol% Cat-2作为催化剂,30 mol% L6作为配体,乙酸甲酯与丙酮3/1作为混合溶剂,于0 °C下进行反应为最优条件(3a, 82% yield, 95:5 er)(表1, entry 10)。
表1 条件筛选
在最优反应条件下,作者首先考察了二恶唑酮的底物范围(图 2)。当二恶唑酮的苯环上具有不同位置、不同电性(吸电子基或者给电子基)的取代基时,均能很好的适应该反应体系,以高收率以及优异的对映选择性得到酰胺化产物。此外,杂芳烃呋喃(2p)和噻吩(2q)也能以高收率和对映选择性得到酰胺化产物(3p, 67%, 95:5 er; 3q, 98%, 96:4 er)。二茂铁衍生的二恶唑酮2r也可以得到目标产物3r(65%, 96:4 er)。值得一提的是,[2.2]-对环番衍生的底物2s也可以在最优条件下得到具有双面手性的目标产物3s(91%, 96:4 er, dr = 1.8:1)。
图 2 二恶唑酮的底物范围
接下来,作者对二茂铁酰胺也进行了底物拓展研究(图3)。含有不同取代基的酰胺均能很好的适应该体系,并能以高收率和优异的对映选择性得到相应的目标产物(4a-4i)。酰胺-N 上不同取代基对反应结果没有明显的影响,取代基位阻的大小对目标产物对映选择性基本无影响。作者也对二茂铁另一个芳环上不同取代基进行了研究(4f-4i)。值得注意的是,当二茂铁上带有叔醇取代基(1h)时也可以得到目标产物4h(60%, 98:2 er),此外,具有Br取代基的底物在最优条件下也可以得到目标产物4i(61%, 94:6 er)。
图 3 二茂铁的底物范围
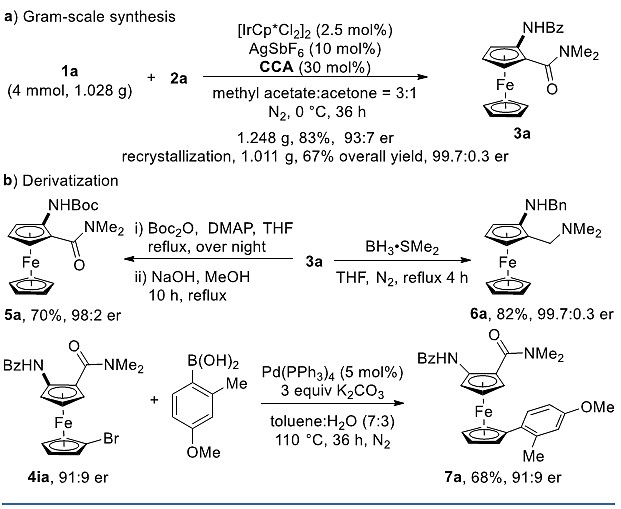
为了证明反应的应用潜力,作者进行了一系列衍生反应(图 4)。首先,该反应可在2.5 mol% [Cp*IrCl2]2 Cat-1催化下,进行4 mmol量的反应,以83%的收率和93:7 er得到目标产物3a。经过一步重结晶,可以得到几乎对映体纯(>99% ee)的3a。用Boc2O处理3a后再水解得到二茂铁5a(70%, 98:2 er)。此外,3a也可以制备手性二茂铁胺6a(82%,>99% ee)。此外,含溴的二茂铁4ia可通过Suzuki偶联反应得到目标产物7a(68%, 91:9 er)。
图4衍生反应
论文总结评价
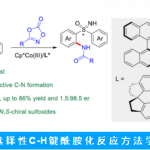
浙江大学史炳锋课题组发展了一例酰胺导向非手性CpxIr(III)催化的二茂铁酰胺的对映选择性C−H 酰胺化反应。由叔亮氨酸经过一步C(sp3)−H芳基化反应制备的CCA作为手性配体应用于该反应体系中,极大扩展了9族金属的催化对映选择性C−H功能化反应。同时,该反应提供了一种在温和条件(0 oC)下高效制备平面手性二茂铁的新方法。此外,作者正在对这一新型催化体系进行更多的研究。
参考文献
- [1] C. G. Newton, S.-G. Wang, C. C. Oliveira, N. Cramer, Chem. Rev. 2017, 117, 8908-8976. DOI: 10.1021/acs.chemrev.6b00692
- [2] T. Yoshino, S. Satake, S. Matsunaga, Chem. – Eur. J. 2020, 26, 7346-7357. DOI: 10.1002/chem.201905417
- [3] D. G. Gwon, D. Lee, J. Kim, S. Park, S. Chang, Chem. – Eur. J. 2014, 20, 12421-12425. DOI: 10.1002/chem.201404151
- [4] Y.-S. Jang, M. Dieckmann, N. Cramer, Angew. Chem. Int. Ed. 2017, 56, 15088-15092. DOI: 10.1002/anie.201708440
- [5] G. C. Fu, Acc. Chem. Res. 2006, 39, 853-860. DOI: 10.1021/ar068115g
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!















No comments yet.