本文作者:石油醚
概要
Scott A. Snyder:美国芝加哥大学化学系教授,有机化学家。课题组主页:http://snyder-group.uchicago.edu/
经历
- 1995年-1999年 威廉姆斯学院获得化学学士学位(Professor J. Hodge Markgraf)
- 1999年-2004年 斯克里普斯研究所获得有机化学博士学位(Professor K. C. Nicolaou)
- 2004年-2006年 NIH博士后(Professor E. J. Corey)
- 2006年-2011年 哥伦比亚大学化学系助理教授
- 2011年-2013年 哥伦比亚大学化学系副教授(终身制)
- 2013年-2015年 斯克里普斯研究所化学系副教授(终身制)
- 2015年-至今 芝加哥大学化学系教授
- 2018年-至今 芝加哥大学化学系教授副主席
- 2018年-至今 芝加哥大学系主任
获奖经历
- Visiting Professor, IIT–Bombay, 2019
- Swiss Chemical Society Lectureship, 2018
- Llewellyn John and Harriet Manchester Quantrell Award for Excellence in Undergraduate
- Teaching, University of Chicago, 2017
- The Chemical Record Lectureship, 2013
- Amgen Young Investigator Award, 2012
- Arthur C. Cope Scholar Award from the American Chemical Society, 2011
- DuPont Young Professor Award, 2011
- Alfred P. Sloan Foundation Research Fellowship, 2010
- Bristol-Myers Squibb Unrestricted Grant in Synthetic Organic Chemistry, 2010
- Eli Lilly Grantee Award, 2009
- National Institutes of Health Postdoctoral Fellowship, 2004
- Bristol-Myers Squibb Graduate Fellowship in Synthetic Organic Chemistry, 2003
- Lesly Starr Shelton Award for Excellence in Chemistry Graduate Studies at TSRI, 2003
- Graduate fellowship from Pfizer, Inc., 2002
- Best Talk Prize at the annual TSRI graduate retreat, 2002
- National Science Foundation Predoctoral Fellowship, 1999
- Elected to Associate Membership in Sigma Xi, 1999
- John Sabin Adriance Prize at Williams College, 1999
- Frank C. Goodrich Prize at Williams College, 1999
- Barry M. Goldwater Science and Engineering Fellowship, 1998
- Elected to the Williams College Chapter of Phi Beta Kappa, 1998
- Pfizer Undergraduate Summer Research Fellowship in Synthetic Organic Chemistry, 1997
- Harold H. Warren Prize at Williams College, 1996
- Semifinalist in the Westinghouse Science Talent Search, 1995
- National Finalist in the United States Chemistry Olympiad, 1995
研究方向
Scott A. Snyder教授受到大自然通过高度受控的环化和功能化化学方法对成千上万种天然产物进行化学选择性合成的灵感,从而提供了课题组研究的思路,并确定了值得实验室深入研究的最终目标。 迄今为止,Snyder教授的工作集中在低聚多酚、天然产物的卤化、立体化学密集的萜烯和多环生物碱等方面的全合成,并提供了几种应用于天然产物合成中具有广泛适用性的新试剂、新策略和新方法。
1. 化学选择性卤化
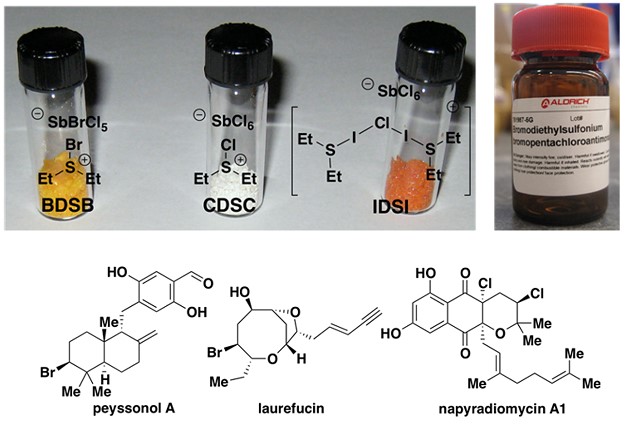
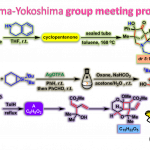
卤化反应已广泛用于医药、农药、染料、香料、增塑剂、阻燃剂等及其中间体等行业,制取各种重要的原料、精细化学品的中间体以及工业溶剂等,是有机合成的重要岗位之一。如何高化学选择性和立体控制的卤化反应引起了许多科学家的兴趣。Snyder教授开发了一类广泛有效的化学选择性卤化试剂1-3。(其中Et2SBr•SbCl5Br(BDSB)是旗舰产品,可从Sigma-Aldrich购买)。在合成实例中证明了该类卤化试剂的高效性和选择性,其中包括:1)通过6次全合成以及正式全合成(包括Peysonnol A)证明了该类试剂是第一种由卤代引发实现高度多样化的萜烯的多烯环化反应的化合物;2)使用该类卤代试剂实现了Laurencia类4,5的8-和9-溴代物的合成,并在laurefucin的合成中使用独特的生物遗传假设完成了其他卤素源无法实现的位置选择性亲电芳族取代;3)萘二酚A1全合成的高对映选择性烯烃二氯化,证明了卤化试剂在烯烃的不对称卤化方面的潜在价值(图 1)。
图 1 化学选择性卤化(图来自Snyder教授课题组主页)
2. 多环构建策略
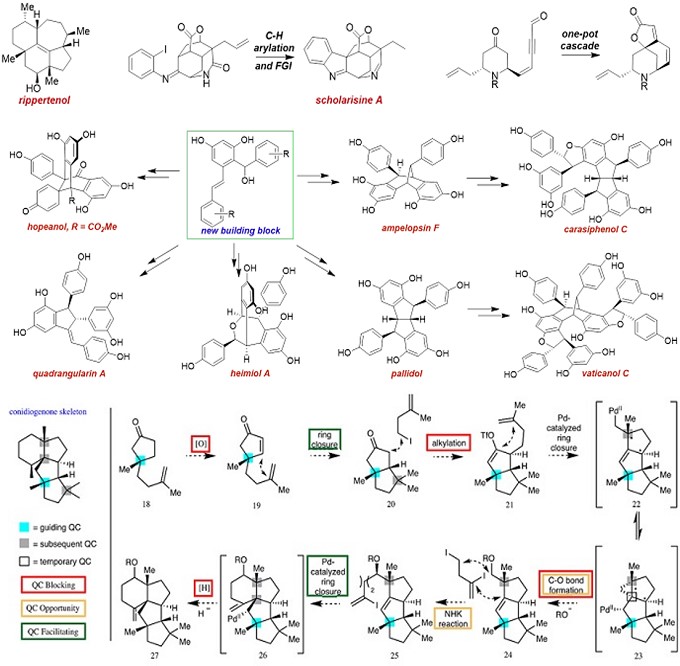
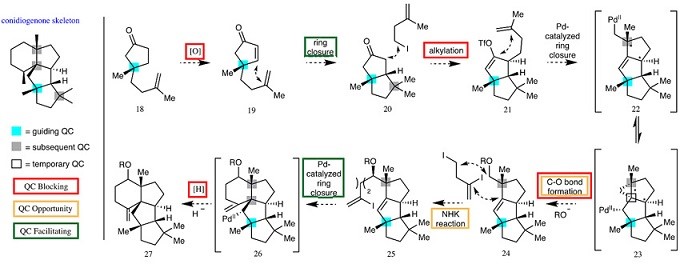
Snyder教授开发了许多用于快速构建多环的策略和方法6-8。如;1)Snyder教授羟醛缩合,Diels-Alder化学以及环扩张,以简洁和非对映体控制的方式,使用单一手性中心的化合物构建了立体化学复杂和官能团稀少的萜烯Rippertenol9;2)在研究紧凑型生物碱10(例如Scholarisine 和norsecurinines家族)时,开发了独特的C-H官能团化11,12和N-杂环卡宾诱导的串联结构13,来迅速构建多个环系统。 基于上面的工作的启发,Snyder教授希望可以为化学生物学的进一步研究提供的材料;3)开创了一种基于对不明显起始材料的识别和一些化学选择性转化以及反应级联的策略,完成了多个不同多聚天然产物家族14-18受控性(有时是克级)合成,并释放其成员进行进一步的生物学研究的障碍(Resveratrol, Rosmarinic acid, Myrmicarin, and Coccinellid家族的天然产物19);4)Snyder教授课题组发展了一种利用季碳中心高效合成萜烯类化合物的方法20-22,他们充分利用分子中的每一个季碳中心以指导其他季碳中心的构建,无需引入过多的官能团,由此简化分子的合成过程,并通过这一策略完成了conidiogenone家族化合物22的高效模块化合成(图 2)。
图 2 多环构建(图来自Snyder教授主页以及Nature)
全合成工作介绍
(1) Regioselective reactions for programmable resveratrol oligomer synthesis
Snyder, S. A., Gollner, A. & Chiriac, M. Nature, (2011) 474, 461-466, DOI: 10.1038/nature10197.
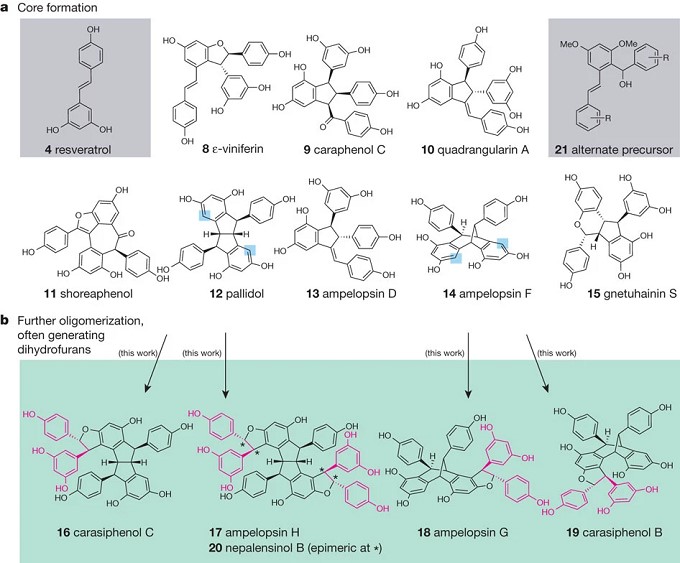
白藜芦醇是一种非黄酮类多酚化合物,是许多植物受到刺激时产生的一种抗毒素。体外实验及动物实验表明,白藜芦醇有抗氧化、抗炎、抗癌及心血管保护等作用。饱和脂肪-白藜芦醇的低聚物尽管具有很高的生物活性,但仍被广泛忽略。其被忽略的主要障碍是无法轻易从天然产物的中分离得到以及轻松地合成制备方面的挑战。Snyder教授通过三阶段设计完成了白藜芦醇家族的可编程,受控和潜在可扩展的合成天然产物全合成。合成策略和试剂指导的化学功能化作用,被用来区分多个具有相同或相似反应性的位点的两个不同核心,最终产生五个更高阶的天然产物。Snyder教授的这项工作表明:在生物合成研究另有说明的情况下,复杂材料的挑战性,位置选择性功能化是可能的,并为释放同类天然产物的生化潜力提供了有效的材料和工具。
图 3 白藜芦醇的受控性合成(来自Nature)
(2) Quaternary-centre-guided synthesis of complex polycyclic terpenes
Hu, P., Chi, H.M., DeBacker, K.C., & Snyder, S. A. Nature (2019), 569, 703-707, DOI: 10.1038/s41586-019-1179-2
季碳中心普遍存在于天然产物(如萜烯类)和药物分子中,对于天然产物的生理活性或药物的代谢稳定性具有重要影响。事实上,被不少人视为合成“搅局者”的季碳中心本身还有“带路党”属性,它的存在可促进某些结构的构建,如通过Thorpe–Ingold效应提高环化反应的速率、通过位阻效应提高反应选择性。基于季碳中心在合成中的特殊作用,Snyder教授课题组发展了一种利用季碳中心高效合成萜烯类化合物的方法,他们充分利用分子中的每一个季碳中心以指导其他季碳中心的构建,无需引入过多的官能团,由此简化分子的合成过程,并通过这一策略完成了conidiogenone家族化合物的高效模块化合成23(图 4)。
图 4 季碳中心指导复杂天然产物的全合成
其他
- Snyder教授除了科研做的好,还给研究生上现代有机合成反应,主要在天然产物全合成的背景下介绍反应实例。(课程主页:http://snyder-group.uchicago.edu/teaching.html)
- Snyder教授编写了许多教科书,如 《Classics in Total Synthesis II: More Targets, Strategies, Methods》《Orangic Chemistry》
参考文献
- [1] Zhang, Y.-A., Yaw, N. & Snyder, S. A. General Synthetic Approach for the Laurencia Family of Natural Products Empowered by a Potentially Biomimetic Ring Expansion. J. Am. Chem. Soc. (2019) 141, 7776-7788, doi:10.1021/jacs.9b01088.
- [2] Schevenels, F. T., Shen, M. & Snyder, S. A. Isolable and Readily Handled Halophosphonium Pre-reagents for Hydro- and Deuteriohalogenation. J. Am. Chem. Soc. (2017) 139, 6329-6337, doi:10.1021/jacs.6b12653.
- [3] Snyder, S. A. & Treitler, D. S. Et2SBr⋅SbCl5Br: An Effective Reagent for Direct Bromonium-Induced Polyene Cyclizations. Angew. Chem. Int. Ed. (2009) 48, 7899-7903, doi:10.1002/anie.200903834.
- [4] Snyder, S. A., Brucks, A. P., Treitler, D. S. & Moga, I. Concise Synthetic Approaches for the Laurencia Family: Formal Total Syntheses of (±)-Laurefucin and (±)-E- and (±)-Z-Pinnatifidenyne. J. Am. Chem. Soc. (2012) 134, 17714-17721, doi:10.1021/ja3076988.
- [5] Snyder, S. A., Treitler, D. S., Brucks, A. P. & Sattler, W. A General Strategy for the Stereocontrolled Preparation of Diverse 8- and 9-Membered Laurencia-Type Bromoethers. J. Am. Chem. Soc. (2011) 133, 15898-15901, doi:10.1021/ja2069449.
- [6] Lisnyak, V. G. & Snyder, S. A. A Concise, Enantiospecific Total Synthesis of Chilocorine C Fueled by a Reductive Cyclization/Mannich Reaction Cascade. J. Am. Chem. Soc. (2020) 142, 12027-12033, doi:10.1021/jacs.0c04914.
- [7] Yi, H., Hu, P. & Snyder, S. A. Development and Elucidation of a Pd-Based Cyclization–Oxygenation Sequence for Natural Product Synthesis. Angew. Chem. Int. Ed. (2020). 59, 2674-2678, doi:10.1002/anie.201913730.
- [8] Zhou, Z., Gao, A. X. & Snyder, S. A. Total Synthesis of (+)-Arborisidine. J. Am. Chem. Soc. (2019) 141, 7715-7720, doi:10.1021/jacs.9b03248.
- [9] Snyder, S. A., Wespe, D. A. & von Hof, J. M. A Concise, Stereocontrolled Total Synthesis of Rippertenol. J. Am. Chem. Soc. (2011) 133, 8850-8853, doi:10.1021/ja202859f.
- [10] Gan, P., Pitzen, J., Qu, P. & Snyder, S. A. Total Synthesis of the Caged Indole Alkaloid Arboridinine Enabled by aza-Prins and Metal-Mediated Cyclizations. J. Am. Chem. Soc. (2018), 140, 919-925, doi:10.1021/jacs.7b07724
- [11] Ye, Q., Qu, P. & Snyder, S. A. Total Syntheses of Scaparvins B, C, and D Enabled by a Key C–H Functionalization. J. Am. Chem. Soc. (2017) 139, 18428-18431, doi:10.1021/jacs.7b06185.
- [12] Smith, M. W. & Snyder, S. A. A Concise Total Synthesis of (+)-Scholarisine A Empowered by a Unique C–H Arylation. J. Am. Chem. Soc. (2013) 135, 12964-12967, doi:10.1021/ja406546k.
- [13] ElSohly, A. M., Wespe, D. A., Poore, T. J. & Snyder, S. A. An Efficient Approach to the Securinega Alkaloids Empowered by Cooperative N-Heterocyclic Carbene/Lewis Acid Catalysis. Angew. Chem. Int. Ed. (2013) 52, 5789-5794, doi:10.1002/anie.201301849.
- [14] Yang, M., Yin, F., Fujino, H. & Snyder, S. A. The Total Synthesis of Chalcitrin. J. Am. Chem. Soc. (2019), 141, 4515-4520, doi:10.1021/jacs.8b12612.
- [15] Jepsen, T. H. et al. Harnessing Quinone Methides: Total Synthesis of (±)-Vaticanol A. Angew. Chem. Int. Ed. (2014) 53, 6747-6751, doi:10.1002/anie.201402858.
- [16] Snyder, S. A., Gollner, A. & Chiriac, M. I. Regioselective reactions for programmable resveratrol oligomer synthesis. Nature , (2011), 474, 461-466, doi:10.1038/nature10197
- [17] Snyder, S. A., Breazzano, S. P., Ross, A. G., Lin, Y. & Zografos, A. L. Total Synthesis of Diverse Carbogenic Complexity within the Resveratrol Class from a Common Building Block. J. Am. Chem. Soc. (2009), 131, 1753-1765, doi:10.1021/ja806183r.
- [18] Snyder, S. A., Zografos, A. L. & Lin, Y. Total Synthesis of Resveratrol-Based Natural Products: A Chemoselective Solution. Angew. Chem. Int. Ed. (2007), 46, 8186-8191, doi:10.1002/anie.200703333.
- [19] Sherwood, T. C., Trotta, A. H. & Snyder, S. A. A Strategy for Complex Dimer Formation When Biomimicry Fails: Total Synthesis of Ten Coccinellid Alkaloids. J. Am. Chem. Soc. (2014), 136, 9743-9753, doi:10.1021/ja5045852
- [20] Peng, C., Arya, P., Zhou, Z. & Snyder, S. A. A Concise Total Synthesis of (+)-Waihoensene Guided by Quaternary Center Analysis. Angew. Chem. Int. Ed. (2020) n/a, doi:10.1002/anie.202004177.
- [21] Hu, P. & Snyder, S. A. Enantiospecific Total Synthesis of the Highly Strained (−)-Presilphiperfolan-8-ol via a Pd-Catalyzed Tandem Cyclization. J. Am. Chem. Soc. (2017) 139, 5007-5010, doi:10.1021/jacs.7b01454.
- [22] Hu, P. et al. Quaternary-centre-guided synthesis of complex polycyclic terpenes. Nature (2019), 569, 703-707, doi:10.1038/s41586-019-1179-2
- [23] Nature:从“搅局者”到“带路党”,季碳中心指导的复杂萜烯合成
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
























No comments yet.