最近明斯特大学的Glorius group报道了利用可见光氧化还原催化剂开发了位置选择性的C(sp3)-H硫代三氟甲基化反应的成果。该方法的优点是,无需使用过量的底物以及自由基清除剂。该反应中的关键是利用了安息香酸自由基作为氢转移催化剂(HAT),在温和的条件下成功进行了C(sp3)-H的活化。
“Visible-Light-Promoted Activation of Unactivated C(sp3)-H Bonds and Their Selective Trifluoromethylthiolation”
Mukherjee, S.; Maji, B.; Tlahuext-Aca, A.; Glorius, F.* J. Am. Chem. Soc. 2016, 138, 16200. DOI: 10.1021/jacs.6b09970
课题需要解决的难点
惰性的C(sp3)-H的位置选择性活化是现在有机化学领域的一个难题,同时也是竞相追逐的热点。以往,都是利用导向基或者通过底物本身的电子状态来实现一些位置选择性的C-H活化。
其中由Macmillan等人开发的利用可见光氧化还原催化剂与氢原子转移(HAT)催化剂,在温和条件下进行的C(sp3)-H反应近年来备受瞩目。但是他们使用的HAT催化剂(硫醇和奎宁环) ,它们的键解离能(BDE:Bond dissociation energy)由于具有上限,因此通常只限用于活性比较高的丙烯基位,苄基位或者杂原子的α位。
为了实现BDE更大的(sp3)-H键的C-H活化反应,Glorius等人把目光投向了苯甲酰自由基,最终利用该类化合物作为HAT催化剂克服了以往的应用限制。安息香酸的O-H键的BDE=111kcal/mol,这是一个非常高的数值,因此他们推测由这个化合物生成的苯甲酰自由基,是很有可能与惰性C-H键反应,催化反应的进行的。
具体实施手法
本催化体系在我们化学空间之前的一篇文章”由追踪反应过渡态来开发新反应”中就能看出端倪。该文章中对于光催化反应,通过荧光光谱的强度测定来筛选光催化剂与消光剂的组合(=光催化剂与合适的反应底物)[2]。
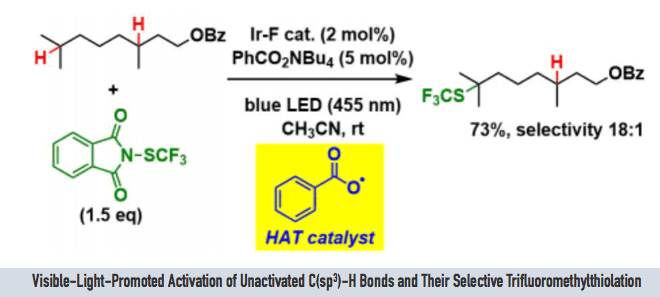
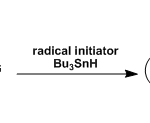
本次介绍的文章也是利用上述方法发现了Ir-F催化剂([Ir(dF(CF3)ppy)2(dtbbpy)]PF6)与安息香酸四丁基铵盐的组合。虽然安息香酸四丁基铵盐会发生脱碳酸反应分解,但是由于HAT的过程更快(苯自由基比较难形成),因此在这里该化合物可以作为HAT催化剂使用。
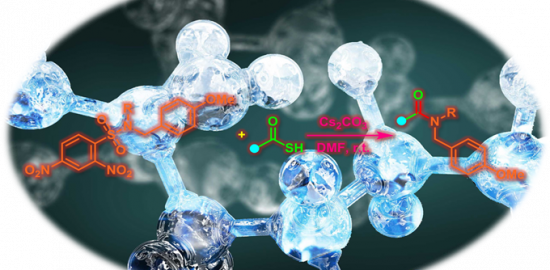
另外,作为C-H活化后生成的碳自由基的捕捉剂,作者使用了Phth-SCF3,为什么用这个试剂呢,小编在查了作者以前的研究发现该类化合物在很早以前就是作者开发的,具体请参考文献[3]。
方法的有效性验证
①条件的最优化与底物的一般性讨论
(i) 使用1 mol% Ir-F催化剂、 5 mol% HAT催化剂(安息香酸盐)同样也能得到很好的反应产率。
(ii) 可见光,光催化剂,HAT催化剂缺一不可。
(iii) BDE低的富电子的C-H优先进行反应(3 級>2 級>1 級)。
(iv) 在有多个3级C-H的底物的时候,距离吸电子基团最远的3级C-H会优先参与反应。
(v) 反应条件同样适用于环己烷、杂原子α位的C-H键。底物用量为SCF3源的2当量即可。该反应条件可以用于Late-Stage官能团化。
(vi) 带有杂原子的芳环底物也同样适用。
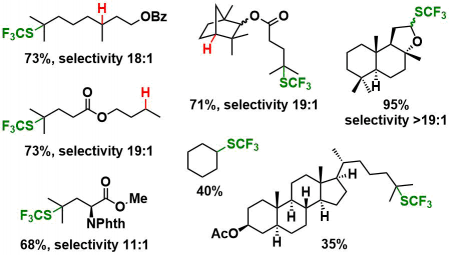
代表性底物列表
②催化循环的推理研究
(i) 观测不到光催化剂与底物,SF3源之间的消光现象。
(ii)邻苯二甲酰亚胺的N-H键虽然也具有相当高的BDE,但是由于邻苯二甲酰亚胺自由基对2级C-H与3级C-H的C-H键活化呈现不出选择性,所以可以判定该体系中邻苯二甲酰亚胺自由基是不能作为HAT催化剂发生作用的。
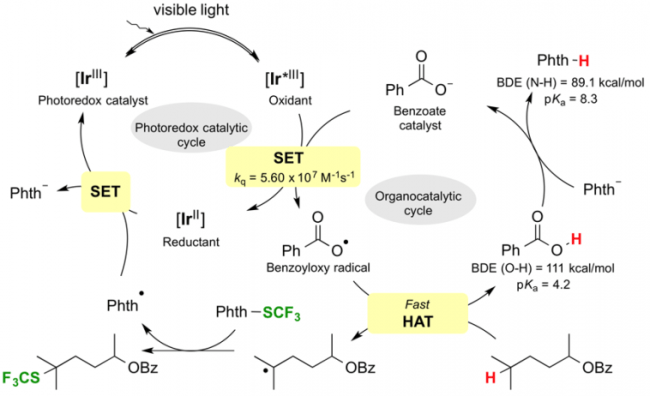
假设的催化循环(引用自论文)
文章中的几个需要注意的地方
- 羧酸作为HAT催化剂的一个比较创新性的研究,但是活性过强。该体系只能用于缺电子的底物的选择性反应,不适用与富电子的丙烯基或苄基位的C-H活化。从这一问题中可以联想到,与羧酸HAT催化剂连用的Ni催化的偶联反应,对于底物的限制性还是很强。
- 该反应设计中的一个非常巧妙的地方是,利用了吸电子的SCF3基团进行官能团化,使得产物的电子密度降低,从而有效终止后续反应的发生,只得到单官能团化的产物。
- 据说该课题组把目光放向了多肽的选择性C-H活化,对多肽的亮氨酸侧链的3级C-H键的SCF3化反应正在进行中。
关联论文?
- MacMillan等人的photoredox-HAT催化体系[1]
- 酰胺类化合物作为HAT催化剂的使用例子[4]
参考文献
- (a) Cuthbertson, J. D.; MacMillan, D. W. C. Nature 2015, 519, 74. doi:10.1038/nature14255 (b) Shaw, M. H.; Shurtleff, V. W.; Terrett, J. A.; Cuthbertson, J. D.; MacMillan, D. W. C. Science 2016, 352, 1304. doi: 10.1126/science.aaf6635
- Hopkinson, M. N.; Gómez Suárez, A.; Teders, M.; Sahoo, B.; Glorius, F. Angew. Chem. Int. Ed. 2016, 55, 4361. DOI: 10.1002/anie.201600995
- (a) Honeker, R.; Ernst, J. B.; Glorius, F. Chem. Eur. J. 2015, 21, 8047. DOI: 10.1002/chem.201500957 (b) Honeker, R.; Garza-Sanchez, R. A.; Hopkinson, M. N.; Glorius, F. Chem. Eur. J. 2016, 22, 4295. DOI: 10.1002/chem.201600190 (c) Candish, L.; Pitzer, L.; Gomez-Suarez, A.; Glorius, F. Chem. Eur. J. 2016, 22, 4753. DOI: 10.1002/chem.201600421
- Choi, G. J.; Zhu, Q.; Miller, D. C.; Gu, C. J.; Knowles, R. R. Nature 2016, 539, 268. DOI: 10.1038/nature19811
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.