作者:石油醚
导读:
近日,四川大学的秦勇教授团队在J. Am. Chem. Soc上,以 “Total Synthesis of Vilmoraconitine”为题,首次完成七环重排型C19-DTA—乌头碱Vilmoraconitine (3) 的全合成。其中,关键步骤主要涉及: 氧化脱芳构化诱导Diels-Alder环加成(oxidative dearomatization-induced Diels–Alder cycloaddition);氢化脱烯裂解/曼尼希反应(hydrodealkenylative fragmentation/Mannich sequence);分子内Diels-Alder环加成(intramolecular Diels–Alder cycloaddition)。
“Total Synthesis of Vilmoraconitine
Jiujian Ji, Jiajun Chen, Sixun Qin, Wanye Li, Jun Zhao, Guozhao Li, Hao Song, Xiao-Yu Liu*, and Yong Qin*
J. Am. Chem. Soc., 2023, 145, 3903–3908. doi: 10.1021/jacs.3c00318”
正文:
C19-二萜生物碱(C19-DTAs)是乌头类中药的主要化学成分[1],其具有显著的抗炎、镇痛、强心等生理活性。因其复杂笼状骨架、高度含氧取代等结构特征和特殊生物活性,C19-二萜生物碱的全合成引起了众多全合成小组广泛的关注。除此之外,两类具有重排骨架的C19– 二萜生物碱也从自然界中被科学家所发现,如重排I型的puberuline C (2,Figure 1)[2]和重排II型的vilmoraconitine(3)最为代表。天然产物vilmoraconitine(3) [3] 由中国科学家谭宁华教授及其同事于2008年从黄草乌(一种用于治疗风湿和疼痛的传统中药)分离获得一种新骨架二萜生物碱 (Figure 1)[1]。近日,秦勇教授首次完成七环重排II型C19-DTA—乌头碱Vilmoraconitine (3) 的全合成,并发表于J. Am. Chem. Soc上。
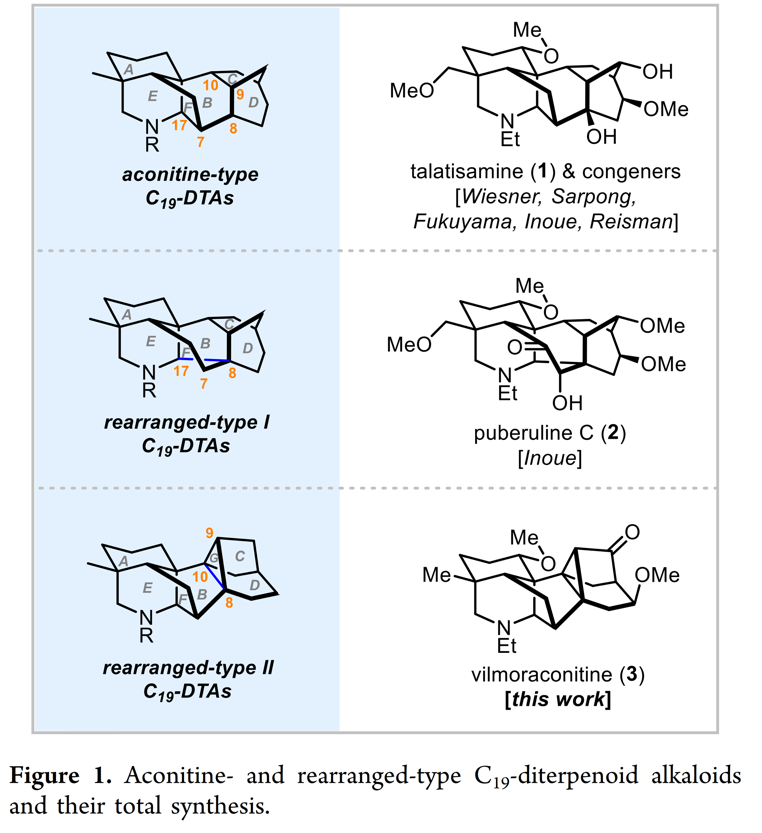
首先,乌头碱Vilmoraconitine (3)具有更复杂的七环体系,其中C8, C9和C10位形成一个独特的三元环,并且其骨架结构中含有11个立体手性中心(包括4个全碳取代的季碳中心 )。基于上述骨架,作者对Vilmoraconitine (3)进行了相关的逆合成分析(Scheme 2)。即以醛8和溴代物9为原料经偶联和氧化去芳构化/Diels-Alder环加成(OD/DA)反应[4]获得三环化合物7,7利用Kwon课题组发展的氢化脱烯裂解[5]合成醛6,醛6利用Mannich 环化反应完成天然产物的vilmoraconitine的E/F环获得四环化合物5。随后,5经Robinson环化反应合成五环中间体4。最后,4通过分子内Diels-Alder(IMDA)反应[6]一步构建关键的C/G环完成天然产物Vilmoraconitine (3)的全合成。
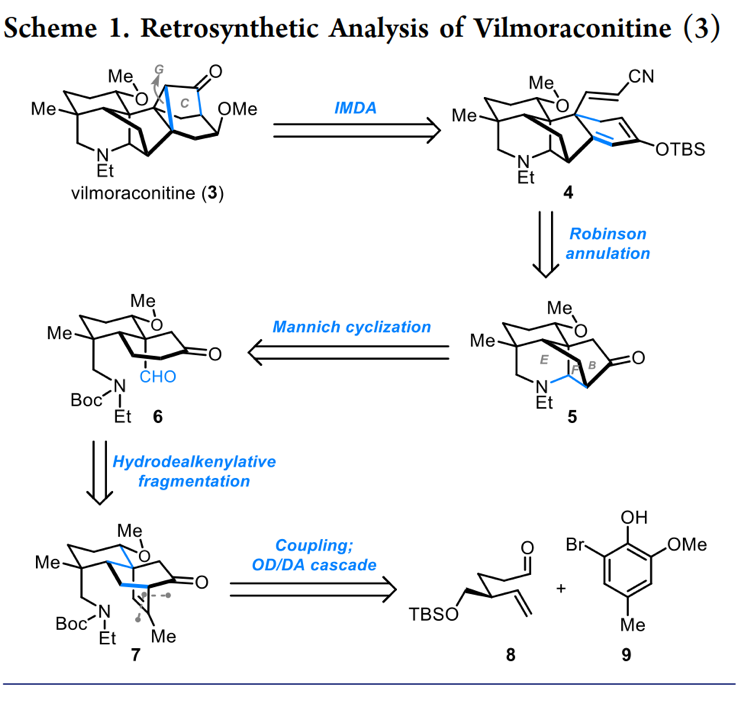
该小组完成了Vilmoraconitine (3)的合成路线设计,如Scheme 2。
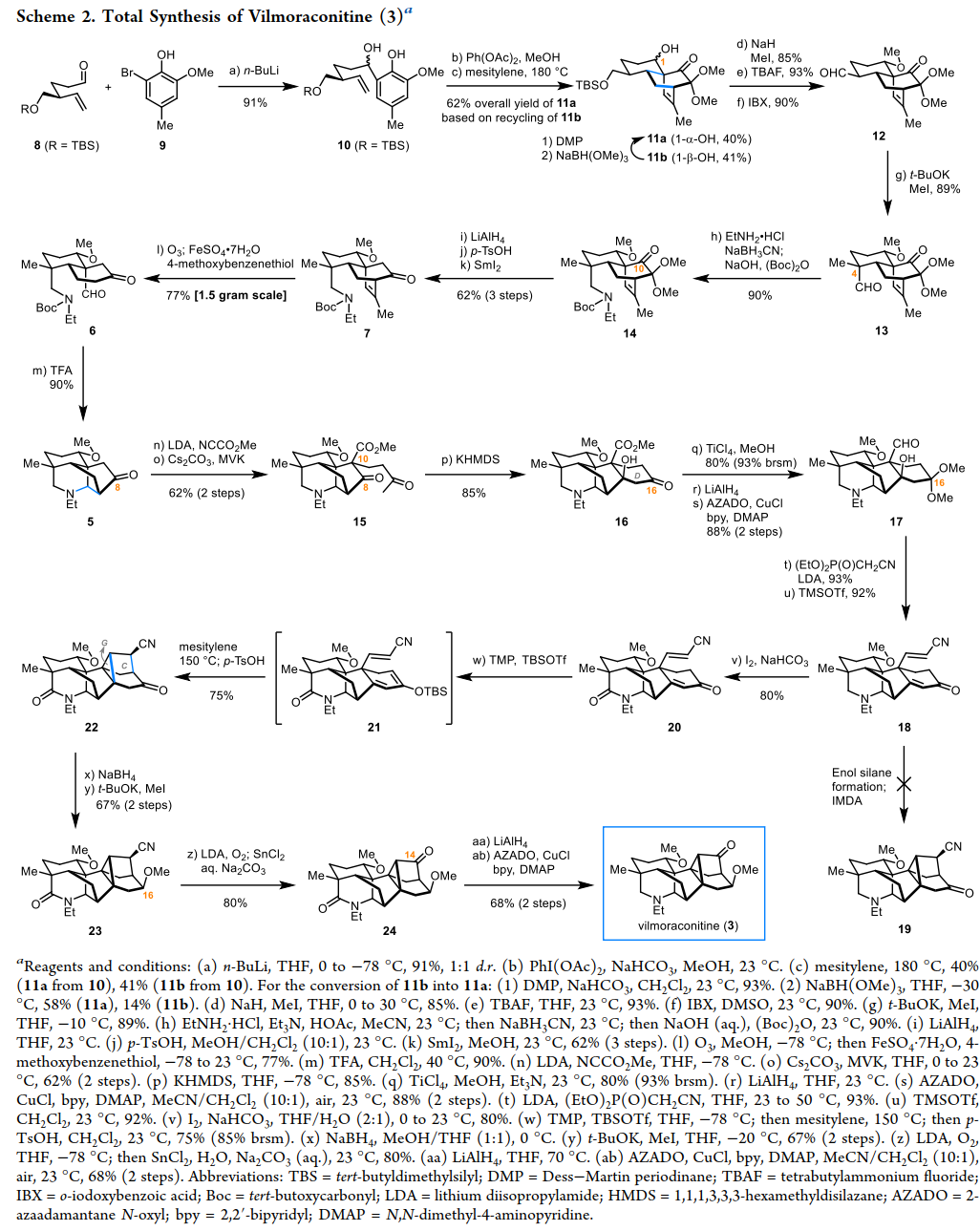

总结,秦勇教授团队首次完成七环重排II型C19-DTA—乌头碱Vilmoraconitine (3) 的全合成。其中,关键步骤主要涉及: 氧化脱芳构化诱导Diels-Alder环加成(oxidative dearomatization-induced Diels–Alder cycloaddition);氢化脱烯裂解/曼尼希反应(hydrodealkenylative fragmentation/Mannich sequence);分子内Diels-Alder环加成(intramolecular Diels–Alder cycloaddition)。
参考文献:
- [1]F.-P. Wang, Q.-H. Chen, in The Alkaloids: Chemistry and Biology, Vol. 69 (Ed.: G. A. Cordell), Academic Press, 2010, pp. 1-577.
- [2] L.-M. Sun, H.-L. Huang, W.-H. Li, Z.-D. Nan, G.-X. Zhao, C.-S. Yuan, Helv. Chim. Acta. 2009, 92, 1126. doi:10.1002/hlca.200800425.
- [3] J. Xiong, N.-H. Tan, C.-J. Ji, Y. Lu, N.-B. Gong, Tetrahedron Lett. 2008, 49, 4851. doi: 10.1016/j.tetlet.2008.06.008.
- [4] Y.-K. Chen, R. K. Peddinti, C.-C. Liao, Chem. Commun. 2001, 1340. doi: 10.1039/B103440P.
- [5] A. J. Smaligo, M. Swain, J. C. Quintana, M. F. Tan, D. A. Kim, O. Kwon, Science 2019, 364, 681. doi: 10.1126/science.aaw4212.
- [6] S. M. Ng, C. M. Beaudry, D. Trauner, Org. Lett. 2003, 5, 1701. doi: 10.1021/ol0343414.
- [7] A. Clerici, N. Pastori, O. Porta, Tetrahedron 2001, 57, 217. doi: 10.1016/S0040-4020(00)01001-2.
- [8] S. J. Selikson, D. S. Watt, J. Org. Chem. 1975, 40, 267. doi: 10.1021/jo00890a032.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.

















No comments yet.