本文作者 孙苏赟
接上篇 碳碳双键的形成 第二部分
- Peterson烯烃合成法
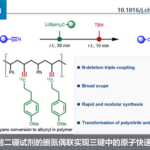
β-羟基硅烷可以自发的发生消除反应而得到双键,这就是Peterson烯烃合成法。
a. β-羟基硅烷的制备
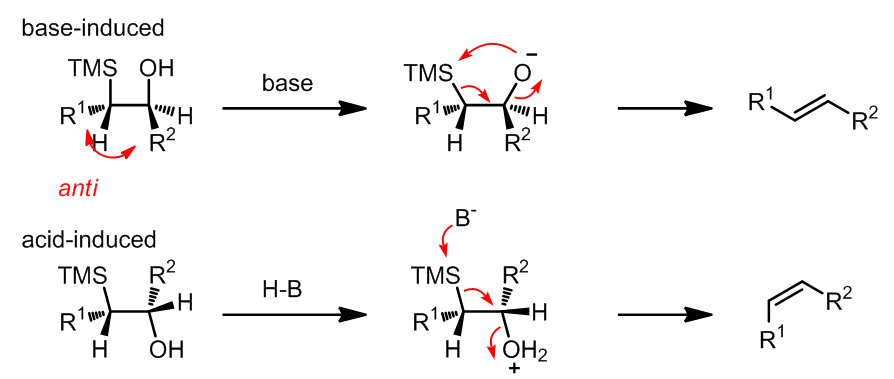
b. 反应的立体化学
对于反应条件的选择可以实现产物构形的完全控制。
c. 反应的实例
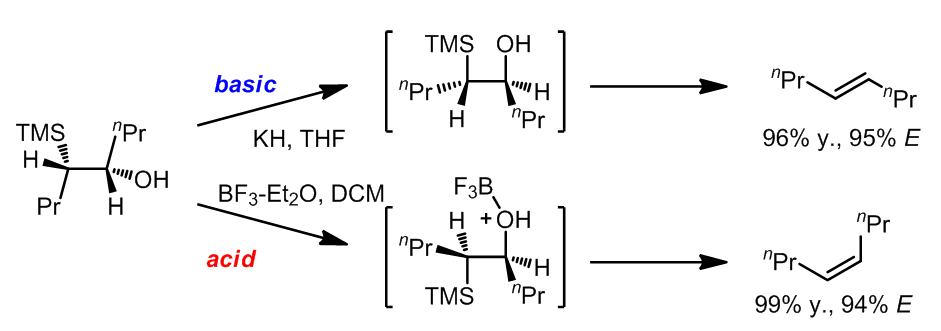
(1) 酸碱不同的条件下分别得到不同构形的产物 (ref. 1):
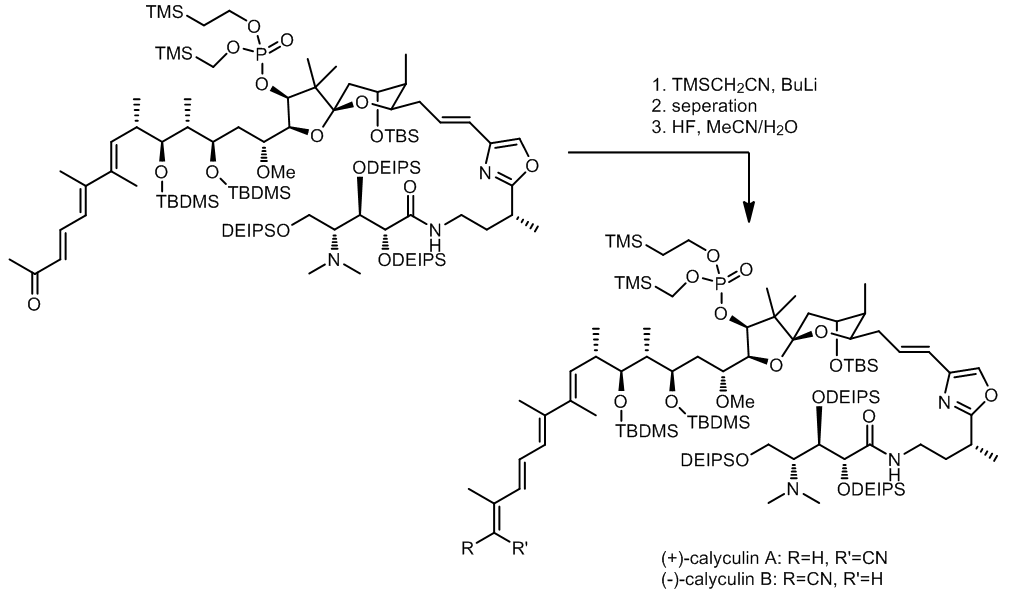
(2) 在calyculin A和calyculin B合成的最后一步生成双键 (ref. 2):
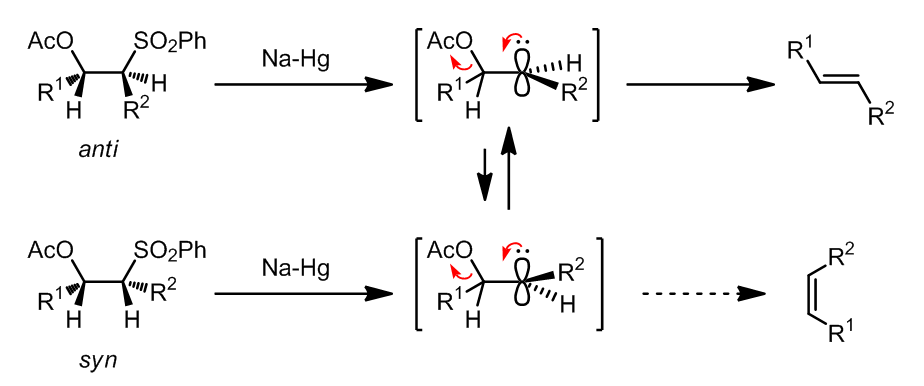
(3) β-硅烷化合物产生的anti-中间体的原因可能是因为消除过程中碱促使发生了syn-消除 (ref. 3):
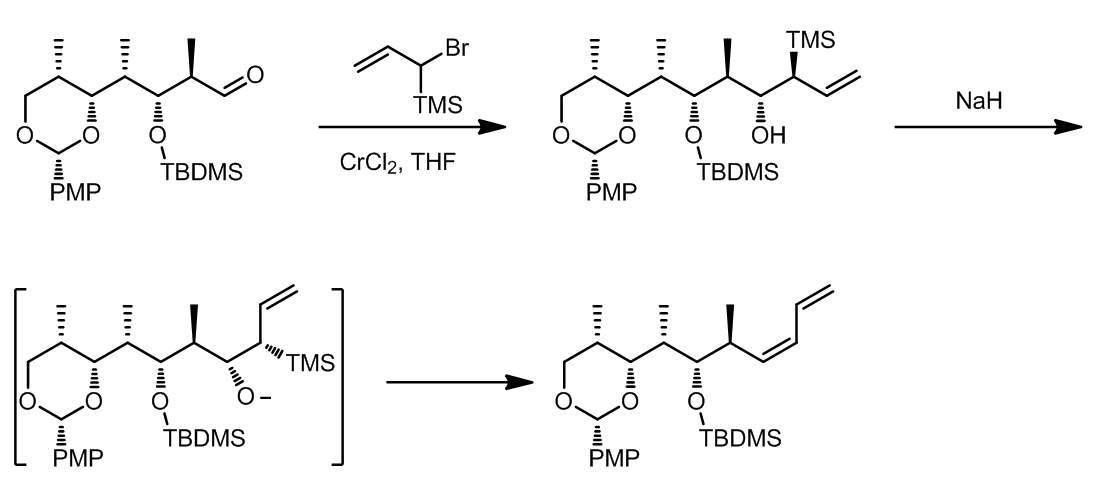
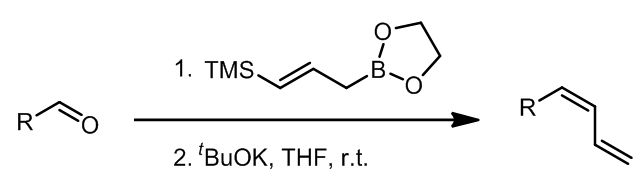
(4) 这是一个连续的烯丙基化-Peterson烯合成法的反应 (ref. 4)
(5) 硅基肟对于醛的延长碳链非常有用,将肟水解成醛又将得到一个反应的活性位点:(ref. 5)
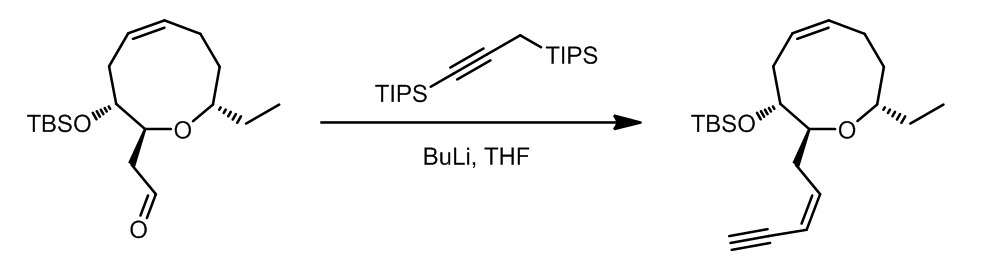
(6) 利用Peterson反应合成烯炔 (ref. 6):
- 基于β-羟基砜的方法
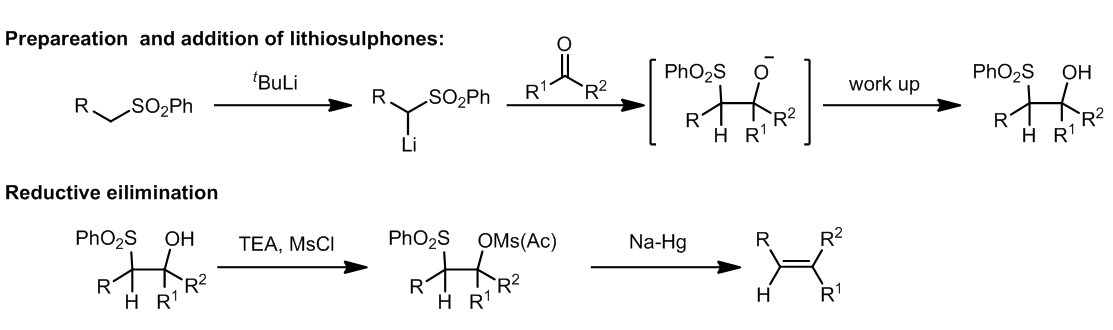
砜的α-锂盐可以和醛酮反应得到β-羟基砜类化合物,这些化合物中包含了一个新形成的C-C键,而座位烯烃合成的关键中间体,它可以发生一下反应:
i. Julia-Lythgoe烯烃合成法
β-羟基砜可以转化成为对应的乙酸酯或是磺酸酯,再利用Na-Hg齐发生还原消除反应就可以得到烯烃。这个反应是具有区域选择性的,并且可以用于生成二取代,三取代甚至是四取代的烯烃。
这个反应可以高度转移的得到二取代的E烯烃。很明显,反应过程中是生成碳负离子再发生消除反应,这个过程中SmI2可以用来代替Na-Hg齐。
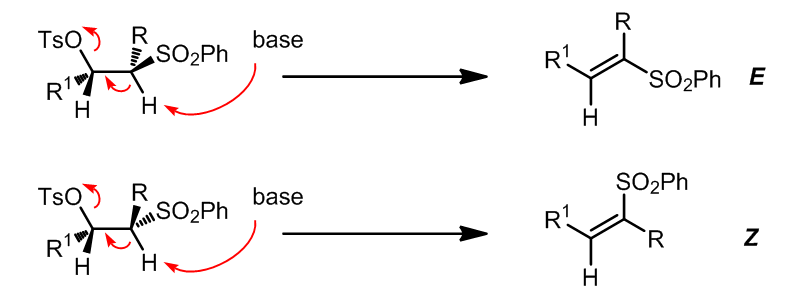
另一个可以替代的反应:立体专一的发生反式E2消除
实例:
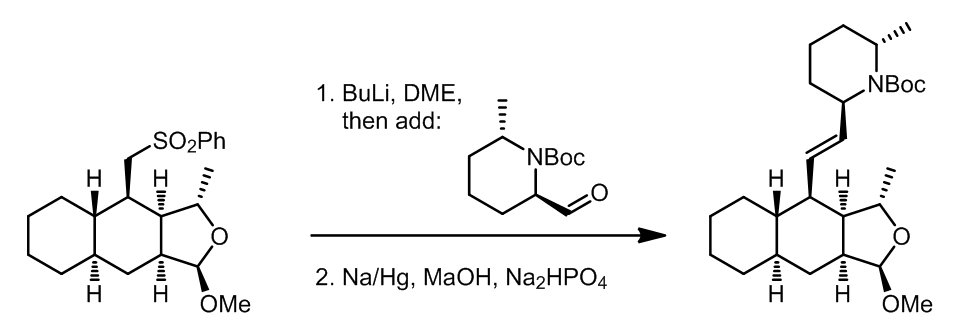
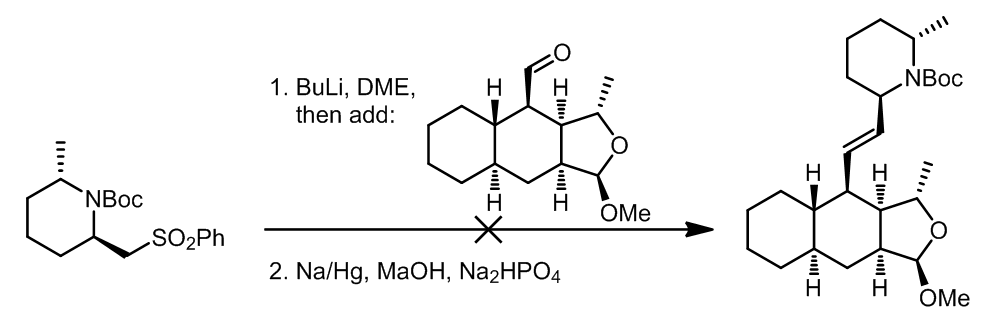
x值得注意的是,将反应底物“倒置”过来是不能发生的,可能的原因是醛的位阻太大了:
ii. Julia-Kocienski“一锅”烯烃合成法
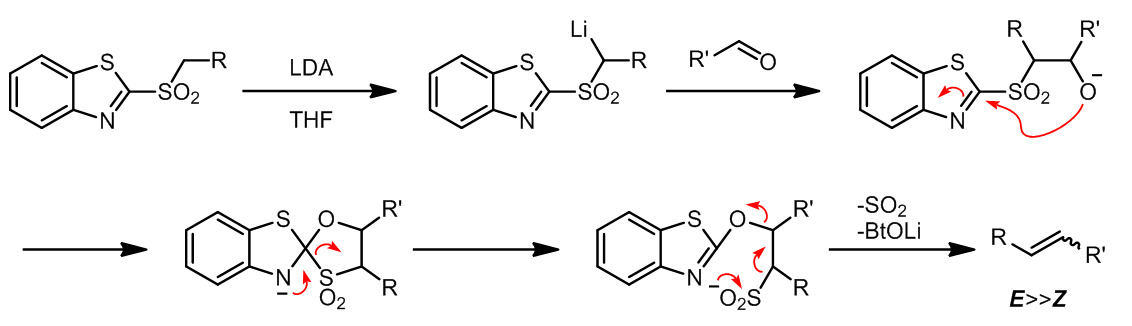
苯并噻唑砜离子可以发生一步法生成烯烃的反应,反应的立体选择性通常和具体的反应条件有关。(ref. 7)
苯并噻唑 (Bt)是这个反应的关键,从机理上看氧离子进攻C=N之后发生S-O转移,最后挤出SO2分子。
例如:
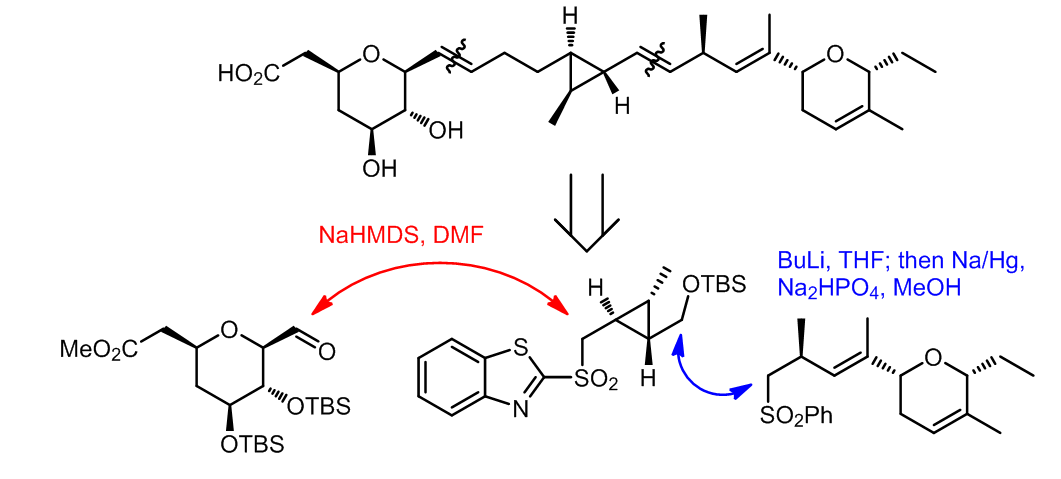
(1) ref. 8
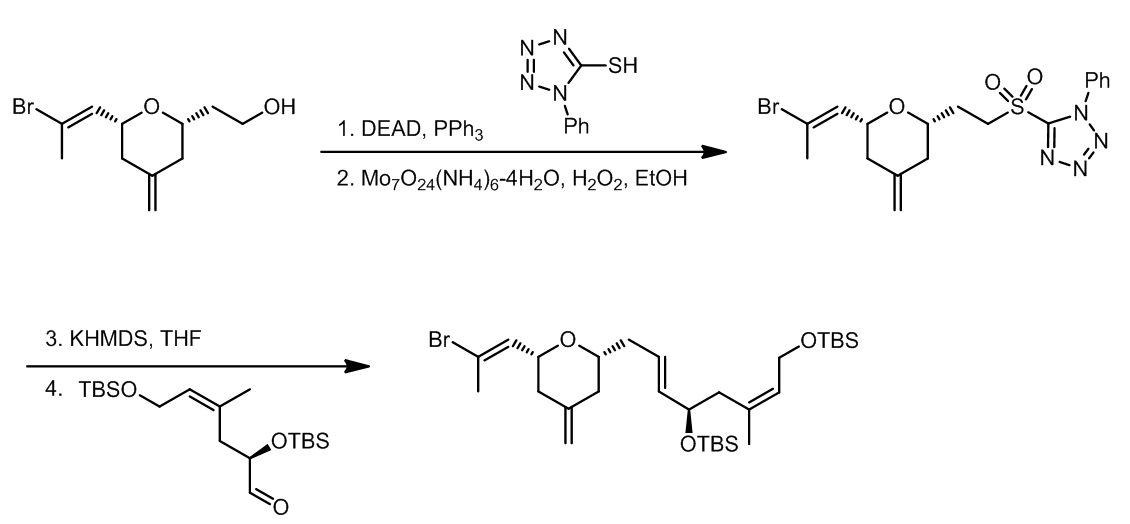
(2) 这是一个Kocienski改进的Julia烯合成法的反应,反应先通过Mutsunobu反应得到砜化合物,再进行双键的形成。其中,芳香基团是苯代四氮唑,这个芳基可以得到更高选择性的产物体系:ref. 9
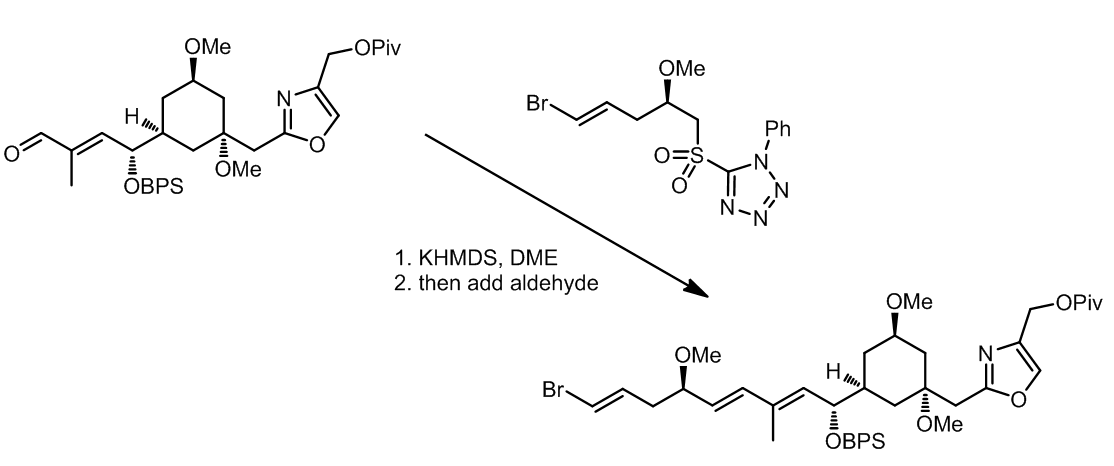
(3) 在这个例子中产物更加倾向于形成Z,E-二烯的结构,而在光照作用下可以进行双键的异构化得到E,E-二烯烃:ref. 10
REFERENCE
- J. Org. Chem., 1968, 33 (2), pp 780–784, DOI: 10.1021/jo01266a061
- J. Org. Chem., 1998, 63 (22), pp 7596–7597, DOI: 10.1021/jo981813x
- J. Org. Chem., 1998, 63 (3), pp 817–823, DOI: 10.1021/jo971900+
- J. Org. Chem., 1986, 51 (5), pp 635–648, DOI: 10.1021/jo00355a013
- J. Am. Chem. Soc., 2000, 122 (16), pp 3830–3838, DOI: 10.1021/ja994285v
- J. Am. Chem. Soc., 2002, 124 (51), pp 15196–15197, DOI: 10.1021/ja028936q
- Tetrahedron Lett., 1991, 32, 1175, DOI: 1016/S0040-4039(00)92037-9
- J. Am. Chem. Soc., 2001, 123 (49), pp 12432–12433, DOI: 10.1021/ja011867f
- J. Am. Chem. Soc., 2001, 123 (49), pp 12426–12427, DOI: 10.1021/ja012220y
- Org. Lett., 2000, 2 (19), pp 3023–3026, DOI: 10.1021/ol0063656
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.